1 . 一氧化二氯( )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:
实验室制备原理: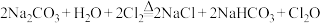
现用如图所示装置设计实验制备少量 ,并探究相关物质的性质。
,并探究相关物质的性质。

(1)装置A中仪器X的名称为________ ,写出装置A中的反应方程式________ 。
(2)若气体从左至右流动,则装置的连接顺序是A、________ 。(每个装置限用一次)
(3)装置F中盛装试剂的名称为________ 。装置E中无水氯化钙的作用________ 。
(4)装置中浓硫酸的作用________ 。写出 与
与 反应的离子方程式
反应的离子方程式________ 。
(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:________ 。
(6)已知 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式________ 。
 )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:物理性质 | 化学性质 |
常温下, |
|
现用如图所示装置设计实验制备少量
 ,并探究相关物质的性质。
,并探究相关物质的性质。
(1)装置A中仪器X的名称为
(2)若气体从左至右流动,则装置的连接顺序是A、
(3)装置F中盛装试剂的名称为
(4)装置中浓硫酸的作用
 与
与 反应的离子方程式
反应的离子方程式(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:
(6)已知
 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式
您最近半年使用:0次
名校
2 . NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的化学方程式是:  +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是
 +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是A.该反应中 被还原 被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1molNaNO3需消耗0.4molKMnO4 |
| D.横线中的粒子是OH- |
您最近半年使用:0次
2022-07-26更新
|
551次组卷
|
45卷引用:西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题
西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题(已下线)2013届浙江省宁波市效实中学高三上学期期中考试化学试卷(已下线)2014届福建省南侨中学等五校高中毕业班期末摸底考试化学试卷(已下线)2014高考化学名师知识点精编 专题4氧化还原反应练习卷2016届湖南省益阳市箴言中学高三上学期第二次模拟测试化学试卷2017届新疆兵团农二师华山中学高三上学前考试化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷天津市和平区2017-2018学年高一上学期期中质量调查化学试题辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题2018-2019学年人教版高中化学必修一模块综合测评题(A)2018-2019学年苏教版高中化学必修一 模块综合测评(A)河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题(已下线)专题2.3 氧化还原反应(练)-《2020年高考一轮复习讲练测》黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题云南省漾濞二中2020届高三上学期开学考试化学试题江西省赣州市寻乌中学2020届高三上学期第一阶段考试化学试题(已下线)专题四 氧化还原反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)衔接点09 氧化还原反应的表示-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)考试帮 模块综合测评B卷人教版(2019)高一必修第一册 模块综合测评-B卷贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题江西省上饶市万年中学2020-2021学年高一上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练湖南省武冈市第二中学2020-2021学年高一上学期第一次月考化学试题(已下线)衔接点09 氧化还原反应的表示-2021年初升高化学无忧衔接黑龙江省哈尔滨市第六中学2021-2022学年高三上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)4.2.2 氧化还原反应方程式的配平(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)黑龙江省哈尔滨市第九中学2021-2022学年高一上学期期中学业阶段性评价考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题01 物质及其变化-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省佳木斯市第八中学2022-2023学年高三上学期第一次调研(开学考试)化学试题黑龙江省哈尔滨市香坊区第九中学校2021-2022学年高一上学期期中考试化学试题西藏林芝市第二高级中学2022-2023学年高三上学期第二次月考化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省枣庄市第三中学2022-2023学年高一上学期12月期中考试化学试题宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题黑龙江省齐齐哈尔市龙西北高中名校联盟2023-2024学年高三上学期10月联考化学试题江西省南昌市第十九中学2022-2023学年高一上学期12月第二次月考化学试卷
名校
3 . 砷(As)与N、P是同主族元素,远古时期人们就开始开发利用砷的性质,现代技术中砷仍然起着非常重要的作用。请回答下列问题:
(1)砷只有一种稳定的同位素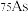 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多_______ (填数值)。
(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
(3)Marsh试砷法和Gutzeit试砷法是法医学上鉴定砷的重要方法。其原理是先将 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。
① 的电子式为
的电子式为_______ 。
②Gutzeit试砷法中 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为_______ ;砷化镓也可用于制造太阳能电池,该电池工作时的能量转化形式为_______ 。
(5)已知 的电离平衡常数分别为
的电离平衡常数分别为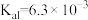 、
、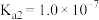 、
、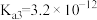 。
。
①25℃时,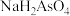 ,溶液中:
,溶液中: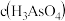
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②25℃时,向 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中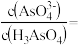
_______ 。
(1)砷只有一种稳定的同位素
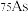 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
A.沸点: |
B.等物质的量浓度溶液的酸性: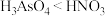 |
C.分解温度: |
D.相对分子质量: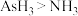 |
 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。①
 的电子式为
的电子式为②Gutzeit试砷法中
 被氧化的离子方程式为
被氧化的离子方程式为(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用
 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为(5)已知
 的电离平衡常数分别为
的电离平衡常数分别为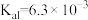 、
、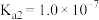 、
、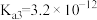 。
。①25℃时,
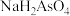 ,溶液中:
,溶液中: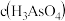
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②25℃时,向
 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中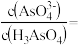
您最近半年使用:0次
2021-12-06更新
|
628次组卷
|
3卷引用:西藏拉萨中学2022届高三第七次月考理综化学试题
名校
4 . 在酸性环境中,纳米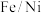 复合材料去除污染水体的
复合材料去除污染水体的 的反应过程(Ni不参与反应)如图所示:
的反应过程(Ni不参与反应)如图所示:
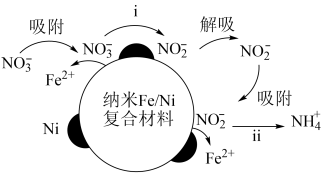
下列表达反应过程或现象的方程式错误的是
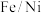 复合材料去除污染水体的
复合材料去除污染水体的 的反应过程(Ni不参与反应)如图所示:
的反应过程(Ni不参与反应)如图所示:
下列表达反应过程或现象的方程式错误的是
A.反应步骤ⅰ: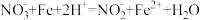 |
B.反应步骤ⅱ: |
C.反应进行一段时间,过滤出水体中出现的白色絮状物,白色絮状物在空气中最终变成红褐色: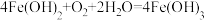 |
D.硝酸亚铁溶液中滴加稀硫酸发现溶液变黄: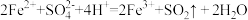 |
您最近半年使用:0次
2021-06-03更新
|
1414次组卷
|
14卷引用:西藏拉萨中学2021届高三第八次月考理综化学试题
西藏拉萨中学2021届高三第八次月考理综化学试题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题13 氮及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练 (已下线)专题08 铁及其化合物(限时精练)-2022年高三毕业班化学常考点归纳与变式演练天津市耀华中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-测试上海市2021-2022学年高三下学期第三次适应性测试 化学试题湖南省永州市第一中学2022-2023学年高三上学期入学考试化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专项特训2 非金属及其化合物对环境的影响宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题天津市天津中学2023-2024学年高三上学期第一次月考化学试题广东省实验中学2023-2024学年高三上学期第一次阶段考试化学试题
解题方法
5 . 硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如图所示。
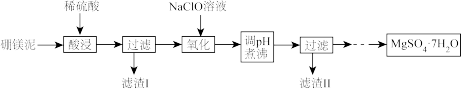
回答下列问题:
(1)硼与浓的氢氧化钠溶液在加热条件下有类似硅的反应,反应后硼元素以BO 形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:
形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:_______ 。
(2) Na2B4O7易溶于水,较易发生水解:B4O +7H2O⇌4H3BO3(硼酸) +2OH- (硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有
+7H2O⇌4H3BO3(硼酸) +2OH- (硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有_______ 、_______ (填化学式)。
(3)“氧化”过程中发生反应的离子方程式为_______ 。
(4)工艺流程中“调pH”应不低于_______ 。 (已知:常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0 ×10-33;当溶液中离子浓度小于等于1 ×10-6mol·L-1时认为该离子沉淀完全)。“煮沸”的目的是_______ 。
(5)该工艺流程中包含多次过滤操作,实验室中过滤后洗涤沉淀的操作为_______ 。
(6)我国科学家研发出以惰性电极材料电解NaBO2的碱性溶液制备NaBH4的方法。阴极产生NaBH4则阳极的电极反应式为。_______ 。

回答下列问题:
(1)硼与浓的氢氧化钠溶液在加热条件下有类似硅的反应,反应后硼元素以BO
 形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:
形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:(2) Na2B4O7易溶于水,较易发生水解:B4O
 +7H2O⇌4H3BO3(硼酸) +2OH- (硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有
+7H2O⇌4H3BO3(硼酸) +2OH- (硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有(3)“氧化”过程中发生反应的离子方程式为
(4)工艺流程中“调pH”应不低于
(5)该工艺流程中包含多次过滤操作,实验室中过滤后洗涤沉淀的操作为
(6)我国科学家研发出以惰性电极材料电解NaBO2的碱性溶液制备NaBH4的方法。阴极产生NaBH4则阳极的电极反应式为。
您最近半年使用:0次
解题方法
6 . 下列有关离子方程式的书写错误的是
A.向饱和NaCl溶液中依次通入足量NH3与CO2:Na++NH3+ CO2+ H2O=NaHCO3↓+NH |
B.向硫酸铝溶液中加入过量氨水:Al3+ +3NH3·H2O=Al(OH)3↓+ 3NH |
C.碳酸氢镁溶液与足量氢氧化钠溶液反应:Mg2++2HCO +4OH-=Mg(OH)2↓+2CO +4OH-=Mg(OH)2↓+2CO +2H2O +2H2O |
D.草酸与足量酸性高锰酸钾溶液反应:2MnO +5C2O +5C2O + 16H+=2Mn2++10CO2↑+8H2O + 16H+=2Mn2++10CO2↑+8H2O |
您最近半年使用:0次
名校
解题方法
7 .  是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备
是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备 ,并测定产品中铁的含量。
,并测定产品中铁的含量。
I.制备晶体
i.称取 5 g 莫尔盐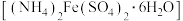 ,用 15 mL 水和几滴
,用 15 mL 水和几滴 溶液充分溶解,再加入25 mL饱和
溶液充分溶解,再加入25 mL饱和 溶液,加热至沸,生成黄色沉淀;
溶液,加热至沸,生成黄色沉淀;
ⅱ.将沉淀洗涤至中性,加入10 mL饱和 溶液,水浴加热至40℃,边搅拌边缓慢滴加
溶液,水浴加热至40℃,边搅拌边缓慢滴加 溶液,沉淀逐渐变为红褐色;
溶液,沉淀逐渐变为红褐色;
ⅲ.将混合物煮沸30 s,加入8 mL饱和 溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
II.测定产品中铁的含量
ⅳ.称量 制得的样品,加水溶解,并加入稀
制得的样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;
v.向ⅳ的溶液中加入过量Zn粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知: 为二元弱酸,具有较强的还原性
为二元弱酸,具有较强的还原性
(1)莫尔盐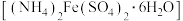 中铁元素的化合价是
中铁元素的化合价是_______ 。
(2)步骤ⅰ中黄色沉淀的化学式为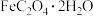 ,生成该沉淀的离子方程式是
,生成该沉淀的离子方程式是_______ 。
(3)步骤ⅱ中除了生成红褐色沉淀,另一部分铁元素转化为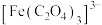 、将下述反应的离子方程式补充完整
、将下述反应的离子方程式补充完整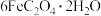 +____+____=
+____+____= ____
____ ,
,_____________ 。
(4)步骤ⅱ中水浴加热的温度不宜过高,原因是_______ 。
(5)步骤iv在铁的含量测定中所起的作用是_______ 。
(6)已知:ⅴ中Zn粉将铁元素全部还原为 ;反应中
;反应中 转化为
转化为 。则该样品中铁元素的质量分数是
。则该样品中铁元素的质量分数是_______ (用含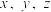 的代数式表示)。
的代数式表示)。
 是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备
是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备 ,并测定产品中铁的含量。
,并测定产品中铁的含量。I.制备晶体
i.称取 5 g 莫尔盐
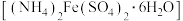 ,用 15 mL 水和几滴
,用 15 mL 水和几滴 溶液充分溶解,再加入25 mL饱和
溶液充分溶解,再加入25 mL饱和 溶液,加热至沸,生成黄色沉淀;
溶液,加热至沸,生成黄色沉淀;ⅱ.将沉淀洗涤至中性,加入10 mL饱和
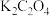 溶液,水浴加热至40℃,边搅拌边缓慢滴加
溶液,水浴加热至40℃,边搅拌边缓慢滴加 溶液,沉淀逐渐变为红褐色;
溶液,沉淀逐渐变为红褐色;ⅲ.将混合物煮沸30 s,加入8 mL饱和
 溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。II.测定产品中铁的含量
ⅳ.称量
 制得的样品,加水溶解,并加入稀
制得的样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;v.向ⅳ的溶液中加入过量Zn粉,反应完全后,弃去不溶物,向溶液中加入稀
 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:
 为二元弱酸,具有较强的还原性
为二元弱酸,具有较强的还原性(1)莫尔盐
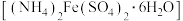 中铁元素的化合价是
中铁元素的化合价是(2)步骤ⅰ中黄色沉淀的化学式为
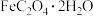 ,生成该沉淀的离子方程式是
,生成该沉淀的离子方程式是(3)步骤ⅱ中除了生成红褐色沉淀,另一部分铁元素转化为
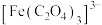 、将下述反应的离子方程式补充完整
、将下述反应的离子方程式补充完整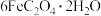 +____+____=
+____+____= ____
____ ,
,(4)步骤ⅱ中水浴加热的温度不宜过高,原因是
(5)步骤iv在铁的含量测定中所起的作用是
(6)已知:ⅴ中Zn粉将铁元素全部还原为
 ;反应中
;反应中 转化为
转化为 。则该样品中铁元素的质量分数是
。则该样品中铁元素的质量分数是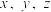 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
2020-12-19更新
|
143次组卷
|
4卷引用:西藏拉萨中学2021届高三上学期第三次月考理综化学试题
名校
8 . (1)填写关于物质的量计算的四个恒等式:n=______ =______ =______ =_______ 。
(2)已知下列四个反应:
A.2Na+2H2O=2NaOH+H2↑ B.2F2+2H2O=4HF+O2
C.Cl2+H2O=HCl+HClO D.C+H2O(g) CO+H2
CO+H2
试从氧化还原的角度,回答下列问题:
①水只作氧化剂的是________ ;
②水只作还原剂的是________ ;
③水既不作氧化剂又不作还原剂的是________ 。
(3) KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为KClO3+HCl(浓)=KCl+ClO2↑+Cl2↑+H2O。
①请配平上述化学方程式_____ 。
②产生0.1molCl2,则转移的电子的物质的量为______ mol。
(2)已知下列四个反应:
A.2Na+2H2O=2NaOH+H2↑ B.2F2+2H2O=4HF+O2
C.Cl2+H2O=HCl+HClO D.C+H2O(g)
 CO+H2
CO+H2试从氧化还原的角度,回答下列问题:
①水只作氧化剂的是
②水只作还原剂的是
③水既不作氧化剂又不作还原剂的是
(3) KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为KClO3+HCl(浓)=KCl+ClO2↑+Cl2↑+H2O。
①请配平上述化学方程式
②产生0.1molCl2,则转移的电子的物质的量为
您最近半年使用:0次
2020-09-29更新
|
74次组卷
|
2卷引用:西藏自治区拉萨市拉萨中学2020-2021学年高二第一次月考理综化学试题
9 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
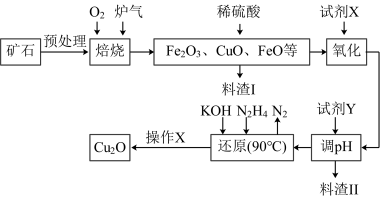
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是__________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________ 。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________ 。当试剂X是______ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________ 。
(4)写出用N2H4制备Cu2O的化学方程式:________ ,操作X包括_________ 、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________ 。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:
(3)加入试剂Y调pH时,pH的调控范围是
(4)写出用N2H4制备Cu2O的化学方程式:
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:
您最近半年使用:0次
2020-03-16更新
|
674次组卷
|
11卷引用:西藏自治区拉萨市拉萨中学2020届高三第六次月考理科化学试题
西藏自治区拉萨市拉萨中学2020届高三第六次月考理科化学试题【市级联考】河南省安阳市2019届高三下学期二模考试理科综合化学试题重庆市云阳江口中学校2020届高三上学期第二次月考理综化学试题2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存2020届人教版高三化学二轮复习非选择题专攻练——工艺流程云南省楚雄州禄丰县第一中学2020届高三下学期3月线上模拟考试理综化学试题山东省2020届高三模拟考试化学(二)山西省运城市稷山县第二中学2020届高三上学期第三次月考化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题云南省大理州祥云四中2020届高三下学期3月线上模拟考试理综化学试题四川省内江市威远中学2021-2022学年高三上学期第三次月考化学试题
名校
解题方法
10 . 二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
① 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体
② 与KI反应的离子方程式为:
与KI反应的离子方程式为: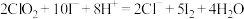 。
。
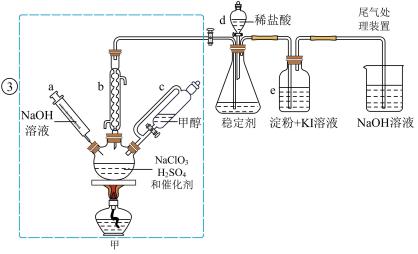
(1)仪器b在装置中的作用是______________ ;比较仪器c和d,实验中c的优点是_____________ 。
(2)制备装置甲中需改进的一项措施是________________ 。
(3)反应中甲醇被氧化为甲酸,写出制备 的化学方程式:
的化学方程式:________________ ;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________________ 。
(4)下列有关说法正确的是__________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的
B.装置e主要用于检验是否有 生成
生成
C.在 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: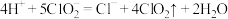
D. 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍
(5)自来水厂用碘量法检测水中 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL  标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为__________  。
。
 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。已知:
①
 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体②
 与KI反应的离子方程式为:
与KI反应的离子方程式为: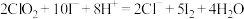 。
。| 物质 |  |  |  |
| 沸点 | 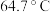 | 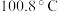 | 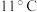 |

(1)仪器b在装置中的作用是
(2)制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备
 的化学方程式:
的化学方程式:(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的

B.装置e主要用于检验是否有
 生成
生成C.在
 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: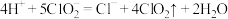
D.
 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍(5)自来水厂用碘量法检测水中
 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL 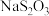 标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为 。
。
您最近半年使用:0次
2020-02-27更新
|
950次组卷
|
8卷引用:西藏拉萨中学2021届高三上学期第四次月考理综化学试题



