1 . 立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________ (填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
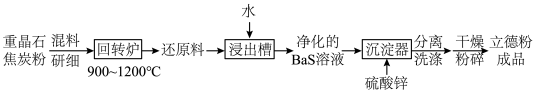
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________ 。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________ 。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________ (填化学式)。
③沉淀器中反应的离子方程式为______________________ 。
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2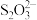 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________ ,样品中S2−的含量为______________ (写出表达式)。
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的
③沉淀器中反应的离子方程式为
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2
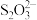 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
您最近半年使用:0次
2019-06-09更新
|
16071次组卷
|
25卷引用:西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题
西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题2019年全国统一考试化学试题(新课标Ⅱ)2020届人教版高三化学二轮复习非选择题专攻练——工艺流程专题3.1 金属及其化合物(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(精讲)——2021年高考化学一轮复习讲练测河南省南阳市2021届高三期中质量评估化学试题专题4 第二单元 综合拔高练-高中化学苏教2019版必修第一册(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练河南省南阳市2021届高三上期期中考试化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)湖北省安陆市第一高级中学2021-2022学年高一下学期开学考试化学试题福建省龙岩第一中学2021-2022学年高二上学期第二次月考化学试题(实验班)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题18 工艺流程题(已下线)T26-工业流程题
名校
2 . 钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
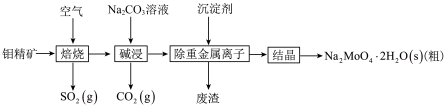
(1)Na2MoO4·2H2O中钼元素的化合价是___________ 。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________ (填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________ 。
(3)写出“碱浸”反应的离子方程式:_____ 。为了能提高该反应速率,可采取的措施有_____ 。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________ %[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
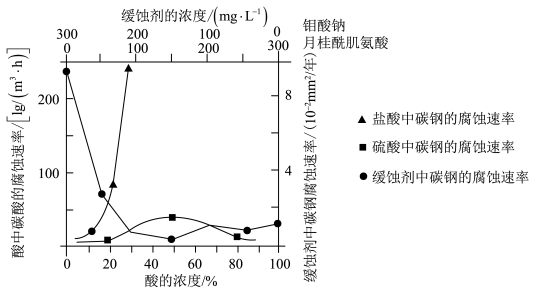
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________ 。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________ 。

(1)Na2MoO4·2H2O中钼元素的化合价是
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是
(3)写出“碱浸”反应的离子方程式:
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是
您最近半年使用:0次
2019-04-24更新
|
570次组卷
|
4卷引用:西藏林芝市第一中学2019-2020学年高三第四次月考化学试题
3 . 铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(主要含BeO、CuS,还含少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
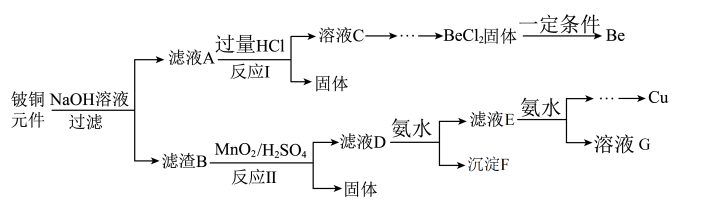
已知:i.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。
ii.常温下:Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。
回答下列问题:
(1)滤液A的主要成分除NaOH外,还有___________ (填化学式);写出反应I中含铍化合物与过量盐酸反应的离子方程式:___________ 。
(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是___________ ;电解熔融BeCl2制备金属铍时,需要加入NaCl,其作用是___________ 。
①加入过量的NaOH:②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。
(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为___________ 。
(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是________ (填化学式);为了尽可能多的回收铜,所得滤液G的pH最大值为___________ 。

已知:i.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。
ii.常温下:Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。
回答下列问题:
(1)滤液A的主要成分除NaOH外,还有
(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是
①加入过量的NaOH:②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。
(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为
(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是
您最近半年使用:0次
2019-03-27更新
|
1161次组卷
|
7卷引用:西藏日喀则市上海实验学校2020-2021学年高三下学期第二次模拟考试理综化学试题
西藏日喀则市上海实验学校2020-2021学年高三下学期第二次模拟考试理综化学试题【市级联考】安徽省合肥市2019届高三下学期第二次教学质量检测理科综合化学试题湖南省株洲市攸县第四中学2018-2019学年高二下学期第一次月考化学试题(已下线)四川省成都外国语学校2018-2019学年高二下学期期中考试化学试题四川师范大学附属中学2021届高三12月月考理综化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)04 无机化工流程题(4) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
4 . 元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________ 。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:
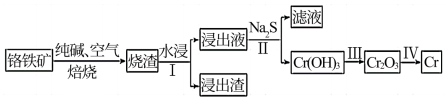
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________ 。
②水浸Ⅰ要获得浸出液的操作是___________ 。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________ 。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________ [c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。
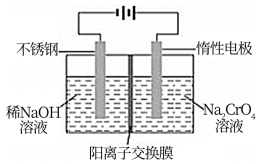
①阳极的电极反应式为___________ 。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________ mol。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是
②水浸Ⅰ要获得浸出液的操作是
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。

①阳极的电极反应式为
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为
您最近半年使用:0次
2019-02-05更新
|
736次组卷
|
3卷引用:西藏自治区昌都市第一高级中学2020届高三下学期第一次模拟考试理综化学试题
解题方法
5 . 本题为《化学与生活(选修1)》选做题。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
(2)矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于_____________ (填“可回收物”或“可堆肥垃圾”);
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式_____________ 。
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是__________

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
(6)化学与生活关系密切。现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①__________ 是重要的体内能源;
②__________ 广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
(8) “辽宁号”航母的服役举世瞩目。钢铁是制造航母的主要材料。生铁和钢成分上的主要差别是_________;
(9)钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为__________ 。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
| A.科学合理使用农药 | B.任意排放化工厂废水 | C.处理生活污水,达标排放 |
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
| A.吸烟会对室内和公共场所造成污染 |
| B.吸入焦油、尼古丁及颗粒物可导致多种病变 |
| C.N2、CO2、CO尼古丁和都属于室内空气污染物 |
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①
②
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
| A.玻璃 | B.陶瓷 | C.水泥 |
| A.碳的含量不同 |
| B.磷、硫的含量不同 |
| C.镍、铬等金属含量不同 |
您最近半年使用:0次
2019-01-30更新
|
80次组卷
|
2卷引用:2015-2016学年西藏日喀则一中高二6月月考化学试卷
6 . 有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知在酸性溶液中,NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
(1)上述反应中氧化剂是__________ 。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 , 你认为下列几组合适的是__________ (填选项)。
A.③⑤ B.①②④ C.①②⑤ D.①②
(3)某厂废液中,含有2%——5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是____________ 。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:
( ) Al+( ) NaNO3+( ) NaOH=( ) NaAlO2+( ) N2↑+( ) H2O。
若反应过程中转移1mol e—,则生成标准状况下N2的体积为___________ L。
(1)上述反应中氧化剂是
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 , 你认为下列几组合适的是
A.③⑤ B.①②④ C.①②⑤ D.①②
(3)某厂废液中,含有2%——5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:
若反应过程中转移1mol e—,则生成标准状况下N2的体积为
您最近半年使用:0次
7 . (1)实验室由Al盐制备Al(OH)3最佳选择NH3·H2O,其离子反应方程式:____________________________
(2)12.4g Na2X含有0.4mol Na+, Na2X的摩尔质量为________ 。
(3)由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为_________
(4)已知 离子可与R2-离子反应,R2-被氧化为R单质,
离子可与R2-离子反应,R2-被氧化为R单质, 的还原产物中M为+3价;又已知100mL c(
的还原产物中M为+3价;又已知100mL c( )=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为
)=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为__________
A.4 B.5 C.6 D.7
(2)12.4g Na2X含有0.4mol Na+, Na2X的摩尔质量为
(3)由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为
(4)已知
 离子可与R2-离子反应,R2-被氧化为R单质,
离子可与R2-离子反应,R2-被氧化为R单质, 的还原产物中M为+3价;又已知100mL c(
的还原产物中M为+3价;又已知100mL c( )=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为
)=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为A.4 B.5 C.6 D.7
您最近半年使用:0次
名校
8 . 铁及其化合物之间的相互转化可用下式表示:
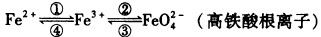
回答下列有关问题:
(1)Fe2O3中铁元素化合价为___________ ,实现④的转化需加入___________ (填“氧化剂”或“还原剂”)。
(2)配平下面的缺项方程式
_____ FeCl3 +_____ Cl2+___□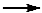 _____ Na2FeO4+ _____ NaCl +_____H2O
_____ Na2FeO4+ _____ NaCl +_____H2O
(3)已知下列反应可以发生:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,
Cl2+2Fe2+=2Cl-+2Fe3+
由上述反应可知氧化性:Co2O3_______ (填“>”或“<”) Fe3+,
下列离子反应错误的是_______ 。
a. Co2O3+6H++2 Fe2+=2Co2++2Fe3++3H2O
b. SO42-+2Cl-+2H+=Cl2↑+SO32-+H2O
c. Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
(4)A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
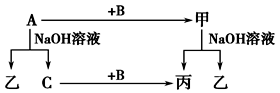
根据图示转化关系回答:
写出A与NaOH溶液反应的离子方程式________________________________ 。
写出A+Fe3O4→甲的化学方程式________________________________ 。
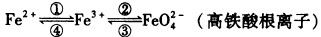
回答下列有关问题:
(1)Fe2O3中铁元素化合价为
(2)配平下面的缺项方程式
 _____ Na2FeO4+ _____ NaCl +_____H2O
_____ Na2FeO4+ _____ NaCl +_____H2O(3)已知下列反应可以发生:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,
Cl2+2Fe2+=2Cl-+2Fe3+
由上述反应可知氧化性:Co2O3
下列离子反应错误的是
a. Co2O3+6H++2 Fe2+=2Co2++2Fe3++3H2O
b. SO42-+2Cl-+2H+=Cl2↑+SO32-+H2O
c. Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
(4)A、B、C是单质,其中A是金属,各种物质间的转化关系如图:

根据图示转化关系回答:
写出A与NaOH溶液反应的离子方程式
写出A+Fe3O4→甲的化学方程式
您最近半年使用:0次
名校
9 . 铁是人类较早使用的金属之一。运用铁及其化合物有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是( )
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为________________________________
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:_________________________________
②发生氧化反应的物质是________ ,反应中4 mol的氧化剂能________ (填“失去”或“得到”)________ mol电子。
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为________ 。
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为___________ 。
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
由此看来,高铁酸钠能够杀菌消毒是因为它具有________ 性,而能够除去水中悬浮物是因为_______________________________________________________
③下列物质能作净水剂(能除去水中的悬浮物)的有____________ 。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:
②发生氧化反应的物质是
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有
③下列物质能作净水剂(能除去水中的悬浮物)的有
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
您最近半年使用:0次
名校
10 . 某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、酸性KMnO4溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式_______________________________________ 。
(2)试设计实验证明溶液X中含过氧化氢____________________________________ 。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:______ H2O2+______ Fe2++_____ OH-===______ Fe(OH)3↓,该反应中H2O2表现了_______ (填“氧化”或“还原”)性。
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了______ (填“氧化”或“还原”)性。该反应的离子方程式为____________________ 。
(1)写出Na2O2与水反应的化学方程式
(2)试设计实验证明溶液X中含过氧化氢
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了
您最近半年使用:0次



