名校
1 . 高铁酸钾 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:

回答下列问题:
(1)配制 溶液。
溶液。
①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和_______ ,需要用托盘天平称量 固体
固体_______ g。
②下列操作可能导致上述 溶液浓度偏大的是
溶液浓度偏大的是_______ (填字母)。
A.摇匀后发现液面低于刻度线,再加水至刻度线
B. 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤
C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为_______ (从物质性质角度)。
(2)“氧化”过程中溶液保持强碱性,写出 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:_______ 。
(3)“除杂”后滤液的主要成分为 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是_______ 。
(4) 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是_______ 。
 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
回答下列问题:
(1)配制
 溶液。
溶液。①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和
 固体
固体②下列操作可能导致上述
 溶液浓度偏大的是
溶液浓度偏大的是A.摇匀后发现液面低于刻度线,再加水至刻度线
B.
 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的
 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为(2)“氧化”过程中溶液保持强碱性,写出
 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:(3)“除杂”后滤液的主要成分为
 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是(4)
 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是
您最近一年使用:0次
2024-03-02更新
|
64次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
名校
解题方法
2 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
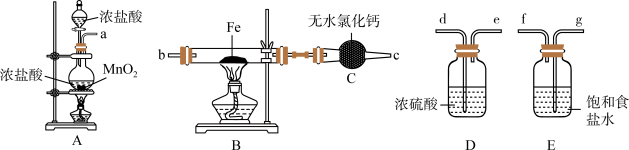
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
79次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
解题方法
3 . 利用软锰矿(主要成分是 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
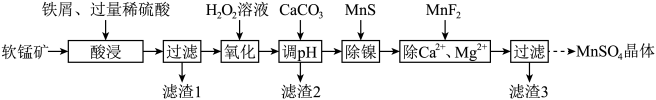
已知:常温下, ,
, ,
, ,
, 。
。
回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是_______ ;“酸浸”后溶液中检测到 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为________ ;“滤渣1”的主要成分为________ (填化学式)。
(2)“氧化”时发生反应的离子方程式为___________ ,“调pH”的目的是___________ 。
(3)“除镍”时,使用MnS作为沉淀剂的原因是___________ 。
(4)加入 使
使 、
、 的浓度均不高于
的浓度均不高于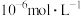 ,此时溶液中
,此时溶液中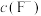 至少为
至少为_______  。
。
(5)硫酸锰的溶解度随温度变化关系如图所示,从“除 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是________ 。

 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下,
 ,
, ,
, ,
, 。
。回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是
 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为(2)“氧化”时发生反应的离子方程式为
(3)“除镍”时,使用MnS作为沉淀剂的原因是
(4)加入
 使
使 、
、 的浓度均不高于
的浓度均不高于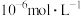 ,此时溶液中
,此时溶液中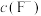 至少为
至少为 。
。(5)硫酸锰的溶解度随温度变化关系如图所示,从“除
 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是
您最近一年使用:0次
4 . 从酸性含铬废水(主要阴离子为 )中回收铬元素(
)中回收铬元素( )的部分工艺流程如图所示。
)的部分工艺流程如图所示。
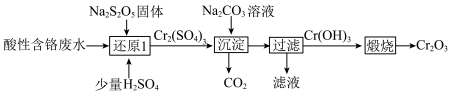
下列有关说法正确的是
 )中回收铬元素(
)中回收铬元素( )的部分工艺流程如图所示。
)的部分工艺流程如图所示。
下列有关说法正确的是
| A.“过滤”时需用玻璃棒搅拌 |
| B.“煅烧”过程中发生了氧化还原反应 |
C.若分别用 、 、 还原等量的 还原等量的 ,消耗 ,消耗 与 与 的物质的量之比为1∶3 的物质的量之比为1∶3 |
D.“还原1”时反应的离子方程式为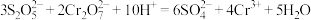 |
您最近一年使用:0次
2024-01-08更新
|
261次组卷
|
6卷引用:辽宁省朝阳市建平县第二高级中学2023-2024学年高一上学期1月期末化学试题
解题方法
5 . 某含镁废弃物中主要含有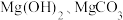 ,还含有少量的
,还含有少量的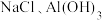 、
、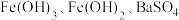 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:

已知:部分离子开始沉淀和完全沉淀的
回答下列问题:
(1)滤渣1的主要成分为_______ (填化学式),其阴离子空间构型为_______ 。
(2)“酸浸”时,发生反应的基本反应类型均为_______ ,所使用的稀盐酸的质量浓度为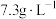 ,则其物质的量浓度为
,则其物质的量浓度为_______  。
。
(3)“氧化”时,反应的离子方程式为_______ 。
(4)“调 ”时,
”时, 的调节范围为
的调节范围为_______ (滤渣2中有两种氢氧化物)。
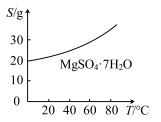
(5)已知 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括_______ 、过滤、洗涤、干燥。
(6)若测定 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
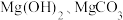 ,还含有少量的
,还含有少量的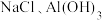 、
、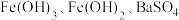 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:
已知:部分离子开始沉淀和完全沉淀的

| 氢氧化物 |  |  |  |
开始沉淀时的 | 4.0 | 8.4 | 1.9 |
完全沉淀时的 | 5.2 | 11.2 | 3.2 |
(1)滤渣1的主要成分为
(2)“酸浸”时,发生反应的基本反应类型均为
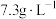 ,则其物质的量浓度为
,则其物质的量浓度为 。
。(3)“氧化”时,反应的离子方程式为
(4)“调
 ”时,
”时, 的调节范围为
的调节范围为(5)已知
 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括
(6)若测定
 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。| A | B | C | D |
 |  |  |  |
| 天平 | 坩埚 | 马弗炉(一种加热设备) | 分液漏斗 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-12更新
|
94次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
6 . 硫酸氧钒(VOSO4)对高血糖、高血脂有治疗作用,也是钒电池不可或缺的电解质。制备 的实验流程如下:
的实验流程如下:
①向仪器a中加入 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;
②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到 溶液(蓝黑色);
溶液(蓝黑色);
③ 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。
实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是_______ ,用仪器b滴加浓硫酸时,_______ (填“需要”或“不需要”)打开上端的玻璃塞。
(2)反应中最适宜的加热方式为_______ ,在a中反应生成
_______ (“是”或“不是”)氧化还原反应。
(3)反应液由橙红色变为蓝黑色的化学方程式为_______ 。
(4)纯度测定:准确称取 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用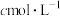 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为_______ %。
(5)性质探究:查阅资料后,有同学对 的热分解提出了两种猜想:
的热分解提出了两种猜想:
猜想ⅰ. ;
;
猜想ⅱ.
欲采用如下装置探究:
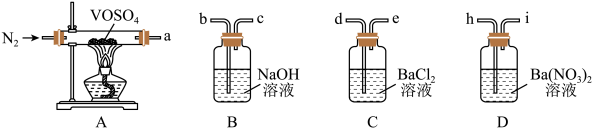
选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→_______ ;若气体流经的装置均有气泡产生,则上述所选必要装置中可观察的现象为_______ ,证明猜想ⅱ正确。
 的实验流程如下:
的实验流程如下:①向仪器a中加入
 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到
 溶液(蓝黑色);
溶液(蓝黑色);③
 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是
(2)反应中最适宜的加热方式为

(3)反应液由橙红色变为蓝黑色的化学方程式为
(4)纯度测定:准确称取
 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用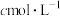 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为(5)性质探究:查阅资料后,有同学对
 的热分解提出了两种猜想:
的热分解提出了两种猜想:猜想ⅰ.
 ;
;猜想ⅱ.

欲采用如下装置探究:

选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→
您最近一年使用:0次
2023-02-08更新
|
311次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高三上学期1月期末化学试题
解题方法
7 . 某校化学实验小组学生为了验证非金属元素氯的非金属性强于硫和氮,设计了一套实验装置如图(已知氯气能把氨气氧化生成氮气和氯化氢)。
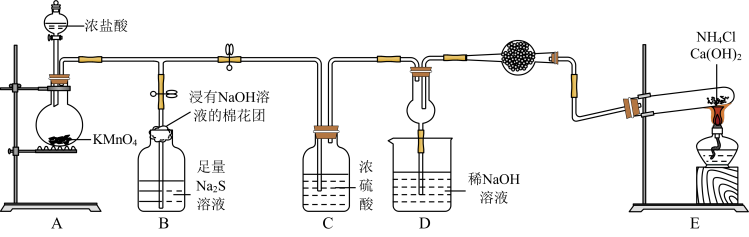
回答下列问题:
(1)配平A中反应的化学方程式:_______ _______HCl(浓)+_______KMnO4=_______MnCl2+_______KCl+_______Cl2↑+_______ H2O。该反应中氧化剂与还原剂物质的量之比为_______ 。
(2)B中浸有NaOH溶液的棉花团的作用为_______ ;B中的现象为_______ ,由该现象得非金属性:Cl>>S。
(3)E中反应化学方程式为_______ 。
(4)D中出现白烟,涉及的反应化学方程式为_______ 、_______ 。
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为_______ (填名称)。
回答下列问题:
(1)配平A中反应的化学方程式:
(2)B中浸有NaOH溶液的棉花团的作用为
(3)E中反应化学方程式为
(4)D中出现白烟,涉及的反应化学方程式为
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为
您最近一年使用:0次
2022-07-14更新
|
232次组卷
|
2卷引用:辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题
解题方法
8 . 在催化剂作用下,H2可处理废水中的NO ,反应原理如图所示。下列说法错误的是
,反应原理如图所示。下列说法错误的是
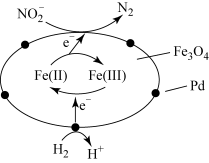
 ,反应原理如图所示。下列说法错误的是
,反应原理如图所示。下列说法错误的是
| A.Fe3O4具有传递电子的作用 |
| B.Pd和Fe3O4均是该过程的催化剂 |
| C.处理后的废水中酸性增强 |
D.每消耗67.2L(标准状况下)H2,可还原2molNO |
您最近一年使用:0次
解题方法
9 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为主要原料制备硫酸的工艺流程如下图所示:
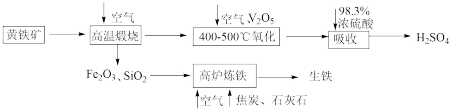
回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是_______ ;煅烧时发生反应的化学方程式为_______ 。
(2)“氧化”时,发生反应的化学方程式为_______ 。
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是_______ 。
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:_______ ;若投入Fe2O3的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中Fe2O3的转化率为_______ 。

回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是
(2)“氧化”时,发生反应的化学方程式为
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:
您最近一年使用:0次
2022-07-12更新
|
313次组卷
|
2卷引用:辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题
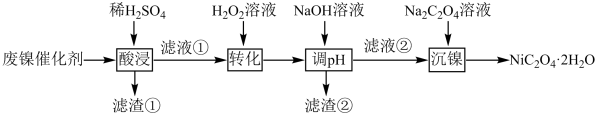
10 . 某废镍催化剂主要含金属 、
、 、
、 及
及 、
、 和
和 等。以该废镍催化剂为原料制备草酸镍晶体
等。以该废镍催化剂为原料制备草酸镍晶体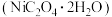 的工艺流程如下:
的工艺流程如下:
已知常温下几种金属离子开始沉淀和完全沉淀时的 如下表:
如下表:
回答下列问题:
(1)滤渣①的化学式为_______ ;“转化”时发生反应的离子方程式为_______ 。
(2)利用上述表格数据,计算 的
的
_______ ,如果“转化”后的溶液中 浓度为
浓度为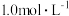 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是_______ 。
(3)“沉镍”时, 溶液滴加过快会导致产品不纯,其原因是
溶液滴加过快会导致产品不纯,其原因是_______ 。
(4)产品草酸镍晶体纯度的测定.称取产品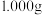 ,经过量稀硫酸处理后,用高锰酸钾标准溶液滴定,滴定终点时消耗
,经过量稀硫酸处理后,用高锰酸钾标准溶液滴定,滴定终点时消耗 的高锰酸钾溶液
的高锰酸钾溶液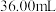 ,则产品中
,则产品中 的质量分数是
的质量分数是_______ ,若某同学测出产品的纯度超过100%,若滴定过程操作无错误,则可能原因是_______ 。
 、
、 、
、 及
及 、
、 和
和 等。以该废镍催化剂为原料制备草酸镍晶体
等。以该废镍催化剂为原料制备草酸镍晶体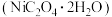 的工艺流程如下:
的工艺流程如下:
已知常温下几种金属离子开始沉淀和完全沉淀时的
 如下表:
如下表:| 金属离子 |  |  |  |  |
开始沉淀时(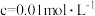 )的 )的 | 7.2 | 3.7 | 2.2 | 7.5 |
完全沉淀时(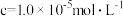 )的 )的 | 8.7 | 4.7 | 3.2 | 9.0 |
(1)滤渣①的化学式为
(2)利用上述表格数据,计算
 的
的
 浓度为
浓度为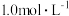 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(3)“沉镍”时,
 溶液滴加过快会导致产品不纯,其原因是
溶液滴加过快会导致产品不纯,其原因是(4)产品草酸镍晶体纯度的测定.称取产品
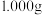 ,经过量稀硫酸处理后,用高锰酸钾标准溶液滴定,滴定终点时消耗
,经过量稀硫酸处理后,用高锰酸钾标准溶液滴定,滴定终点时消耗 的高锰酸钾溶液
的高锰酸钾溶液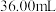 ,则产品中
,则产品中 的质量分数是
的质量分数是
您最近一年使用:0次
2022-01-20更新
|
166次组卷
|
4卷引用:辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题



