名校
1 . 磁性纳米四氧化三铁在催化剂、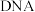 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
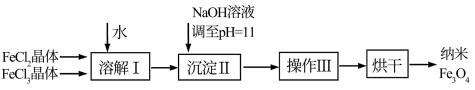
(1)Ⅱ中的反应温度需控制在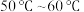 之间,生成
之间,生成 的离子方程式是
的离子方程式是_______ 。
(2)操作Ⅲ分离 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、_______ 、_______ 。
(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为_______ 。但实际操作时,却很难控制这一比例,原因是_______ 。
(4)经过多次实验发现,当混合溶液中 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全_______ 。
(5)以太阳能为热源分解 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
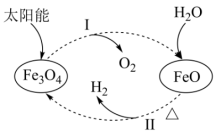
①下列叙述正确的是_______ (填字母)。
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中 为氧化剂
为氧化剂
C.过程中的 为碱性氧化物
为碱性氧化物
D.铁氧化合物循环制 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点
②请写出反应Ⅱ对应的化学方程式_______ 。
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: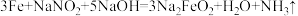 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。
 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
(1)Ⅱ中的反应温度需控制在
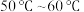 之间,生成
之间,生成 的离子方程式是
的离子方程式是(2)操作Ⅲ分离
 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米
 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为(4)经过多次实验发现,当混合溶液中
 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全(5)以太阳能为热源分解
 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
①下列叙述正确的是
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中
 为氧化剂
为氧化剂C.过程中的
 为碱性氧化物
为碱性氧化物D.铁氧化合物循环制
 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点②请写出反应Ⅱ对应的化学方程式
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成
 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: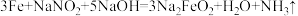 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。A. 的氧化性大于 的氧化性大于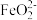 的氧化性 的氧化性 |
B.反应中转移电子 ,则生成还原产物 ,则生成还原产物 |
| C.枪支“发蓝”实质上是使铁表面钝化生成致密保护层导致难以生锈 |
D.上述反应中,若有 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) |
您最近一年使用:0次
2022-01-19更新
|
283次组卷
|
2卷引用:辽宁省抚顺市六校协作体2021-2022学年高一上学期期末考试化学试题
2 . 已知还原性:SO >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是A.当a≥b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |
您最近一年使用:0次
2021-12-24更新
|
614次组卷
|
8卷引用:辽宁省抚顺市2016-2017学年高二下学期期末考试化学试题
辽宁省抚顺市2016-2017学年高二下学期期末考试化学试题浙江省2018版考前特训(2017年10月)学考70快练:9 定量离子方程式的书写判断与计算2016年10月浙江省普通高校招生选考科目考试化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【2023】【高一下】【其他】【杭二中-期中复习卷】【高中化学】【邵威宏收集】浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月月考化学试题
3 . Ⅰ、下表为元素周期表的一部分,请回答有关问题
(1)①和②的简单气态氢化物的稳定性较弱的是___________ (填化学式)。②和③形成的一种化合物为淡黄色固体,该化合物的电子式为___________ 。
(2)元素③、④、⑤的离子半径由大到小的顺序为___________ (填离子符号)。
(3)写出实验室制取⑤单质的化学方程式___________ 。
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
(4)元素X在周期表中的位置是___________ 。
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式___________ 。
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式___________ 。
(7)下列说法能够证明Y的金属性比Z强的是___________ 。
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ |
(2)元素③、④、⑤的离子半径由大到小的顺序为
(3)写出实验室制取⑤单质的化学方程式
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 元素的最高正价与最低负价的代数和为6 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式
(7)下列说法能够证明Y的金属性比Z强的是
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
您最近一年使用:0次
2010·全国·高考真题
真题
名校
4 . 若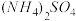 在强热时分解的产物是
在强热时分解的产物是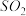 、
、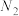 、
、 和
和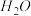 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为
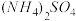 在强热时分解的产物是
在强热时分解的产物是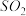 、
、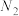 、
、 和
和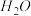 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
您最近一年使用:0次
2019-01-30更新
|
1482次组卷
|
28卷引用:2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷
(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011-2012学年四川省巴中市四县中高一上期期末联考化学试卷贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题河北省易县中学2018-2019学年高二下学期期末考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题云南省剑川县第一中学2019-2020学年高一上学期期末考试化学试题宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题2010年普通高等学校招生统一考试理综试题化学部分(全国卷II)(已下线)2011-2012学年云南省玉溪一中高二上学期期中考试化学(理)试卷(已下线)2011-2012年江西省吉安一中高一上学期期中考试化学试卷(已下线)2012届福建省厦门市翔安一中高三11月份月考化学试卷(已下线)2012届山东省济宁市鱼台二中高三11月月考化学试卷(已下线)2015届黑龙江省哈师大附中高三第一次月考化学试卷2015-2016学年河北省武邑中学高一下周考化学试卷甘肃省兰州市第一中学2018届高三8月月考化学试题山西省康杰中学2018届高三上学期第一次月考化学试卷【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题云南省昭通鲁甸县二中2019-2020学年高一10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2020届高三上学期第一次月考化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷2020届高三化学总复习考点强化练习:物质及其变化(已下线)【浙江新东方】36新疆新和县实验中学2020-2021学年高三上学期期中考试化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题黑龙江省大庆外国语学校2021-2022学年高一下学期开学考试化学试题微专题(三)——氧化还原反应方程式的配平与书写宁夏银川市唐徕中学2023-2024学年高三上学期9月月考化学试题
解题方法
5 . 铜的离子除了铜离子(Cu2+)外,自然界中还存在亚铜离子(Cu+)。Cu+在水溶液中没有Cu2+稳定,易在酸性条件下发生反应:2Cu+═Cu2++Cu。+1价铜的化合物通常是难溶物,如Cu2O、CuI、CuCl、Cu2S、等。
回答下列问题:
(1) 在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成难溶物的颜色为________ ;若继续加热,出现黑色物质,判断这种物质的化学式为________________ 。
(2) 在CuCl2溶液中滴加过量KI溶液,可发生如下反应:
a.2Cu2++4I-═2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2
为顺利观察到CuI、CuCl白色沉淀,可以加入下列试剂中的________ 。
A.乙醇 B.苯 C.盐酸溶液 D.NaCl溶液
(3) Cu2S在稀H2SO4酸化下与氧气反应生成CuSO4,该反应的化学方程式为________________________________ ;该反应的还原剂为________________ ,当1 mol O2发生反应时,还原剂所失电子的物质的量为________ mol,其中被S元素还原的O2的物质的量为________ mol。
回答下列问题:
(1) 在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成难溶物的颜色为
(2) 在CuCl2溶液中滴加过量KI溶液,可发生如下反应:
a.2Cu2++4I-═2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2
为顺利观察到CuI、CuCl白色沉淀,可以加入下列试剂中的
A.乙醇 B.苯 C.盐酸溶液 D.NaCl溶液
(3) Cu2S在稀H2SO4酸化下与氧气反应生成CuSO4,该反应的化学方程式为
您最近一年使用:0次
6 . 根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、(明)矾而为轻粉(Hg2Cl2),加以硫磺升而为银朱(HgS)”。发生的主要化学反应方程式如下:
①HgS+O2 === Hg+SO2
② Hg+ NaCl+ KAl(SO4)2+ O2 === Hg2Cl2+ Na2SO4+ Al2O3+ K2SO4
③ Hg+S === HgS
请回答下列问题:
(1)在①的方程式中,HgS是做_______
a.氧化剂 b.还原剂 c.既做氧化剂又做还原剂 d.既不做氧化剂又不做还原剂
(2)配平②的化学方程式___________________________________________
(3)实验室制备SO2一般选用浓硫酸与Na2SO3反应。实验室制取SO2并检验其性质的装置与过程如下图:

a. 实验开始前检验气体发生装置气密 性的方法为____________________ (说明操作方法、现象和结论)
b. 分析下列装置中的现象分别为
①_________ ②__________
③_________ ④__________
c. ⑤的作用为_______________ ,所涉及的化学反应方程式为:____________________
d. 若在制备SO2时改为用稀盐酸与Na2SO3反应,则可能产生的影响为______________
①HgS+O2 === Hg+SO2
② Hg+ NaCl+ KAl(SO4)2+ O2 === Hg2Cl2+ Na2SO4+ Al2O3+ K2SO4
③ Hg+S === HgS
请回答下列问题:
(1)在①的方程式中,HgS是做
a.氧化剂 b.还原剂 c.既做氧化剂又做还原剂 d.既不做氧化剂又不做还原剂
(2)配平②的化学方程式
(3)实验室制备SO2一般选用浓硫酸与Na2SO3反应。实验室制取SO2并检验其性质的装置与过程如下图:

a. 实验开始前检验气体发生装置气密 性的方法为
b. 分析下列装置中的现象分别为
①
③
c. ⑤的作用为
d. 若在制备SO2时改为用稀盐酸与Na2SO3反应,则可能产生的影响为
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.某工厂的工业废水中含有大量的FeSO4 和较多的Fe3+和Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
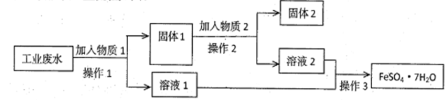
(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为________ 。
(2)加入过量物质1后,发生反应的离子方程式为___________________________ 。
(3)固体2是__________ ,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入__________ 。
Ⅱ.工业上冶炼铝的原料是铝土矿( 主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________ (填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式______________ 。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为_________________________ 。

(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为
(2)加入过量物质1后,发生反应的离子方程式为
(3)固体2是
Ⅱ.工业上冶炼铝的原料是铝土矿( 主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为
您最近一年使用:0次
2018-01-17更新
|
669次组卷
|
5卷引用:辽宁省清原中学2017-2018学年高一上学期期末考试化学试题
名校
8 . 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________________ 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为_________ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为__________ (填化学式)。
③NaH2PO2为___________ (填“正盐”或“酸式盐”)
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:___________________________________ 。
(1)H3PO2是一元中强酸,写出其电离方程式
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为
③NaH2PO2为
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:
您最近一年使用:0次
2016-12-09更新
|
459次组卷
|
2卷引用:2015-2016学年辽宁省抚顺重点高中协作校高二下期末化学试卷



