Ⅰ、下表为元素周期表的一部分,请回答有关问题
(1)①和②的简单气态氢化物的稳定性较弱的是___________ (填化学式)。②和③形成的一种化合物为淡黄色固体,该化合物的电子式为___________ 。
(2)元素③、④、⑤的离子半径由大到小的顺序为___________ (填离子符号)。
(3)写出实验室制取⑤单质的化学方程式___________ 。
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
(4)元素X在周期表中的位置是___________ 。
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式___________ 。
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式___________ 。
(7)下列说法能够证明Y的金属性比Z强的是___________ 。
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ |
(2)元素③、④、⑤的离子半径由大到小的顺序为
(3)写出实验室制取⑤单质的化学方程式
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 元素的最高正价与最低负价的代数和为6 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式
(7)下列说法能够证明Y的金属性比Z强的是
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
更新时间:2021-01-25 09:41:23
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】 是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为
是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为 、
、 、
、 、
、 )和硫铁矿(主要成分为
)和硫铁矿(主要成分为 )制备
)制备 的工艺流程如下:
的工艺流程如下:
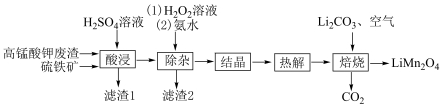
已知:酸浸液主要含有 、
、 、
、 、
、 等金属阳离子。
等金属阳离子。
回答下列问题:
(1)酸浸。 与
与 反应生成
反应生成 和
和 的离子方程式为:
的离子方程式为:___________ 。
(2)滤渣1中主要含有___________ (填化学式),其属于___________ (填“酸性氧化物”、“两性氧化物”或“碱性氧化物”)。
(3)保持温度、浸取时间不变,能提高锰元素浸出率的措施有___________ 。
(4)除杂。加入 的作用为:
的作用为:___________ 。
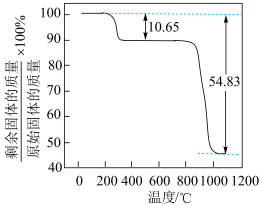
(5)热解。在真空中加热分解 ,测得固体的质量随温度变化如图所示。真空热解
,测得固体的质量随温度变化如图所示。真空热解 制备
制备 ,需控制的温度为大于
,需控制的温度为大于___________ ℃,原因为:___________ 。(写出计算推理过程)
(6)焙烧。生成 的反应为
的反应为___________ 。
 是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为
是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为 、
、 、
、 、
、 )和硫铁矿(主要成分为
)和硫铁矿(主要成分为 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知:酸浸液主要含有
 、
、 、
、 、
、 等金属阳离子。
等金属阳离子。回答下列问题:
(1)酸浸。
 与
与 反应生成
反应生成 和
和 的离子方程式为:
的离子方程式为:(2)滤渣1中主要含有
(3)保持温度、浸取时间不变,能提高锰元素浸出率的措施有
(4)除杂。加入
 的作用为:
的作用为:(5)热解。在真空中加热分解
 ,测得固体的质量随温度变化如图所示。真空热解
,测得固体的质量随温度变化如图所示。真空热解 制备
制备 ,需控制的温度为大于
,需控制的温度为大于
(6)焙烧。生成
 的反应为
的反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:N2(g)+O2(g)=2NO(g)ΔH=+180kJ/mol;N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;则2NO(g)+O2(g)=2NO2(g)ΔH=______ kJ/mol。
(2)查阅资料:2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快)
Ⅱ.N2O2(g)+O2(g)⇌2NO2(g)(慢)
反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1_____ E2(填“>”“<”或“=”),2NO(g)+O2(g)⇌2NO2(g)的反应速率主要由反应______ (填“I”或“Ⅱ”)决定。
(3)温度为T1时,在容积为1L的恒容密闭容器中充入0.6molNO2(g),发生反应:2NO2(g)⇌2NO(g)+O2(g)△H>0,达平衡时c(O2)=0.2mol/L。
①反应的平衡常数K=______ 。
②实验测得:v正=k正•c2(NO2),v逆=k逆•c2(NO)•c(O2),k正、k逆为速率常数,仅受温度影响。当温度为T2时,反应达到平衡状态,若k正=k逆,则T1______ T2(填“>”或“<”),得出该结论的理由是______ 。
(4)NO 是水体中的主要污染物。碱性条件下,强氧化剂过硫酸钠(Na2S2O8)可脱除水体中的NO
是水体中的主要污染物。碱性条件下,强氧化剂过硫酸钠(Na2S2O8)可脱除水体中的NO ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
(5)不同温度下,达到平衡时NO 的脱除率与过硫酸钠初始浓度的关系如图所示。
的脱除率与过硫酸钠初始浓度的关系如图所示。

比较a、b点的反应速率:va_____ vb(填“>”“<”或“=”)。若要提高NO 的脱除率,可以采取的措施有
的脱除率,可以采取的措施有_____ (写出一点即可)。
(1)已知汽车气缸中氮及其化合物发生如下反应:N2(g)+O2(g)=2NO(g)ΔH=+180kJ/mol;N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;则2NO(g)+O2(g)=2NO2(g)ΔH=
(2)查阅资料:2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快)
Ⅱ.N2O2(g)+O2(g)⇌2NO2(g)(慢)
反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1
(3)温度为T1时,在容积为1L的恒容密闭容器中充入0.6molNO2(g),发生反应:2NO2(g)⇌2NO(g)+O2(g)△H>0,达平衡时c(O2)=0.2mol/L。
①反应的平衡常数K=
②实验测得:v正=k正•c2(NO2),v逆=k逆•c2(NO)•c(O2),k正、k逆为速率常数,仅受温度影响。当温度为T2时,反应达到平衡状态,若k正=k逆,则T1
(4)NO
 是水体中的主要污染物。碱性条件下,强氧化剂过硫酸钠(Na2S2O8)可脱除水体中的NO
是水体中的主要污染物。碱性条件下,强氧化剂过硫酸钠(Na2S2O8)可脱除水体中的NO ,该反应的离子方程式是
,该反应的离子方程式是(5)不同温度下,达到平衡时NO
 的脱除率与过硫酸钠初始浓度的关系如图所示。
的脱除率与过硫酸钠初始浓度的关系如图所示。
比较a、b点的反应速率:va
 的脱除率,可以采取的措施有
的脱除率,可以采取的措施有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】央视报道《王者归“铼”》:我国利用新技术发现并提纯了超级金属“铼”,其熔点高、耐磨、耐腐蚀,可用来制造航空发动机核心部件,有望打破美国垄断。工业上用富铼渣(含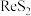 )制得铼粉,其工艺流程如下图所示:
)制得铼粉,其工艺流程如下图所示:
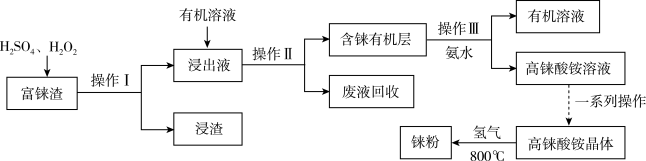
回答下列问题:
(1)操作Ⅰ的名称是_________ ,操作Ⅱ用到的玻璃仪器有烧杯、_________ 。
(2)铼不溶于盐酸,可溶于稀硝酸生成强酸高铼酸(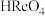 ),请写出反应的离子方程式
),请写出反应的离子方程式_________ 。
(3)高铼酸铵和氢气制取单质铼的化学方程式为_________ ;此反应过程中,实际消耗 的量大于理论值,其原因是
的量大于理论值,其原因是_________ 。
(4)由高铼酸铵溶液获得高铼酸铵晶体的一系列操作为_________ 、洗涤、干燥。
(5)整个工艺流程中除有机溶液可循环利用外,还有_________ 。
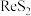 )制得铼粉,其工艺流程如下图所示:
)制得铼粉,其工艺流程如下图所示:
回答下列问题:
(1)操作Ⅰ的名称是
(2)铼不溶于盐酸,可溶于稀硝酸生成强酸高铼酸(
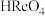 ),请写出反应的离子方程式
),请写出反应的离子方程式(3)高铼酸铵和氢气制取单质铼的化学方程式为
 的量大于理论值,其原因是
的量大于理论值,其原因是(4)由高铼酸铵溶液获得高铼酸铵晶体的一系列操作为
(5)整个工艺流程中除有机溶液可循环利用外,还有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】已知和氮元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y的原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是 。试回答:
。试回答:
(1)X元素的基态原子的核外电子排布式为_________ ,Y元素原子价电子排布图(也叫轨道表示式)为_________ 。
(2)X、Y两元素之间形成的化学键为_________ (填“共价键”或“离子键”)。
(3) 的空间结构为
的空间结构为_________ 形,中心原子采取_________ 杂化,分子为_________ (填“极性分子”或“非极性分子”)。
(4) 的沸点与
的沸点与 比较:
比较:_________ (填化学式)的高,原因_________ 。
 。试回答:
。试回答:(1)X元素的基态原子的核外电子排布式为
(2)X、Y两元素之间形成的化学键为
(3)
 的空间结构为
的空间结构为(4)
 的沸点与
的沸点与 比较:
比较:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】1869年,俄国化学家门捷列夫制作了第一张元素周期表,下表是元素周期表的一部分,表中①~⑧代表8种元素。
回答下列问题:
(1)②的元素名称是______ 。
(2)画出⑥的原子结构示意图______ ,写出③与⑦形成的离子化合物的电子式______ 。
(3)③④⑧对应的简单离子半径最小的是______ (用离子符号表示)。
(4)写出⑤的单质与③的最高价氧化物对应水化物反应的离子方程式______ 。
(5)下列说法能证明非金属性⑧强于⑦的是______ (填字母)。
a.简单阴离子的还原性:⑧>⑦ b.简单氢化物的稳定性:⑧>⑦
c.氧化物对应的水化物的酸性:⑧>⑦
(6)由①⑧组成的化合物是______ (填“离子化合物”或“共价化合物”),该化合物的某浓溶液的密度为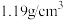 ,溶质质量分数为36.5%,其物质的量浓度为
,溶质质量分数为36.5%,其物质的量浓度为______ mol/L。
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)②的元素名称是
(2)画出⑥的原子结构示意图
(3)③④⑧对应的简单离子半径最小的是
(4)写出⑤的单质与③的最高价氧化物对应水化物反应的离子方程式
(5)下列说法能证明非金属性⑧强于⑦的是
a.简单阴离子的还原性:⑧>⑦ b.简单氢化物的稳定性:⑧>⑦
c.氧化物对应的水化物的酸性:⑧>⑦
(6)由①⑧组成的化合物是
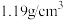 ,溶质质量分数为36.5%,其物质的量浓度为
,溶质质量分数为36.5%,其物质的量浓度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】如图是部分短周期元素的常见化合价与原子序数的关系图:

注:答题时,A—G所有元素都用其对应的元素符号表示。
(1)画出A的原子结构示意图______________ ;
(2)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物(H的稳定氧化物为液态)时放出的热量为QkJ,请写出表示1molA2H6完全燃烧的热化学方程式:_____________ ;
(3)用电子式表示D2G的形成过程______________ ;其所含化学键类型为________ ;
(4)C2-、D+、G2-离子半径大小顺序是___ >____ >____ ;
(5)C、G元素所形成的氢化物稳定性为___ >____ (填化学式),原因是:______________ ;
(6)某同学设计实验证明A、B、F的非金属性强弱关系, 装置如图。

①溶液a和b分别为_________ ,__________ ;
②溶液c中发生反应的离子方程式为_____________ 。

注:答题时,A—G所有元素都用其对应的元素符号表示。
(1)画出A的原子结构示意图
(2)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物(H的稳定氧化物为液态)时放出的热量为QkJ,请写出表示1molA2H6完全燃烧的热化学方程式:
(3)用电子式表示D2G的形成过程
(4)C2-、D+、G2-离子半径大小顺序是
(5)C、G元素所形成的氢化物稳定性为
(6)某同学设计实验证明A、B、F的非金属性强弱关系, 装置如图。

①溶液a和b分别为
②溶液c中发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.卤素单质及其化合物在社会生产、生活中有重要的应用。
(1)①卤素原子的最外层电子数相同,碘离子的电子式为___________ 。
②同温同压下,HBr气体和HI气体的体积比为1:2,则这两种气体的质量之比为___________ 。标准状况下, 氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为
氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为___________ 。
③漂白粉在使用过程中,吸收 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)卤素单质及化合物在许多性质上都存在着递变规律,下列有关说法中,正确的是___________。
Ⅱ.某同学设计了如图所示装置,进行实验。实验操作步骤如下:

①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④___________,取下试管c震荡,静置。
请回答:
(3)步骤②中反应的离子方程式为:___________ 。设计步骤③的实验目的是___________ 。
(4)步骤④横线上的操作是___________ 。
(5)从试管c中获得纯净的碘单质,需进行的操作步骤为___________ 。
(6)本实验的目的是:___________ 。
(1)①卤素原子的最外层电子数相同,碘离子的电子式为
②同温同压下,HBr气体和HI气体的体积比为1:2,则这两种气体的质量之比为
 氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为
氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为③漂白粉在使用过程中,吸收
 发生反应的化学方程式为
发生反应的化学方程式为(2)卤素单质及化合物在许多性质上都存在着递变规律,下列有关说法中,正确的是___________。
| A.卤化氢的热稳定性按HCl、HBr、HI的顺序依次增强 |
| B.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深 |
| C.卤化钠的还原性按NaCl、NaBr,NaI的顺序依次增强 |
D.卤素单质与氢气化合按 、 、 、 、 的顺序由难变易 的顺序由难变易 |
Ⅱ.某同学设计了如图所示装置,进行实验。实验操作步骤如下:

①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④___________,取下试管c震荡,静置。
请回答:
(3)步骤②中反应的离子方程式为:
(4)步骤④横线上的操作是
(5)从试管c中获得纯净的碘单质,需进行的操作步骤为
(6)本实验的目的是:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】如图是元素周期表的一部分,表中所列字母分别代表一种元素。根据表中所列元素回答下列问题:
(1)c的离子结构示意图是_______ ,h在元素周期表中的位置为_______ 。
(2)a、e、f最高价氧化物对应水化物的酸性强弱由大到小的顺序为_______ (用化学式表示)。
(3)b的一种氧化物可以消毒杀菌,其电子式为_______ 。
(4)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。碱性:
_______ 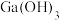 (填“>”或“<”),氧化镓与
(填“>”或“<”),氧化镓与 反应的化学方程式为
反应的化学方程式为_______ 。
| a | |||||||||||||||||
| b | c | d | e | f | g | ||||||||||||
| h |
(2)a、e、f最高价氧化物对应水化物的酸性强弱由大到小的顺序为
(3)b的一种氧化物可以消毒杀菌,其电子式为
(4)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。碱性:

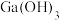 (填“>”或“<”),氧化镓与
(填“>”或“<”),氧化镓与 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氢燃料电池汽车所用的有机物液体储氢技术应用前景广阔。该技术的化学反应原理是在一定条件下,环己烷发生气相脱氢反应释放出氢气(反向即为储氢过程):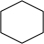 (g)⇌
(g)⇌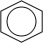 (g)+3H2(g),已知该反应平衡常数与温度的关系如下表:
(g)+3H2(g),已知该反应平衡常数与温度的关系如下表:
140℃时,在体积为2L的密闭容器中充入1mol环己烷(g),发生上述反应。完成下列填空:
(1)元素周期表中,碳元素的位置是_______ 。列举一个能说明硫元素非金属性比碳元素强的事实_______ 。
(2)该反应的化学平衡常数表达式_______ ,正反应是_______ (填“吸热”或“放热”)反应。
(3)若5min时,容器中气体的物质的量增大为原来的2.2倍,此时环己烷的转化率为_______ ,v(正)_______ v(逆)(填“>”、“=”或“<”)。
(4)恒压下,环己烷起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如下图所示,其中分子筛膜能选择性分离出H2。

用化学平衡移动原理解释分子筛膜对环己烷平衡转化率的影响_______ 。
 (g)⇌
(g)⇌ (g)+3H2(g),已知该反应平衡常数与温度的关系如下表:
(g)+3H2(g),已知该反应平衡常数与温度的关系如下表:| 温度/℃ | 120 | 140 | 160 |
| 平衡常数 | 5.343×10-2 | 1.152 | 18.70 |
140℃时,在体积为2L的密闭容器中充入1mol环己烷(g),发生上述反应。完成下列填空:
(1)元素周期表中,碳元素的位置是
(2)该反应的化学平衡常数表达式
(3)若5min时,容器中气体的物质的量增大为原来的2.2倍,此时环己烷的转化率为
(4)恒压下,环己烷起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如下图所示,其中分子筛膜能选择性分离出H2。

用化学平衡移动原理解释分子筛膜对环己烷平衡转化率的影响
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】前四周期中原子序数依次增大的五种元素A、B、C、D、E,其中A、B同周期,B、C同族,A元素2p原子轨道半充满,C原子有2个未成对电子,D元素原子核外有17种运动状态的电子;E元素次外层全充满,最外层只有1个电子。回答下列问题:
(1)E原子的价层电子排布图为___________ ,其p电子的原子轨道呈___________ 形;
(2)B的氢化物比同族相邻元素氢化物沸点高,原因是___________ ;
(3)C、D的最高价含氧酸中酸性较强的是___________ (填化学式);该酸中阴离子的空间构型是___________ ,中心原子的杂化类型为___________ ;
(4)A和D形成的化合物AD3的电子式为___________ ,该物质水解生成碱性气体和漂白性物质,写出该反应的化学方程式___________ ;
(5)A的氢化物通入到E2+溶液中发生的反应为___________ 、___________ ;
(1)E原子的价层电子排布图为
(2)B的氢化物比同族相邻元素氢化物沸点高,原因是
(3)C、D的最高价含氧酸中酸性较强的是
(4)A和D形成的化合物AD3的电子式为
(5)A的氢化物通入到E2+溶液中发生的反应为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序 数都小于 18。A微粒的最外层电子数比次外层多5个;金属B的原子核内质子数比前一周期的同族元素多 8 个,其单质不能从 CuSO4 溶液中置换出 Cu;C 元素有 3 种同位 素;D的气态氢化物溶于水后显碱性;E 是由两种不同元素组成的带负电荷的微粒,它 共有2个原子核 10 个电子,E极易与 C+结合成中性微粒。
(1)写出微粒的表示符号:B_____________ 、E_____________ 。
(2)C和D形成的10个电子的分子的化学式为_____________ 。
(1)写出微粒的表示符号:B
(2)C和D形成的10个电子的分子的化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】有A、B、C、D、E、F六种短周期元素,原子序数依次增大,A的最高正价和最低负价的代数和为2,B的阴离子、C、D的阳离子均具有与氖原子相同的电子层结构;B、C可形成离子化合物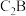 ,C、D、F三种元素的最高价氧化物对应的水化物之间可以两两发生反应;E元素的单质常用于制造芯片和太阳能电池;F元素的原子在同周期中原子半径最小。试回答下列各问题:
,C、D、F三种元素的最高价氧化物对应的水化物之间可以两两发生反应;E元素的单质常用于制造芯片和太阳能电池;F元素的原子在同周期中原子半径最小。试回答下列各问题:
(1)E元素在周期表中的位置为___________
(2)A、C、F三种元素中,离子半径由大到小的顺序为___________ (填离子符号)
(3)B、C、F三种元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________
(4)D的最高价氧化物与F的最高价氧化物对应的水化物溶液反应的离子方程式:___________
(5)工业上制备粗E单质的化学方程式为___________ 。
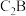 ,C、D、F三种元素的最高价氧化物对应的水化物之间可以两两发生反应;E元素的单质常用于制造芯片和太阳能电池;F元素的原子在同周期中原子半径最小。试回答下列各问题:
,C、D、F三种元素的最高价氧化物对应的水化物之间可以两两发生反应;E元素的单质常用于制造芯片和太阳能电池;F元素的原子在同周期中原子半径最小。试回答下列各问题:(1)E元素在周期表中的位置为
(2)A、C、F三种元素中,离子半径由大到小的顺序为
(3)B、C、F三种元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)D的最高价氧化物与F的最高价氧化物对应的水化物溶液反应的离子方程式:
(5)工业上制备粗E单质的化学方程式为
您最近一年使用:0次



