解题方法
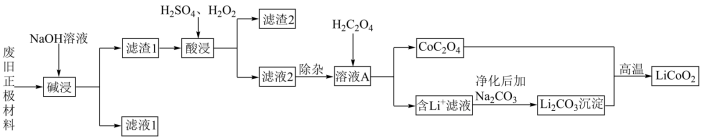
1 . 废旧锂离子电池材料的回收再生意义重大。一种回收废旧锂离子电池正极材料[含有钴酸锂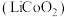 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸 的电离常数
的电离常数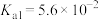 ,
,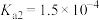 ;
;
②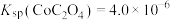 。
。
请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为_______ 。
(2)为提高“碱浸”效率可采取的措施有_______ (任写一条)。
(3)“滤渣2”的主要成分为_______ 。
(4)“酸浸”中发生反应的离子方程式为_______ 。
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是_______ 。
(6)常温下,溶液A中加入 产生
产生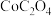 沉淀:
沉淀: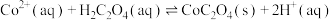 ,该反应的化学平衡常数
,该反应的化学平衡常数
_______ 。
(7)在空气中,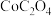 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为_______ 。
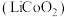 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸
 的电离常数
的电离常数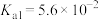 ,
,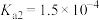 ;
;②
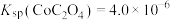 。
。请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为
(2)为提高“碱浸”效率可采取的措施有
(3)“滤渣2”的主要成分为
(4)“酸浸”中发生反应的离子方程式为
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是
| 反应温度/℃ | 60 | 70 | 80 | 90 |
| 钴的浸出率/% | 88 | 90.5 | 93 | 89 |
(6)常温下,溶液A中加入
 产生
产生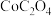 沉淀:
沉淀: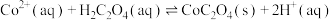 ,该反应的化学平衡常数
,该反应的化学平衡常数
(7)在空气中,
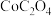 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为
您最近一年使用:0次
2 . 某同学做实验时白色衣服上沾了一些KMnO4,产生褐色斑点,如果用草酸(H2C2O4)的稀溶液洗涤马上可以复原,其离子方程式为: +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
 +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是| A.该反应的氧化产物是Mn2+ |
| B.离子方程式横线上的生成物是OH- |
| C.配平离子方程式,H+的计量数是6 |
| D.标准状况下,有5.6 LCO2生成时,转移电子的物质的量为0.5 mol |
您最近一年使用:0次
名校
解题方法
3 . 碱式碳酸锰[Mn2(OH)2CO3]是一种不溶于水的固体,是制造其他含锰化合物的原料。工业上以方锰矿(主要成分为MnO,还含有少量的Fe3O4、Al2O3、CaO、SiO2)为原料制备碱式碳酸锰。
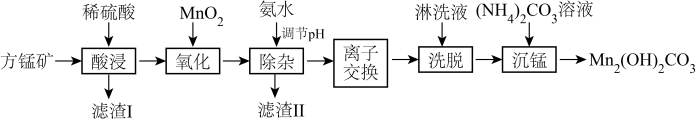
25℃时,相关物质的Ksp如表:
回答下列问题:
(1)“酸浸”时,滤渣I的成分是_____ (填化学式)。
(2)“氧化”时,该反应的离子方程式为_____ 。
(3)“除杂”时,使用氨水的目的是将Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥_____ ;若Al3+沉淀完全时,则溶液中Fe3+的物质的量浓度为_____ mol•L-1通常认为溶液中的离子浓度≤1×10-5mol•L-1沉淀完全)。
(4)“离子交换”和“洗脱”时,发生反应:Mn2++2HR MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为_____ (填“硫酸”、“氢氧化钠溶液”或“蒸馏水)。
(5)沉锰时,反应的离子方程式为_____ ,过滤、洗涤、干燥,得到Mn2(OH)2CO3,检验沉淀是否洗涤干净的操作是_____ 。

25℃时,相关物质的Ksp如表:
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| Ksp | 2×10-13 | 5×10-17 | 3×10-39 | 1×10-32 | 6×10-6 |
(1)“酸浸”时,滤渣I的成分是
(2)“氧化”时,该反应的离子方程式为
(3)“除杂”时,使用氨水的目的是将Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥
(4)“离子交换”和“洗脱”时,发生反应:Mn2++2HR
 MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为(5)沉锰时,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 正高碘酸(H5IO6)是白色结晶性粉末,溶于水,主要用作氧化剂和分析试剂。由NaI制取H5IO6的实验流程如图所示:
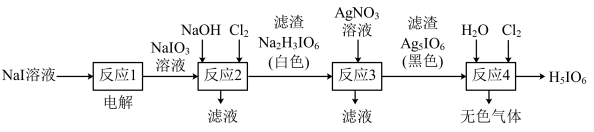
下列说法正确的是

下列说法正确的是
A.电解过程中阳极反应为:I-+6OH--6e-=IO +3H2O +3H2O |
| B.“反应2”中Cl2与NaIO3的物质的量之比为1∶1 |
| C.“反应3”的滤液中含有NaNO3,NaI等 |
| D.“反应4”为非氧化还原反应 |
您最近一年使用:0次
2022-12-17更新
|
189次组卷
|
3卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
名校
解题方法
5 . 能正确表示下列反应的离子方程式的是
| A.向CuSO4溶液中加入金属钠:2Na+Cu2+=2Na++Cu |
B.向高锰酸钾溶液中滴加双氧水:2Mn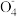 +3H2O2+6H+=2Mn2++4O2↑+6H2O +3H2O2+6H+=2Mn2++4O2↑+6H2O |
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使S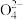 完全沉淀:N 完全沉淀:N +Al3++2S +Al3++2S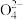 +2Ba2++4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ +2Ba2++4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.氢氧化铁与氢碘酸反应:Fe(OH)3+3H+=Fe3++3H2O |
您最近一年使用:0次
2022-12-13更新
|
171次组卷
|
3卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
名校
解题方法
6 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
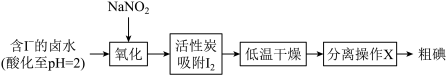
已知:pH=2时,I.NaNO2溶液只能将I-氧化为I2,同时生成NO
II.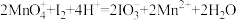
①氧化过程的离子方程式为_______ 。
②根据I2的特性,分离操作X应为_______ 、冷却结晶。
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是_______ 。
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:
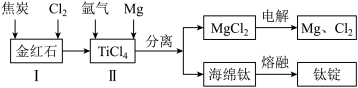
①I在高温条件下进行,产物中有一种可燃性无色气体。I中反应的化学方程式为_______ 。
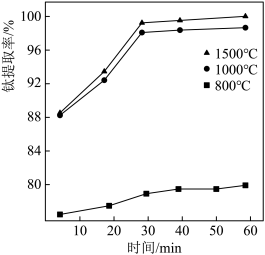
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为_______ ℃。
③II中氩气的作用是_______ 。
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有_______ (填化学式)。
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:

已知:pH=2时,I.NaNO2溶液只能将I-氧化为I2,同时生成NO
II.
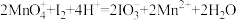
①氧化过程的离子方程式为
②根据I2的特性,分离操作X应为
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:

①I在高温条件下进行,产物中有一种可燃性无色气体。I中反应的化学方程式为
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

③II中氩气的作用是
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有
您最近一年使用:0次
2022-07-12更新
|
547次组卷
|
4卷引用:辽宁省锦州市2021-2022学年高一下学期期末考试化学试卷
名校
解题方法
7 . 某兴趣小组利用经过初步处理的含有Fe2+的废液制备硫酸亚铁晶体的流程如图:____ ,若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为____ 。
(2)加入铁粉的作用是____ 。
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:____ 。
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为____ 。
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为____ ,该反应中每产生1molFe2O3,转移的电子数为____ NA。

(2)加入铁粉的作用是
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为
您最近一年使用:0次
2022-03-16更新
|
216次组卷
|
2卷引用:辽宁省渤海大学附属高级中学2021-2022学年高一上学期期末质量检测化学试题
解题方法
8 . 已知氢碘酸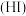 是一种具有强还原性的强酸,
是一种具有强还原性的强酸, 可以与多种物质【如:
可以与多种物质【如: 、
、 、
、 、
、 、
、 、
、 等】发生不同类型的化学反应.请回答下列问题:
等】发生不同类型的化学反应.请回答下列问题:
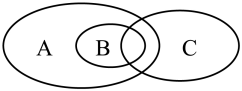
(1)下图可表示离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是_________ (填标号).
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为_________________ .
(3)常温下 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为 ,说明还原性
,说明还原性
______  (填“>”、“<”或“=).
(填“>”、“<”或“=).
(4)在反应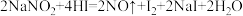 ,氧化剂与还原剂的物质的量之比为
,氧化剂与还原剂的物质的量之比为________ .
(5)下列三种氧化剂均可以将 氧化生成
氧化生成 ,自身对应的还原产物情况如下:
,自身对应的还原产物情况如下:
请判断等物质的量的三种氧化剂分别与足量HI作用,得到I2质量最多的是________ (填选项标号).
(6)向 胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
①红褐色沉淀溶解,反应的离子方程式为___________________________ .
②最后溶液颜色加深,反应的离子方程式为______________________________ .
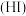 是一种具有强还原性的强酸,
是一种具有强还原性的强酸, 可以与多种物质【如:
可以与多种物质【如: 、
、 、
、 、
、 、
、 、
、 等】发生不同类型的化学反应.请回答下列问题:
等】发生不同类型的化学反应.请回答下列问题:(1)下图可表示离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)常温下
 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为 ,说明还原性
,说明还原性
 (填“>”、“<”或“=).
(填“>”、“<”或“=).(4)在反应
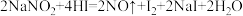 ,氧化剂与还原剂的物质的量之比为
,氧化剂与还原剂的物质的量之比为(5)下列三种氧化剂均可以将
 氧化生成
氧化生成 ,自身对应的还原产物情况如下:
,自身对应的还原产物情况如下:选项 | A | B | C |
氧化剂 |
|
|
|
还原产物 |
|
|
|
(6)向
 胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.①红褐色沉淀溶解,反应的离子方程式为
②最后溶液颜色加深,反应的离子方程式为
您最近一年使用:0次
9 . 某离子反应中涉及 、
、 、
、 、H+、N2、Cl-六种粒子,其中
、H+、N2、Cl-六种粒子,其中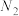 的物质的量随时间变化的曲线如图所示.下列判断正确的是
的物质的量随时间变化的曲线如图所示.下列判断正确的是

 、
、 、
、 、H+、N2、Cl-六种粒子,其中
、H+、N2、Cl-六种粒子,其中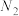 的物质的量随时间变化的曲线如图所示.下列判断正确的是
的物质的量随时间变化的曲线如图所示.下列判断正确的是
| A.反应后溶液的酸性增强 | B.标准状况下,生成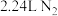 时,反应中转移 时,反应中转移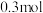 电子 电子 |
| C.氧化产物与还原产物的物质的量之比为2∶1 | D. 被还原,是还原剂 被还原,是还原剂 |
您最近一年使用:0次
2022-01-18更新
|
317次组卷
|
2卷引用:辽宁省锦州市2021-2022学年高一上学期期末考试化学试题
名校
10 . 已知2MO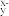 +5S2-+16H+=2M2++5S↓+8H2O,则MO
+5S2-+16H+=2M2++5S↓+8H2O,则MO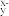 中x的值为
中x的值为
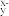 +5S2-+16H+=2M2++5S↓+8H2O,则MO
+5S2-+16H+=2M2++5S↓+8H2O,则MO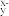 中x的值为
中x的值为| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2021-03-21更新
|
268次组卷
|
16卷引用:辽宁省锦州市滨海实验中学2019-2020学年高一上学期期末考试化学试题(2019新人教版)
辽宁省锦州市滨海实验中学2019-2020学年高一上学期期末考试化学试题(2019新人教版)2015-2016学年吉林省实验中学高一上期末(理)化学试卷2015-2016学年吉林省实验中学高一上期末文化学试卷安徽省合肥市六校2019-2020学年高一上学期期末考试化学试题(已下线)2011-2012学年河北省衡水中学高一下学期一调考试化学试卷海南省定安县定安中学2020届高三上学期第二次月考化学试题江西省宜春九中(外国语学校)2019-2020学年高一上学期第二次月考化学试题河北省石家庄市第一中学2020~2021学年高一上学期期中试题化学试题河北省石家庄市第二中学西校区2020-2021学年高一上学期10月月考化学试题湖北省宜昌市长阳土家族自治县第一高级中学2021-2022学年高一上学期10月月考化学试卷河北省石家庄市第一中学2021-2022学年高一上学期期中考试化学试卷河北省保定定州市2022-2023学年高一上学期期中考试化学试题辽宁省六校协作体2023-2024学年高一上学期联考化学试题河北省石家庄市第二中学2023-2024高一上学期第一次诊断测评化学试题贵州省贵阳市清镇市第一中学2022-2023学年高一上学期期中考试化学试题河北省石家庄市第九中学2023-2024学年高一上学期第二次月考化学试题




