某兴趣小组利用经过初步处理的含有Fe2+的废液制备硫酸亚铁晶体的流程如图:____ ,若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为____ 。
(2)加入铁粉的作用是____ 。
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:____ 。
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为____ 。
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为____ ,该反应中每产生1molFe2O3,转移的电子数为____ NA。

(2)加入铁粉的作用是
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为
更新时间:2022-03-16 13:38:16
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】稀土元素在耐热钢中有重要的作用。某废渣含Eu2O3、Fe2O3、Al2O3、Ta2O5、MnO等物质。以此废渣为原料,设计如下工艺流程对资源进行回收,可得到较为纯净的TaCl5(氯化钽)和Eu2O3(氧化铕)。
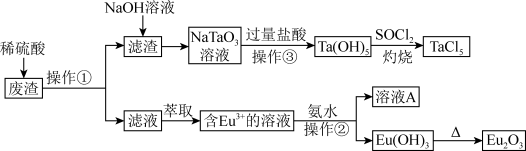
回答下列问题:
(1)操作②为_______ ,溶液A中含有的主要溶质为_______ (填化学名称)。
(2)滤渣与NaOH溶液反应的离子方程式为_______ ,灼烧时发生反应的化学方程式为_______ 。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。流程中为了用萃取剂除去金属杂质离子,进行萃取最适宜的pH是_______ (填字母),其原因是_______ 。
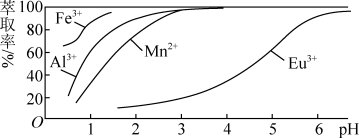
A.2.0左右 B.3.0左右 C.5.0左右
(4)FFC电解法可由金属氧化物直接电解制备金属单质,利用此法可电解Ta2O5制备稀土元素Ta,其原理如图所示。
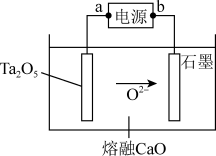
①电源b为_______ (填“正”或“负”)极。
②Ta2O5极发生的电极反应为_______ 。
③工业生产过程中,石墨电极需要定期更换,原因是:_______ 。

回答下列问题:
(1)操作②为
(2)滤渣与NaOH溶液反应的离子方程式为
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。流程中为了用萃取剂除去金属杂质离子,进行萃取最适宜的pH是

A.2.0左右 B.3.0左右 C.5.0左右
(4)FFC电解法可由金属氧化物直接电解制备金属单质,利用此法可电解Ta2O5制备稀土元素Ta,其原理如图所示。

①电源b为
②Ta2O5极发生的电极反应为
③工业生产过程中,石墨电极需要定期更换,原因是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):

已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)固体混合物B的成分是_______ 。它与NaOH溶液反应的离子方程式为_______ 。
(2)滤液A中铁元素的存在形式为________ (填离子符号),生成该离子与Fe元素有关的离子反应方程式为______ ,_______ 。设计要检验该铁元素的离子实验步骤为________ 。
(3)在滤液C中通入足量CO2的离子方程式为______ 。

已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)固体混合物B的成分是
(2)滤液A中铁元素的存在形式为
(3)在滤液C中通入足量CO2的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】海洋资源的利用具有非常广阔的前景。

I.海水制盐。
(1)粗盐中可溶性杂质离子包含 、
、 、
、 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________ (填字母)。
a. 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
b. 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
c. 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
(2)精盐水可用于氯碱工业,请写出氯碱工业总反应的离子方程式:___________ 。
Ⅱ.海水提溴。
(3)工业上常用“吹出法”提取溴,请写出用 吸收
吸收 的化学反应方程式:
的化学反应方程式:___________ 。
(4)含 的海水经“空气吹出、
的海水经“空气吹出、 吸收、通入氯气”后再蒸馏的目的是
吸收、通入氯气”后再蒸馏的目的是___________ 。
Ⅲ.从海带中提取碘的实验过程如图所示。

(5)步骤①中灼烧海带时,应将海带放入___________ (填仪器名称)中灼烧。
(6)请写出步骤④反应的离子方程式:___________ 。
Ⅳ.海水淡化。
(7)列举一种海水淡化的方法:___________ 。

I.海水制盐。
(1)粗盐中可溶性杂质离子包含
 、
、 、
、 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为a.
 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸b.
 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸c.
 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸(2)精盐水可用于氯碱工业,请写出氯碱工业总反应的离子方程式:
Ⅱ.海水提溴。
(3)工业上常用“吹出法”提取溴,请写出用
 吸收
吸收 的化学反应方程式:
的化学反应方程式:(4)含
 的海水经“空气吹出、
的海水经“空气吹出、 吸收、通入氯气”后再蒸馏的目的是
吸收、通入氯气”后再蒸馏的目的是Ⅲ.从海带中提取碘的实验过程如图所示。

(5)步骤①中灼烧海带时,应将海带放入
(6)请写出步骤④反应的离子方程式:
Ⅳ.海水淡化。
(7)列举一种海水淡化的方法:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
(1)在基态14C原子中,核外存在________ 对自旋相反的电子,基态氮原子的价层电子排布图为________ 。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___ ,其中氧原子的杂化方式为_____ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=_______ 。CO与N2结构相似,CO分子内σ键与π键个数之比为_________ 。
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是______ 。
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因:__________ ;
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有__________ 个铜原子。
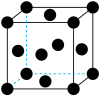
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为________ cm(阿伏伽德罗常数为NA,只要求列式表示)。
(1)在基态14C原子中,核外存在
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因:
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】磷化铝(AlP)和磷化氢( )都是粮食储备常用的高效熏蒸杀虫剂。
)都是粮食储备常用的高效熏蒸杀虫剂。
(1)AlP遇水蒸气会发生反应放出 气体,该反应的另一种产物的化学式为
气体,该反应的另一种产物的化学式为_______ 。
(2) 具有强还原性,能与
具有强还原性,能与 溶液反应,配平该反应的化学方程式:
溶液反应,配平该反应的化学方程式:_______ 。
_______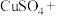 _______
_______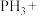 _______
_______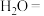 _______
_______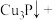 _______
_______ _______
_______
有0.4mol电子转移时被氧化的 的物质的量为
的物质的量为_______ mol。
(3)工业制备 的流程如图所示。
的流程如图所示。

①次磷酸属于_______ 元酸,其化学式为_______ 。
②白磷和烧碱溶液反应的化学方程式为:_______ 。
③若起始时有 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成_______ 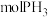 。
。
 )都是粮食储备常用的高效熏蒸杀虫剂。
)都是粮食储备常用的高效熏蒸杀虫剂。(1)AlP遇水蒸气会发生反应放出
 气体,该反应的另一种产物的化学式为
气体,该反应的另一种产物的化学式为(2)
 具有强还原性,能与
具有强还原性,能与 溶液反应,配平该反应的化学方程式:
溶液反应,配平该反应的化学方程式:_______
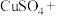 _______
_______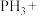 _______
_______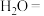 _______
_______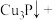 _______
_______ _______
_______
有0.4mol电子转移时被氧化的
 的物质的量为
的物质的量为(3)工业制备
 的流程如图所示。
的流程如图所示。
①次磷酸属于
②白磷和烧碱溶液反应的化学方程式为:
③若起始时有
 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成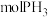 。
。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】有原子序数依次增大的X、Y、Z、W、M五种短周期主族元素,X与W同主族不相邻,Z与Y, Z与M均相邻且Z有aZ和bZ两种核素,其中bZ比aZ多2个中子,X与Z可形成两种(通常情况下)液态的无机化合物,其中一种是自然界分布最广的化合物。
(1)X既可与W,又可与Y形成WX和YX5两种离子化合物,写出中的WX中阴离子的电子式____________ ; YX5中阳离子的符号________________ 。
(2)X均可与Y和Z形成10电子的分子YXn和ZXm(或XnY和XmZ),用一个离子方程式表示这两种分子结合质子的能力_____________________________________________________ 。W与bZ所形成的一种化合物投入到水中能产生一种常见的气体单质,写出此反应的方程式(化学式中同位素bZ必需显示出来)_______________________________________________ 。
(3)在新疆和甘肃的交界处有一条山谷,被称为“魔鬼谷”,其地表浅处有一层磁铁矿,经常是晴天霹雳,雷雨倾盆;但树草却异常旺盛,其原因是雨水中含有一种能促进植物生长的离子是_________ ,当雨水浸到地表与磁铁矿接触时发生反应的离子方程式为____________________ 。
(1)X既可与W,又可与Y形成WX和YX5两种离子化合物,写出中的WX中阴离子的电子式
(2)X均可与Y和Z形成10电子的分子YXn和ZXm(或XnY和XmZ),用一个离子方程式表示这两种分子结合质子的能力
(3)在新疆和甘肃的交界处有一条山谷,被称为“魔鬼谷”,其地表浅处有一层磁铁矿,经常是晴天霹雳,雷雨倾盆;但树草却异常旺盛,其原因是雨水中含有一种能促进植物生长的离子是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】铁及其化合物在生产生活中有重要用途。某化学兴趣小组同学设计以下实验探究铁及其化合物性质。
Ⅰ.氢氧化亚铁的制备:
两组同学分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图1)
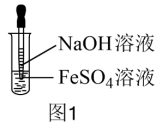
(1) FeSO4可由铁粉还原Fe2(SO4)3制得,反应的离子方程式是:_______ 。
(2)该方法能观察到白色Fe(OH)2沉淀,但沉淀颜色快速发生变化,其颜色变化为_______ 。
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图2。

(3)实验时,先_______ (填“打开”或“关闭”)止水夹K,然后打开分液漏斗的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后, _______ (填“打开”或“关闭”)止水夹K,制得白色Fe(OH)2沉淀,且沉淀能持续一段时间不变色。
Ⅱ.“铁与水反应”的实验,并检验产物的性质:

(4)①A装置的作用是_______ B中反应的化学方程式为_______ 。
②D的作用是_______ 。
③点燃E处酒精灯之前应进行的操作是_______ 。
Ⅰ.氢氧化亚铁的制备:
两组同学分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图1)

(1) FeSO4可由铁粉还原Fe2(SO4)3制得,反应的离子方程式是:
(2)该方法能观察到白色Fe(OH)2沉淀,但沉淀颜色快速发生变化,其颜色变化为
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图2。

(3)实验时,先
Ⅱ.“铁与水反应”的实验,并检验产物的性质:

(4)①A装置的作用是
②D的作用是
③点燃E处酒精灯之前应进行的操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】小组同学用FeSO4·7H2O晶体和蒸馏水配制0.5mol·L−1FeSO4溶液(pH为3.3)。1h后,溶液变黄。24h后,产生黄褐色沉淀,测得上层清液pH为1.4。
(1)取少量黄色溶液,___________ (填操作和现象),证明黄色溶液中含有Fe3+。
(2)取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为___________ 。
(3)探究溶液变黄的原因。
①实验证实,溶液变黄是因为空气中的O2将Fe2+氧化,反应的离子方程式为___________ 。
②用FeSO4和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
a.实验Ⅲ和Ⅳ说明___________ 对溶液变黄快慢有影响。
b.实验Ⅱ比Ⅰ更快变黄的原因是___________ 。
(4)检验黄褐色沉淀的成分。
①通过下列实验证实,黄褐色沉淀中含有SO 。
。
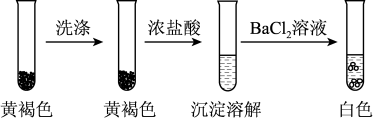
a.证实黄褐色沉淀中含有SO 的证据是
的证据是___________ 。
b.洗涤黄褐色沉淀的目的是___________ 。
②进一步实验证实黄褐色沉淀为Fe(OH)SO4.将反应的离子方程式补充完整并将完整的方程式转移至答题卷___________ :
Fe3++___________+___________=Fe(OH)SO4↓+___________。
(1)取少量黄色溶液,
(2)取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为
(3)探究溶液变黄的原因。
①实验证实,溶液变黄是因为空气中的O2将Fe2+氧化,反应的离子方程式为
②用FeSO4和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| c(FeSO4)/(mol·L−1) | 0.5 | 0.25 | 0.5 | 0.25 |
| 溶液pH | 3.3 | 3.5 | 2.9 | 2.9 |
| 初始颜色 | 浅绿色 | 浅绿色,比Ⅰ浅 | 浅绿色,同Ⅰ | 浅绿色,同Ⅱ |
| 0.5h颜色 | 浅绿色 | 黄绿色 | 浅绿色 | 浅绿色 |
| 5h颜色 | 黄色 | 黄色 | 浅黄色 | 浅黄色(比Ⅲ浅) |
b.实验Ⅱ比Ⅰ更快变黄的原因是
(4)检验黄褐色沉淀的成分。
①通过下列实验证实,黄褐色沉淀中含有SO
 。
。
a.证实黄褐色沉淀中含有SO
 的证据是
的证据是b.洗涤黄褐色沉淀的目的是
②进一步实验证实黄褐色沉淀为Fe(OH)SO4.将反应的离子方程式补充完整并将完整的方程式转移至答题卷
Fe3++___________+___________=Fe(OH)SO4↓+___________。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】几种中学常见的单质及化合物的相互转化关系如图(部分反应物或产物已省略):
②A是黄铁矿的主要成分,由两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,反应⑤中乙转化为一种常见的温室气体。试根据上述信息,回答下列问题:
(1)A的化学式为______ 。
(2)工业上用A为原料来制备D,写出反应②的化学方程式______ 。
(3)F与丁单质反应也可以得到G,试写出该反应的离子方程式______ 。
(4)写出反应⑤的化学方程式______ 。
(5)化合物M与H组成元素相同,可以将G转化为F,且不引进新杂质。M中化学键的类型为_____ (填“离子键、极性键或非极性键”)试写出M在酸性环境下将G氧化为F的离子方程式______ 。
②A是黄铁矿的主要成分,由两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,反应⑤中乙转化为一种常见的温室气体。试根据上述信息,回答下列问题:
(1)A的化学式为
(2)工业上用A为原料来制备D,写出反应②的化学方程式
(3)F与丁单质反应也可以得到G,试写出该反应的离子方程式
(4)写出反应⑤的化学方程式
(5)化合物M与H组成元素相同,可以将G转化为F,且不引进新杂质。M中化学键的类型为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
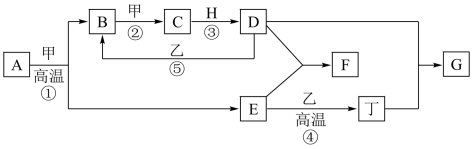
【推荐1】实验室里用如图所示仪器和药品来制取纯净的无水氯化铝(2Al+3Cl2 2AlCl3)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。(氯化铝易吸水)
2AlCl3)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。(氯化铝易吸水)
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)_______ ,其中②与④装置相连时,玻璃管接口(用装置中字母表示)应是_______ 接_______ 。
(2)装置②的作用是_______ ;装置④的作用是_______ 。
(3)实验开始时,应首先检验装置的_______ ,实验结束时,应先熄灭_______ 处的酒精灯。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为_______
(5)装置⑥中发生的离子反应方程式为_______ 。
 2AlCl3)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。(氯化铝易吸水)
2AlCl3)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。(氯化铝易吸水)| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  |  |  | 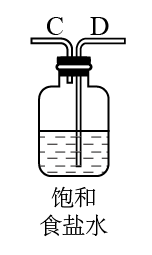 |  | 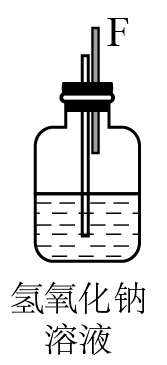 |
(2)装置②的作用是
(3)实验开始时,应首先检验装置的
(4)在装置⑤的烧瓶中,发生反应的化学方程式为
(5)装置⑥中发生的离子反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】下图是实验室制取Cl2并以纯净、干燥的Cl2为原料进行特定反应的实验装置图:
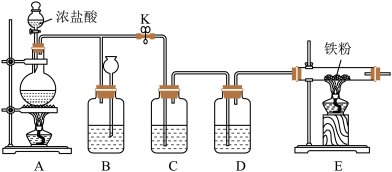
(1)写出实验室制取氯气的离子反应方程式:_______ 。
(2)C中盛装的液体是_______ ,D中盛装的液体是_______ 。
(3)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃E处的酒精灯。E装置内盛有铁粉,写出E装置中反应的化学方程式:_______ 。
(4)E处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_______ ,B的作用是_______ 。
(5)该装置的设计是否合理_______ (填“是“或“否”),如果不合理,请加以改正_______ 。

(1)写出实验室制取氯气的离子反应方程式:
(2)C中盛装的液体是
(3)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃E处的酒精灯。E装置内盛有铁粉,写出E装置中反应的化学方程式:
(4)E处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是
(5)该装置的设计是否合理
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I.NA是阿伏加德罗常数,完成下列问题。
(1)①CO2;②H2O;③BaSO4;④NaClO;⑤硫酸;⑥乙醇;⑦Ba(OH)2;⑧NaHSO4溶液;⑨氨气;⑩NH3·H2O。上述物质属于强电解质的是_______ ;属于弱电解质的是_______ ;属于非电解质的是_______ ;
(2)14.9 g NaClO溶解在水中,要使Na+数与水分子数之比为1:100,则需要水的个数为_______ 。
II.FeCl3在工农业生产中有广泛的应用,某实验小组用如下装置模拟干法制备FeCl3。已知:FeCl3加热易升华,在空气中易潮解。
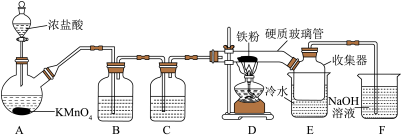
回答下列问题:
(3)装置C的作用是_______ ;硬质玻璃管直接接入收集器而不用导管连接D和E的原因是_______ 。
(4)上述装置存在一处缺陷,会导致产品FeCl3不纯,改进的方法是_______ 。
(5)称取收集器中粗产品m g配制成100 mL溶液,进行FeCl3纯度的测定(粗产品中的杂质不参与反应,已知:I2+2Na2S2O3=Na2S4O6+2NaI)。取10mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mL c mol/L的Na2S2O3溶液反应,则FeCl3纯度为_______ 。
(1)①CO2;②H2O;③BaSO4;④NaClO;⑤硫酸;⑥乙醇;⑦Ba(OH)2;⑧NaHSO4溶液;⑨氨气;⑩NH3·H2O。上述物质属于强电解质的是
(2)14.9 g NaClO溶解在水中,要使Na+数与水分子数之比为1:100,则需要水的个数为
II.FeCl3在工农业生产中有广泛的应用,某实验小组用如下装置模拟干法制备FeCl3。已知:FeCl3加热易升华,在空气中易潮解。

回答下列问题:
(3)装置C的作用是
(4)上述装置存在一处缺陷,会导致产品FeCl3不纯,改进的方法是
(5)称取收集器中粗产品m g配制成100 mL溶液,进行FeCl3纯度的测定(粗产品中的杂质不参与反应,已知:I2+2Na2S2O3=Na2S4O6+2NaI)。取10mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mL c mol/L的Na2S2O3溶液反应,则FeCl3纯度为
您最近一年使用:0次



