名校
解题方法
1 . 硫代硫酸钠( )常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
)常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
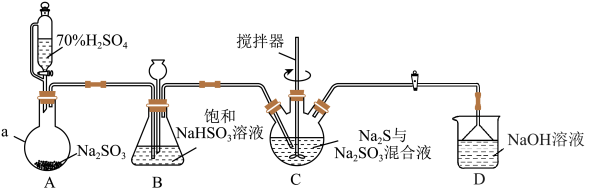
回答下列问题:
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若__________ ,则整个装置气密性良好。
(2)仪器C的名称是__________ ;装置D的作用是__________ 。
(3)装置A中发生反应的化学方程式为__________ 。
(4)装置C中的反应分两步:第一步通入 后溶液中
后溶液中 浓度明显增大,则第一步反应的离子方程式为
浓度明显增大,则第一步反应的离子方程式为__________ ;第二步反应为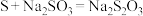 ,已知第二步反应相对较慢,则装置C中反应达到终点的现象是
,已知第二步反应相对较慢,则装置C中反应达到终点的现象是__________ 。
(5)将制得的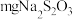 样品溶于水,加入
样品溶于水,加入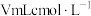 碘水溶液时,二者恰好完全反应(
碘水溶液时,二者恰好完全反应( ),则样品的纯度为
),则样品的纯度为__________ 。
 )常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
)常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
回答下列问题:
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若
(2)仪器C的名称是
(3)装置A中发生反应的化学方程式为
(4)装置C中的反应分两步:第一步通入
 后溶液中
后溶液中 浓度明显增大,则第一步反应的离子方程式为
浓度明显增大,则第一步反应的离子方程式为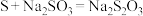 ,已知第二步反应相对较慢,则装置C中反应达到终点的现象是
,已知第二步反应相对较慢,则装置C中反应达到终点的现象是(5)将制得的
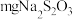 样品溶于水,加入
样品溶于水,加入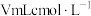 碘水溶液时,二者恰好完全反应(
碘水溶液时,二者恰好完全反应( ),则样品的纯度为
),则样品的纯度为
您最近一年使用:0次
名校
解题方法
2 . 为验证SO2的性质并制备NaHSO3和Na2SO3,设计如图所示实验装置(部分夹持装置略去)。
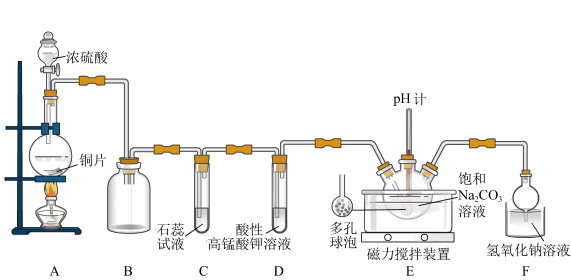
(1)装置A中反应的化学方程式是_______ 。
(2)盛放浓硫酸的仪器名称是_______ ,装置B的作用是_______ 。
(3)试管D中发生反应的离子方程式为_______ 。
(4)装置E中设计多孔球泡的目的是_______ 。
(5)已知:Na2SO3水溶液中H2SO3、 、
、 的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。
的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。
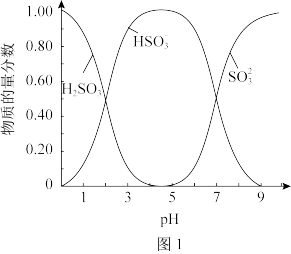
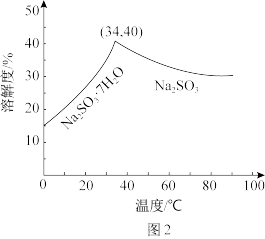
由NaHSO3溶液制备Na2SO3的实验方案为边搅拌边向NaHSO3溶液中加入NaOH溶液,测量溶液的pH,当pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于_______ ℃条件下趁热过滤。滴加NaOH溶液不能过慢的原因是_______ 。

(1)装置A中反应的化学方程式是
(2)盛放浓硫酸的仪器名称是
(3)试管D中发生反应的离子方程式为
(4)装置E中设计多孔球泡的目的是
(5)已知:Na2SO3水溶液中H2SO3、
 、
、 的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。
的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。

由NaHSO3溶液制备Na2SO3的实验方案为边搅拌边向NaHSO3溶液中加入NaOH溶液,测量溶液的pH,当pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于
您最近一年使用:0次
名校
解题方法
3 . 在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析下列一组有现象变化的化学反应。
(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:_______ 。
(2)Ⅲ中加碱时出现的现象是_______ 。
(3)Ⅳ中加酸时出现的现象是_______ ,用离子方程式解释产生此现象的原因:_______ 。
(4)滴加试剂顺序的变化会影响溶液中的现象和发生的反应。请继续分析以下实验。
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0mL0.1mol·L-1Fe(NO3)2溶液中_______ ,如果溶液变红色,说明溶液中含有Fe3+,证明加酸时溶液中发生了反应。(请将上述操作补充完整)
②推测溶液中产生Fe3+的可能原因有两种:
a._______ 。
b._______ 。
| 实验及操作 | 现象 | ||
| 装置 | 试管 | 滴管 | |
 | 饱和Na2SiO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol·L-1NaOH溶液;再滴加1.5mL1.0mol·L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol·L-1AlCl3溶液 | Ⅱ.加碱时_______;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol·L-1Fe(NO3)2溶液 | Ⅲ.加碱时_______;加酸后得到棕黄色溶液 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后_______ | ||
(2)Ⅲ中加碱时出现的现象是
(3)Ⅳ中加酸时出现的现象是
(4)滴加试剂顺序的变化会影响溶液中的现象和发生的反应。请继续分析以下实验。
| 实验及操作 | 现象 | ||
| 装置 | 试管 | 滴管 | |
 | 0.1mol·L-1Fe(NO3)2溶液 | 先滴加1.5mL1.0mol·L-1H2SO4溶液;再滴加1.0mL0.5mol·L-1NaOH溶液 | Ⅴ.加酸时溶液有明显现象;加碱后溶液依然没有明显变化 |
②推测溶液中产生Fe3+的可能原因有两种:
a.
b.
您最近一年使用:0次
4 . 溴、碘主要存在于海水里,有“海洋元素”的美称。我国海带产量位居世界第一,海带除供食用外,还可大量用于制碘。从海带中提取碘单质的工艺流程如图。请回答下列问题:
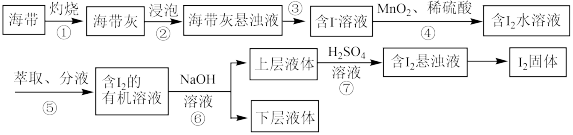
(1)溴、碘均为第ⅦA族元素,位于元素周期表前五周期的第ⅦA族元素对应的最简单氢化物中沸点最高的是_____ (填氢化物的化学式),位于元素周期表前五周期的第ⅦA族元素对应的单质的氧化性由强到弱的顺序为_____ (填化学式), 的空间结构为
的空间结构为_____ 。
(2)步骤④发生反应的离子方程式为_____ (已知: 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用_____ (填标号)代替。
A. B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

“萃取、分液”的具体操作如下:
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用_____ 吸收含溴单质的空气来达到富集溴元素的目的。

(1)溴、碘均为第ⅦA族元素,位于元素周期表前五周期的第ⅦA族元素对应的最简单氢化物中沸点最高的是
 的空间结构为
的空间结构为(2)步骤④发生反应的离子方程式为
 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用A.
 B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

“萃取、分液”的具体操作如下:
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用
您最近一年使用:0次
5 . 近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、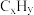 、
、 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。

在图示的转化中,被还原的元素是___________ ,X的化学式为___________ 。
(2)SCR技术可使 与
与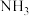 直接反应,实现无害转化。假设
直接反应,实现无害转化。假设 是NO时,发生反应的化学方程式是
是NO时,发生反应的化学方程式是_______ 。
(3)利用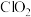 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: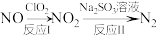 。反应I的化学方程式是
。反应I的化学方程式是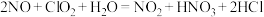 ,反应II的离子方程式是
,反应II的离子方程式是___________ 。
(4)加入过量次氯酸钠可使废水中 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。
①检验废水中是否存在 的方法是
的方法是___________ 。
②若处理废水产生了0.448L (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为___________ mL。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、
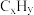 、
、 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
在图示的转化中,被还原的元素是
(2)SCR技术可使
 与
与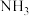 直接反应,实现无害转化。假设
直接反应,实现无害转化。假设 是NO时,发生反应的化学方程式是
是NO时,发生反应的化学方程式是(3)利用
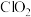 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: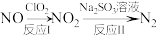 。反应I的化学方程式是
。反应I的化学方程式是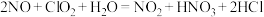 ,反应II的离子方程式是
,反应II的离子方程式是(4)加入过量次氯酸钠可使废水中
 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。①检验废水中是否存在
 的方法是
的方法是②若处理废水产生了0.448L
 (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
您最近一年使用:0次
6 . 化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:
(1)煤的气化是将煤转化为气体燃料,其中重要的一步反应是高温下焦炭与水蒸气反应制备水煤气(CO、H2),该反应的化学方程式为___________ 。
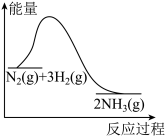
(2)合成氨工业是煤化工产业链中非常重要的一步。合成氨反应过程中的能量变化如图所示,则该反应为___________ (填“吸热”或“放热”)反应。
(3)实验室模拟工业合成氨,向2L恒容密闭容器内充入1molN2反应过程和3molH2,在一定条件下发生反应。若经过5min后,测得容器内NH3的物质的量为1mol,则这段时间内,v(N2)=___________ ,此时容器内H2的物质的量浓度为___________ 。
(4)天然气的主要成分是CH4.在酸性介质中,利用反应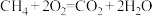 可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
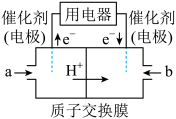
通入b气体的电极名称为___________ ,通入a气体的电极上反应式为___________ 。
(1)煤的气化是将煤转化为气体燃料,其中重要的一步反应是高温下焦炭与水蒸气反应制备水煤气(CO、H2),该反应的化学方程式为
(2)合成氨工业是煤化工产业链中非常重要的一步。合成氨反应过程中的能量变化如图所示,则该反应为

(3)实验室模拟工业合成氨,向2L恒容密闭容器内充入1molN2反应过程和3molH2,在一定条件下发生反应。若经过5min后,测得容器内NH3的物质的量为1mol,则这段时间内,v(N2)=
(4)天然气的主要成分是CH4.在酸性介质中,利用反应
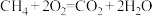 可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
通入b气体的电极名称为
您最近一年使用:0次
2023-07-16更新
|
81次组卷
|
2卷引用:辽宁省鞍山市台安县高级中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
7 . 氮元素与人类的生命、生产等活动息息相关。
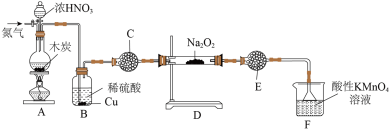
(1)亚硝酸钠( )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:① ;
;
②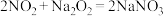
③酸性条件下, 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②装置B中的实验现象为___________ 。
③装置C的作用为___________ 。
④装置F中发生反应的离子方程式为___________ 。
(2)生物脱氮法流程如下:
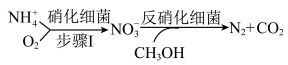
步骤I中若 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为___________ 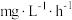 。
。
(3)目前,湿法 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一
已知:两组实验中 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为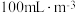
①图1是 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式___________ 。
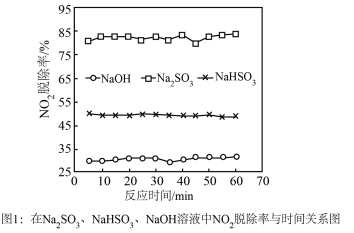
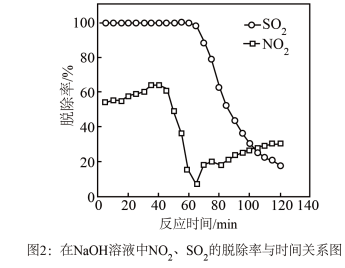
②实验发现,在相同实验条件下利用 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因___________ 。
(1)亚硝酸钠(
 )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:①
 ;
;②
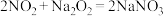
③酸性条件下,
 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为
②装置B中的实验现象为
③装置C的作用为
④装置F中发生反应的离子方程式为
(2)生物脱氮法流程如下:

步骤I中若
 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为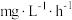 。
。(3)目前,湿法
 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一已知:两组实验中
 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为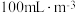
①图1是
 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式
②实验发现,在相同实验条件下利用
 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因
您最近一年使用:0次
2023-07-14更新
|
437次组卷
|
2卷引用:辽宁省辽南协作校2022-2023学年高一下学期期末考试化学试题
解题方法
8 . 海水中蕴藏着大量资源,利用海水可提取溴和镁,主要工业生产流程如下图所示:
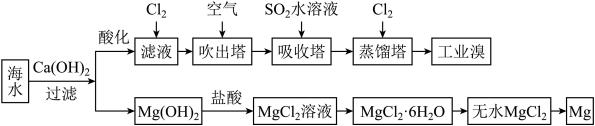
请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为___________ 。
(2)提取溴的过程中,经过两次 的转化,其目的是
的转化,其目的是___________ 。
(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
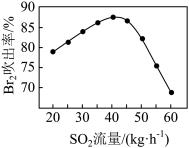
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是___________ 。
(4)工业上也可用 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。________
___________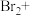 ___________
___________ ___________
___________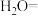 __________
__________
 ___________
___________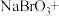 ___________
___________
(5)从 溶液中得到
溶液中得到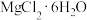 晶体的主要操作为
晶体的主要操作为___________ 、___________ 、过滤、洗涤、干燥(在HCl气流的保护下)。
(6)工业上用无水氯化镁得到金属镁的冶炼方法为___________ 。
(7)请写出上述过程中可以循环利用的一种物质___________ 。(写出化学式)。

请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为
(2)提取溴的过程中,经过两次
 的转化,其目的是
的转化,其目的是(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是(4)工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。___________
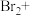 ___________
___________ ___________
___________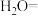 __________
__________
 ___________
___________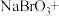 ___________
___________
(5)从
 溶液中得到
溶液中得到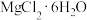 晶体的主要操作为
晶体的主要操作为(6)工业上用无水氯化镁得到金属镁的冶炼方法为
(7)请写出上述过程中可以循环利用的一种物质
您最近一年使用:0次
9 . 以黄铁矿(主要成分为 ,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
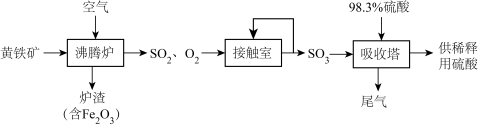
 ,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
| A.将黄铁矿粉碎,可加快其在沸腾炉中的化学反应速率 |
B.沸腾炉中发生反应的化学方程式为: |
C.接触室中排放出的 、 、 循环利用,可提高原料利用率 循环利用,可提高原料利用率 |
D.依据上述流程,当最终生成 时,共转移 时,共转移 电子 电子 |
您最近一年使用:0次
解题方法
10 . 为治理雾霾天气,可采用多种方法实现工业废气脱硫。
Ⅰ.软锰矿浆(主要成分 ,含有少量铁、铝等氧化物)可脱除燃煤烟气中的
,含有少量铁、铝等氧化物)可脱除燃煤烟气中的 ,又可制得电池材料
,又可制得电池材料 。主要流程如图:
。主要流程如图:
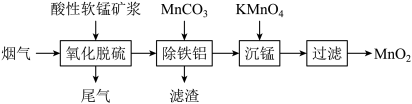
(1)提高烟气吸收效率的可行措施有___________ (写出两点)。
(2)写出“沉锰”步骤发生反应的离子方程式:___________ 。
(3)现将该烟气以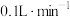 的流量通入到装有
的流量通入到装有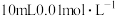 的
的 溶液的装置中,
溶液的装置中, 后,
后, 恰好完全反应。计算该烟气中
恰好完全反应。计算该烟气中 含量:
含量:___________  。
。
II.活性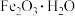 是一种固体脱硫剂(无水
是一种固体脱硫剂(无水 无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性
无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性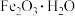 脱除沼气中的
脱除沼气中的 可转化成
可转化成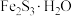 。
。
(4)“脱除沼气中 ”反应的化学方程式为
”反应的化学方程式为___________ 。
(5)工业上要求脱除过程温度不能超过 ,原因是
,原因是___________ 。
Ⅲ.有人设想利用电化学原理除去 ,并将化学能转化为电能。装置图如下。
,并将化学能转化为电能。装置图如下。
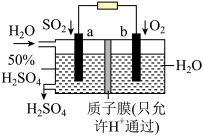
(6)电池的正极是___________ 。(填“a”或“b”)
(7)写出a电极的电极反应___________ 。
Ⅰ.软锰矿浆(主要成分
 ,含有少量铁、铝等氧化物)可脱除燃煤烟气中的
,含有少量铁、铝等氧化物)可脱除燃煤烟气中的 ,又可制得电池材料
,又可制得电池材料 。主要流程如图:
。主要流程如图:
(1)提高烟气吸收效率的可行措施有
(2)写出“沉锰”步骤发生反应的离子方程式:
(3)现将该烟气以
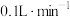 的流量通入到装有
的流量通入到装有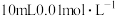 的
的 溶液的装置中,
溶液的装置中, 后,
后, 恰好完全反应。计算该烟气中
恰好完全反应。计算该烟气中 含量:
含量: 。
。II.活性
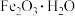 是一种固体脱硫剂(无水
是一种固体脱硫剂(无水 无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性
无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性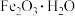 脱除沼气中的
脱除沼气中的 可转化成
可转化成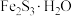 。
。(4)“脱除沼气中
 ”反应的化学方程式为
”反应的化学方程式为(5)工业上要求脱除过程温度不能超过
 ,原因是
,原因是Ⅲ.有人设想利用电化学原理除去
 ,并将化学能转化为电能。装置图如下。
,并将化学能转化为电能。装置图如下。
(6)电池的正极是
(7)写出a电极的电极反应
您最近一年使用:0次
2023-07-13更新
|
294次组卷
|
2卷引用:辽宁省五校(大连二十四中、东北育才等)2022-2023学年高一下学期期末考试化学试题



