为治理雾霾天气,可采用多种方法实现工业废气脱硫。
Ⅰ.软锰矿浆(主要成分 ,含有少量铁、铝等氧化物)可脱除燃煤烟气中的
,含有少量铁、铝等氧化物)可脱除燃煤烟气中的 ,又可制得电池材料
,又可制得电池材料 。主要流程如图:
。主要流程如图:
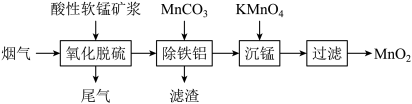
(1)提高烟气吸收效率的可行措施有___________ (写出两点)。
(2)写出“沉锰”步骤发生反应的离子方程式:___________ 。
(3)现将该烟气以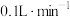 的流量通入到装有
的流量通入到装有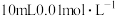 的
的 溶液的装置中,
溶液的装置中, 后,
后, 恰好完全反应。计算该烟气中
恰好完全反应。计算该烟气中 含量:
含量:___________  。
。
II.活性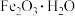 是一种固体脱硫剂(无水
是一种固体脱硫剂(无水 无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性
无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性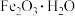 脱除沼气中的
脱除沼气中的 可转化成
可转化成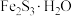 。
。
(4)“脱除沼气中 ”反应的化学方程式为
”反应的化学方程式为___________ 。
(5)工业上要求脱除过程温度不能超过 ,原因是
,原因是___________ 。
Ⅲ.有人设想利用电化学原理除去 ,并将化学能转化为电能。装置图如下。
,并将化学能转化为电能。装置图如下。
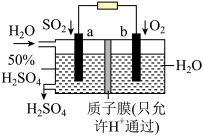
(6)电池的正极是___________ 。(填“a”或“b”)
(7)写出a电极的电极反应___________ 。
Ⅰ.软锰矿浆(主要成分
 ,含有少量铁、铝等氧化物)可脱除燃煤烟气中的
,含有少量铁、铝等氧化物)可脱除燃煤烟气中的 ,又可制得电池材料
,又可制得电池材料 。主要流程如图:
。主要流程如图:
(1)提高烟气吸收效率的可行措施有
(2)写出“沉锰”步骤发生反应的离子方程式:
(3)现将该烟气以
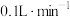 的流量通入到装有
的流量通入到装有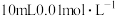 的
的 溶液的装置中,
溶液的装置中, 后,
后, 恰好完全反应。计算该烟气中
恰好完全反应。计算该烟气中 含量:
含量: 。
。II.活性
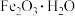 是一种固体脱硫剂(无水
是一种固体脱硫剂(无水 无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性
无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性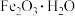 脱除沼气中的
脱除沼气中的 可转化成
可转化成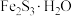 。
。(4)“脱除沼气中
 ”反应的化学方程式为
”反应的化学方程式为(5)工业上要求脱除过程温度不能超过
 ,原因是
,原因是Ⅲ.有人设想利用电化学原理除去
 ,并将化学能转化为电能。装置图如下。
,并将化学能转化为电能。装置图如下。
(6)电池的正极是
(7)写出a电极的电极反应
更新时间:2023-07-13 13:02:38
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】四氯化碳( )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下:
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下:

已知:
① 可与溴水反应生成硫酸和氢溴酸:
可与溴水反应生成硫酸和氢溴酸:
② 与
与 在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
⑧硫单质的沸点445℃, 的沸点46.5℃,
的沸点46.5℃, 的沸点76.8℃、密度1.6g/cm3。
的沸点76.8℃、密度1.6g/cm3。
(1) 分子的空间结构为
分子的空间结构为______ 。
(2)上述仪器的连接顺序为:a→______→______→______→______→______→______→______→______。______ 。
A装置中导管k的作用为______ 。在制备气体的实验中若用普通的分液漏斗,在其他条件相同的情况下,从装置A中排出气体的体积与本实验相比______ (填“偏大”“偏小”或“不变”)。
(3)B装置中发生反应的化学方程式为______ 。
(4)实验过程中F装置的作用有______ 、______ 。反应结束后关闭 、
、 ,此时F装置的作用为
,此时F装置的作用为______ 。
(5)反应结束先过滤除去固体,再经过______ (填操作名称)可得到 。
。
 )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下:
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下:
已知:
①
 可与溴水反应生成硫酸和氢溴酸:
可与溴水反应生成硫酸和氢溴酸:②
 与
与 在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;⑧硫单质的沸点445℃,
 的沸点46.5℃,
的沸点46.5℃, 的沸点76.8℃、密度1.6g/cm3。
的沸点76.8℃、密度1.6g/cm3。(1)
 分子的空间结构为
分子的空间结构为(2)上述仪器的连接顺序为:a→______→______→______→______→______→______→______→______。
A装置中导管k的作用为
(3)B装置中发生反应的化学方程式为
(4)实验过程中F装置的作用有
 、
、 ,此时F装置的作用为
,此时F装置的作用为(5)反应结束先过滤除去固体,再经过
 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】 是高效安全灭菌消毒剂,部分性质如下:
是高效安全灭菌消毒剂,部分性质如下:
实验室可利用反应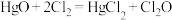 制取
制取 ,装置如图所示:
,装置如图所示:_______ 。
(2)装置①中制取氯气时需要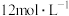 盐酸,若加入盐酸的体积是
盐酸,若加入盐酸的体积是 ,制取氯气的物质的量小于
,制取氯气的物质的量小于 ,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是
,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是_______ 。
(3)③中试剂的名称是_______ 。
(4)④中反应氧化剂和还原剂物质的量比值是_______ 。
(5)⑥中 与水反应制取
与水反应制取 ,反应的化学方程式是
,反应的化学方程式是_______ ; 中混有盐酸,原因是
中混有盐酸,原因是_______ (用化学方程式表示)。
(6)⑦中 溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是_______ 。
 是高效安全灭菌消毒剂,部分性质如下:
是高效安全灭菌消毒剂,部分性质如下:| 物理性质 | 化学性质 |
| 常温下,具有强烈刺激性气味的黄棕色气体 熔点:  ℃;沸点:3.8℃;42℃以上分解为 ℃;沸点:3.8℃;42℃以上分解为 和 和 。 。 | 强氧化性;与有机物、还原剂接触或浓度过高时会发生爆炸;易溶于水且会与水反应生成次氯酸 |
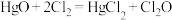 制取
制取 ,装置如图所示:
,装置如图所示: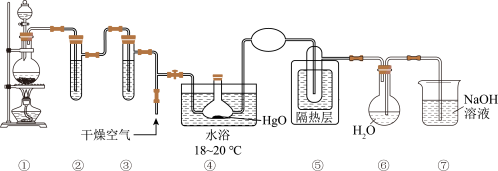
(2)装置①中制取氯气时需要
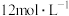 盐酸,若加入盐酸的体积是
盐酸,若加入盐酸的体积是 ,制取氯气的物质的量小于
,制取氯气的物质的量小于 ,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是
,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是(3)③中试剂的名称是
(4)④中反应氧化剂和还原剂物质的量比值是
(5)⑥中
 与水反应制取
与水反应制取 ,反应的化学方程式是
,反应的化学方程式是 中混有盐酸,原因是
中混有盐酸,原因是(6)⑦中
 溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】碳和硅是带来人类文明的重要元素。
(1)工业上用焦炭在高温下还原二氧化硅可制得含有少量杂质的粗硅。写出该反应的化学反应方程式_______ 。
(2)100℃时,将足量的碳酸氢钠固体置于V L真空恒容容器中,已知: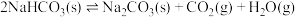 ,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
①下列说法不正确的是_______ 。
A.可通过CO2(g)和H2O(g)的物质的量比值不变来判断该反应达到平衡
B.保持温度、体积不变,平衡体系中不断移走H2O(g),正反应速率增大,逆反应速率减小,平衡向右移动
C.保持体积不变,升高温度,反应速率加快
D.保持温度、体积不变,平衡体系中不断通入等物质的量的CO2(g)和H2O(g), 最终将完全转变为
最终将完全转变为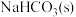
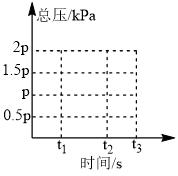
②上述平衡体系t1时刻总压为p(如图),保持温度不变,t1时刻突然将容器的体积变为原来一半且保持不变,到t2时刻达到平衡,在图中画出 时体系的总压
时体系的总压______ 。
(3)大气中部分CO2溶于水并与水进一步发生反应。常温下,反应方程式如下:
①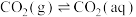
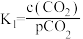
②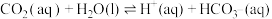 K2
K2
其中pCO2为CO2(g)在空气中的分压,c(CO2)为CO2在水溶液中的平衡浓度。当大气压强为p kPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为_______ mol/L(用K1、K2、p、x、Kw表示,考虑水的电离,忽略 的电离)
的电离)
(4)甲烷气相热分解反应方程式为: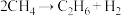 ,该反应的机理如下:
,该反应的机理如下:
① ,②_______,③
,②_______,③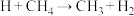 ④
④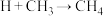 ,补充反应②反应方程式:
,补充反应②反应方程式:_______ 。
(5)在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响。如:
地壳中存在CaAl2Si2O8、Mg2SiO4和CaMg2Al2Si3O12,在地壳区域高压条件下,有利于_______ (写化学式)生成,试结合上述数据解释原因_______ 。
(1)工业上用焦炭在高温下还原二氧化硅可制得含有少量杂质的粗硅。写出该反应的化学反应方程式
(2)100℃时,将足量的碳酸氢钠固体置于V L真空恒容容器中,已知:
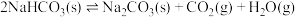 ,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)①下列说法不正确的是
A.可通过CO2(g)和H2O(g)的物质的量比值不变来判断该反应达到平衡
B.保持温度、体积不变,平衡体系中不断移走H2O(g),正反应速率增大,逆反应速率减小,平衡向右移动
C.保持体积不变,升高温度,反应速率加快
D.保持温度、体积不变,平衡体系中不断通入等物质的量的CO2(g)和H2O(g),
 最终将完全转变为
最终将完全转变为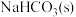
②上述平衡体系t1时刻总压为p(如图),保持温度不变,t1时刻突然将容器的体积变为原来一半且保持不变,到t2时刻达到平衡,在图中画出
 时体系的总压
时体系的总压
(3)大气中部分CO2溶于水并与水进一步发生反应。常温下,反应方程式如下:
①
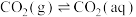
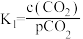
②
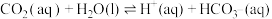 K2
K2其中pCO2为CO2(g)在空气中的分压,c(CO2)为CO2在水溶液中的平衡浓度。当大气压强为p kPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为
 的电离)
的电离)(4)甲烷气相热分解反应方程式为:
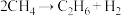 ,该反应的机理如下:
,该反应的机理如下:①
 ,②_______,③
,②_______,③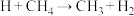 ④
④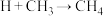 ,补充反应②反应方程式:
,补充反应②反应方程式:(5)在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响。如:

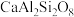 (钙长石) (钙长石) |  (镁橄榄石) (镁橄榄石) | 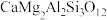 (钙镁石榴子石) | |
| 摩尔质量(g/mol) | 278 | 140 | 418 |
| 密度(g/cm) | 2.70 | 3.22 | 3.50 |
地壳中存在CaAl2Si2O8、Mg2SiO4和CaMg2Al2Si3O12,在地壳区域高压条件下,有利于
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】氮氧化合物和二氧化硫是引起雾霾重要物质,工业用多种方法来治理。某种综合处理含 废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
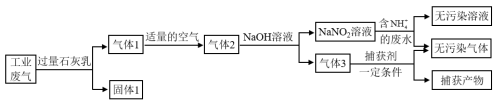
已知:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)NO是___________ 色的气体,___________ (填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为___________ 。
(2)SO2造成的一种常见的环境污染为___________ 。
(3)固体1的主要成分有Ca(OH)2、___________ 、___________ (填化学式)。
(4)验证废水中NH 已基本除净的方法是
已基本除净的方法是___________ (写出操作现象与结论)。
(5)捕获剂捕获的气体主要是___________ (填化学式)。
(6)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,I2可以使淀粉溶液变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl固体。需选用的物质是___________ (填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
 废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
已知:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)NO是
(2)SO2造成的一种常见的环境污染为
(3)固体1的主要成分有Ca(OH)2、
(4)验证废水中NH
 已基本除净的方法是
已基本除净的方法是(5)捕获剂捕获的气体主要是
(6)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,I2可以使淀粉溶液变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl固体。需选用的物质是
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为 5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表。
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___________________________________ 。增加压强,NO的转化率______________ (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______ 脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是________________ 。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如图所示。由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_________ (填“增大”、“不变”或“减小”)。

(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为 5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②随着吸收反应的进行,吸收剂溶液的pH逐渐
③由实验结果可知,脱硫反应速率
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如图所示。由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降落在热电厂附近的雨水进行实验。
① 测得该雨水样品的pH为4.73;② 向雨水样品中滴加BaCl2溶液,有白色沉淀生成;③ 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为_________________________________ 。
(2)分析上述数据变化,你认为形成这一变化的原因是_____________________ 。
(3)兴趣小组同学取某一时段的这种雨水VL,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算(列出计算过程):
① 该V L雨水中溶解SO2的体积(标准状况)为______________ mL。
计算过程:
② 生成沉淀物的质量范围为________________________ 。
① 测得该雨水样品的pH为4.73;② 向雨水样品中滴加BaCl2溶液,有白色沉淀生成;③ 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为
(2)分析上述数据变化,你认为形成这一变化的原因是
(3)兴趣小组同学取某一时段的这种雨水VL,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算(列出计算过程):
① 该V L雨水中溶解SO2的体积(标准状况)为
计算过程:
② 生成沉淀物的质量范围为
您最近一年使用:0次
【推荐1】已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且只有I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。

回答下列问题:
(1)F的电子式:___________ ;
(2)写出反应①的化学反应方程式:___________ ;
(3)用惰性电极电解足量A溶液,一段时间后,若要使溶液恢复到电解前的状态,则可向溶液中加入适量___________ 或__________ 。
(4)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极电极反应方程式:__________ 。

回答下列问题:
(1)F的电子式:
(2)写出反应①的化学反应方程式:
(3)用惰性电极电解足量A溶液,一段时间后,若要使溶液恢复到电解前的状态,则可向溶液中加入适量
(4)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极电极反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氮及其化合物在工农业生产中有广泛的应用。请回答下列问题:
(1)氨气是一种重要的工业原料,工业上利用氮气和氢气在一定条件下合成氨气:N2(g)+3H2(g) 2NH3(g) ΔH,该反应过程中的能量变化如图1所示(E1>0,E2>0),图中E1代表的意义是
2NH3(g) ΔH,该反应过程中的能量变化如图1所示(E1>0,E2>0),图中E1代表的意义是___________ ,反应热ΔH的表达式为___________ (用E1,E2表示)

(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广的烟气氮氧化物脱除技术。反应原理如图A所示:

①图B是催化剂Mn和Cr在不同温度下对应的脱氧率,由图综合考虑可知最佳的催化剂和相应的温度分别为___________ 、___________
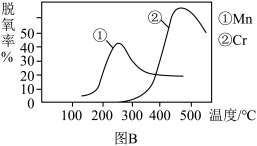
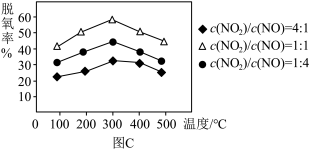
②用Fe做催化剂时,在氨气足量的情况下,不同 对应的脱氧率如图C所示,脱氧效果最佳的
对应的脱氧率如图C所示,脱氧效果最佳的
___________
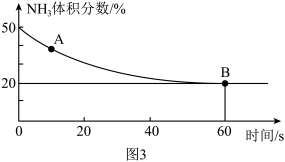
(3)工业上合成尿素的反应:2NH3(g)+CO2(g) H2O(g)+CO(NH2)2(l) ΔH,在一个真空恒容密闭容器中充入CO2和NH3发生上述反应,恒定温度下混合气体中NH3的体积分数如图3所示,则A点的正反应速率v正(CO2)
H2O(g)+CO(NH2)2(l) ΔH,在一个真空恒容密闭容器中充入CO2和NH3发生上述反应,恒定温度下混合气体中NH3的体积分数如图3所示,则A点的正反应速率v正(CO2)___________ B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”),CO2的平衡转化率为___________
(4)尿液也能发电。化学家正在研究尿素动力燃料电池,用这种电池直接除去城市废水中的尿素,既能产生净化的水又能发电,其工作原理为2CO(NH2)+3O2=2N2+2CO2+4H2O。电解质溶液为硫酸,则负极的电极反应式为___________ 。
(1)氨气是一种重要的工业原料,工业上利用氮气和氢气在一定条件下合成氨气:N2(g)+3H2(g)
 2NH3(g) ΔH,该反应过程中的能量变化如图1所示(E1>0,E2>0),图中E1代表的意义是
2NH3(g) ΔH,该反应过程中的能量变化如图1所示(E1>0,E2>0),图中E1代表的意义是
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广的烟气氮氧化物脱除技术。反应原理如图A所示:

①图B是催化剂Mn和Cr在不同温度下对应的脱氧率,由图综合考虑可知最佳的催化剂和相应的温度分别为

②用Fe做催化剂时,在氨气足量的情况下,不同
 对应的脱氧率如图C所示,脱氧效果最佳的
对应的脱氧率如图C所示,脱氧效果最佳的

(3)工业上合成尿素的反应:2NH3(g)+CO2(g)
 H2O(g)+CO(NH2)2(l) ΔH,在一个真空恒容密闭容器中充入CO2和NH3发生上述反应,恒定温度下混合气体中NH3的体积分数如图3所示,则A点的正反应速率v正(CO2)
H2O(g)+CO(NH2)2(l) ΔH,在一个真空恒容密闭容器中充入CO2和NH3发生上述反应,恒定温度下混合气体中NH3的体积分数如图3所示,则A点的正反应速率v正(CO2)
(4)尿液也能发电。化学家正在研究尿素动力燃料电池,用这种电池直接除去城市废水中的尿素,既能产生净化的水又能发电,其工作原理为2CO(NH2)+3O2=2N2+2CO2+4H2O。电解质溶液为硫酸,则负极的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】X、Y、Z、W均为含有10电子的微粒,W为离子,X、Y、Z为分子,且X与Z分子中含有的共用电子数之比为3:4。
(1)常温下,取10mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为__________________ ;下列叙述正确的是(填序号)_________ 。

①Y溶于水部分电离
②稀释后所有离子的浓度均减小
③Y的水溶液通常保存在玻璃瓶中
④稀释后,阴离子的物质的量浓度之和增大
(2)已知H2的燃烧热285.8kJ/mol。现有Z和H2的混合气体共0.2mol,与O2完全燃烧生成H2O(1)和CO2(g),转移电子的物质的量为1.0mol,放出的热量为117.6kJ。则Z完全燃烧的热化学反应方程式为:_________________________________________ Z和O2在KOH溶液中构成燃料电池的负极的电极反应式为:_______________________ 。
(1)常温下,取10mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为

①Y溶于水部分电离
②稀释后所有离子的浓度均减小
③Y的水溶液通常保存在玻璃瓶中
④稀释后,阴离子的物质的量浓度之和增大
(2)已知H2的燃烧热285.8kJ/mol。现有Z和H2的混合气体共0.2mol,与O2完全燃烧生成H2O(1)和CO2(g),转移电子的物质的量为1.0mol,放出的热量为117.6kJ。则Z完全燃烧的热化学反应方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】 是重要的化工原料,具有多种用途。回答下列问题:
是重要的化工原料,具有多种用途。回答下列问题:
(1) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
(2)将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(3)查阅资料知: 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
①已知 能发生如下反应:
能发生如下反应: 。上述反应中氧化剂是
。上述反应中氧化剂是___________ ,氧化产物是___________ ; 在反应中体现了
在反应中体现了___________ (填性质)。
②根据上述反应鉴别 和
和 。可选用的物质有
。可选用的物质有___________ (填字母)。
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
(4)某学习小组以过氧化钠为原料制备出了一定量的纯碱,不小心混入了少量的 ,现欲对其纯度进行测定,将10g样品加热至质量不再发生变化,其质量变为6.9g,则该纯碱样品的纯度(即质量分数)为
,现欲对其纯度进行测定,将10g样品加热至质量不再发生变化,其质量变为6.9g,则该纯碱样品的纯度(即质量分数)为___________ 。
 是重要的化工原料,具有多种用途。回答下列问题:
是重要的化工原料,具有多种用途。回答下列问题:(1)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式(2)将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(3)查阅资料知:
 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。①已知
 能发生如下反应:
能发生如下反应: 。上述反应中氧化剂是
。上述反应中氧化剂是 在反应中体现了
在反应中体现了②根据上述反应鉴别
 和
和 。可选用的物质有
。可选用的物质有A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
(4)某学习小组以过氧化钠为原料制备出了一定量的纯碱,不小心混入了少量的
 ,现欲对其纯度进行测定,将10g样品加热至质量不再发生变化,其质量变为6.9g,则该纯碱样品的纯度(即质量分数)为
,现欲对其纯度进行测定,将10g样品加热至质量不再发生变化,其质量变为6.9g,则该纯碱样品的纯度(即质量分数)为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】碘酸钙[Ca(IO3)2]是一种既能补碘又能补钙的新型饲料添加剂。某实验小组设计了如下实验制备Ca(IO3)2并测定其含量。
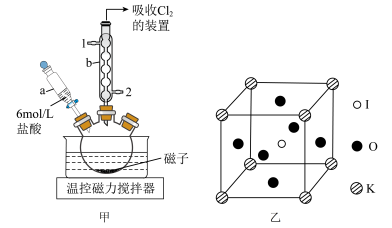
(一).Ca(IO3)2的制备。
步骤①:在图甲所示的装置中依次加入2.20gI2、2.00gKClO3和45mL水,搅拌,滴加约8滴6mol/L盐酸,
使pH=1,85°C左右水浴加热,直至反应完全。
步骤②:将反应后的液体转入烧杯中,滴加2mL30%KOH溶液,使pH=10。
步骤③:用滴管逐渐加入10mL1mol/LCaCl2溶液,并不断搅拌,有白色沉淀生成。
步骤④:在冰水中静置10分钟,抽滤,用少量冷水洗三次,再用少量无水乙醇洗一次,抽干后,将产品转移到滤纸上,晾干。
(1)仪器a的名称为_____ ,仪器b中冷凝水从_____ (填“1”或“2”)口进。
(2)“步骤①”中发生反应:2KClO3+I2+HCl=KIO3·HIO3+Cl2↑+KCl,其中I2和Cl2的熔点,较高的是_____ (填“Cl2”或“I2”)。
(3)“步骤②”中发生反应的化学方程式为_____ 。KIO3的立方晶胞如图乙所示,则KIO3晶体中与K紧邻的O个数为_____ 。
(4)“步骤④”中,在冰水中静置的目的是_____ ,便于过滤。
(二).产品中Ca(IO3)2的含量测定。
称取mg粗产品,配制成250mL溶液。每次移取50.00mL置于250mL碘量瓶中,高氯酸酸化后,加入过量KI,盖上瓶塞,在暗处放置3分钟,发生反应:IO +5I-+6H+=3I2+3H2O,加入淀粉溶液作为指示剂,然后用cmol/LNa2S2O3标准溶液滴定,发生反应:I2+2S2O
+5I-+6H+=3I2+3H2O,加入淀粉溶液作为指示剂,然后用cmol/LNa2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,三次滴定平均消耗VmLNa2S2O3标准溶液。
,三次滴定平均消耗VmLNa2S2O3标准溶液。
(5)滴定终点的现象为_____ 。
(6)设Ca(IO3)2的摩尔质量为Mg/mol,则Ca(IO3)2的纯度为_____ (用含c、m、M的式子表示)。

(一).Ca(IO3)2的制备。
步骤①:在图甲所示的装置中依次加入2.20gI2、2.00gKClO3和45mL水,搅拌,滴加约8滴6mol/L盐酸,
使pH=1,85°C左右水浴加热,直至反应完全。
步骤②:将反应后的液体转入烧杯中,滴加2mL30%KOH溶液,使pH=10。
步骤③:用滴管逐渐加入10mL1mol/LCaCl2溶液,并不断搅拌,有白色沉淀生成。
步骤④:在冰水中静置10分钟,抽滤,用少量冷水洗三次,再用少量无水乙醇洗一次,抽干后,将产品转移到滤纸上,晾干。
(1)仪器a的名称为
(2)“步骤①”中发生反应:2KClO3+I2+HCl=KIO3·HIO3+Cl2↑+KCl,其中I2和Cl2的熔点,较高的是
(3)“步骤②”中发生反应的化学方程式为
(4)“步骤④”中,在冰水中静置的目的是
(二).产品中Ca(IO3)2的含量测定。
称取mg粗产品,配制成250mL溶液。每次移取50.00mL置于250mL碘量瓶中,高氯酸酸化后,加入过量KI,盖上瓶塞,在暗处放置3分钟,发生反应:IO
 +5I-+6H+=3I2+3H2O,加入淀粉溶液作为指示剂,然后用cmol/LNa2S2O3标准溶液滴定,发生反应:I2+2S2O
+5I-+6H+=3I2+3H2O,加入淀粉溶液作为指示剂,然后用cmol/LNa2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,三次滴定平均消耗VmLNa2S2O3标准溶液。
,三次滴定平均消耗VmLNa2S2O3标准溶液。(5)滴定终点的现象为
(6)设Ca(IO3)2的摩尔质量为Mg/mol,则Ca(IO3)2的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,是无色单斜晶体。 它易溶于水,不溶于乙醇,具有较强的还原性, 可应用于照相等工业中。回答下列问题:
(1)Na2S2O3·5H2O 属于________ (填“纯净物”或“混合物”)。
(2)酸性条件下, S2O32-自身发生氧化还原反应生成 SO2。试写出 Na2S2O3 与盐酸反应的离子方程式:_________________________________________ 。
(3)亚硫酸钠法制备Na2S2O3·5H2O简易流程如下:

①Na2S2O3·5H2O制备原理为_________________________________________ (用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2S2O3、 Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量______________ (填试剂名称),若___________________________ (填现象),则证明产品中含有 Na2SO3和 Na2SO4(已知: Na2S2O3稀溶液与BaCl2溶液无沉淀生成)。
③粗品中Na2S2O3·5H2O的质量分数的测定称取 6 g 粗品配制 250 mL 的溶液待用。另取 25.00 mL 0.0100 mol· L-1 K2Cr2O7溶液于锥形瓶中,然后加入过量酸化的 KI 溶液并酸化和几滴淀粉溶液,立即用配制的 Na2S2O3溶液滴定至终点,消耗 Na2S2O3溶液 25.00 mL。 滴定终点的现象是________ 。粗品中Na2S2O3·5H2O的质量分数为__________ 。已知 Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O、 I2+2S2O32- =2I-+S4O62-。
(1)Na2S2O3·5H2O 属于
(2)酸性条件下, S2O32-自身发生氧化还原反应生成 SO2。试写出 Na2S2O3 与盐酸反应的离子方程式:
(3)亚硫酸钠法制备Na2S2O3·5H2O简易流程如下:

①Na2S2O3·5H2O制备原理为
②Na2S2O3·5H2O粗品中可能含有Na2S2O3、 Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量
③粗品中Na2S2O3·5H2O的质量分数的测定称取 6 g 粗品配制 250 mL 的溶液待用。另取 25.00 mL 0.0100 mol· L-1 K2Cr2O7溶液于锥形瓶中,然后加入过量酸化的 KI 溶液并酸化和几滴淀粉溶液,立即用配制的 Na2S2O3溶液滴定至终点,消耗 Na2S2O3溶液 25.00 mL。 滴定终点的现象是
您最近一年使用:0次



