1 . 水热法制备 纳米颗粒的反应如下(反应条件忽略):
纳米颗粒的反应如下(反应条件忽略):
 。下列说法错误的是
。下列说法错误的是
 纳米颗粒的反应如下(反应条件忽略):
纳米颗粒的反应如下(反应条件忽略):
 。下列说法错误的是
。下列说法错误的是A.该反应中 作氧化剂 作氧化剂 | B.该反应中 和 和 都是还原剂 都是还原剂 |
C.3个 参加反应时有1个 参加反应时有1个 被氧化 被氧化 | D.离子方程式中 |
您最近一年使用:0次
名校
2 . 高铁酸钾 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:

回答下列问题:
(1)配制 溶液。
溶液。
①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和_______ ,需要用托盘天平称量 固体
固体_______ g。
②下列操作可能导致上述 溶液浓度偏大的是
溶液浓度偏大的是_______ (填字母)。
A.摇匀后发现液面低于刻度线,再加水至刻度线
B. 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤
C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为_______ (从物质性质角度)。
(2)“氧化”过程中溶液保持强碱性,写出 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:_______ 。
(3)“除杂”后滤液的主要成分为 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是_______ 。
(4) 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是_______ 。
 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
回答下列问题:
(1)配制
 溶液。
溶液。①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和
 固体
固体②下列操作可能导致上述
 溶液浓度偏大的是
溶液浓度偏大的是A.摇匀后发现液面低于刻度线,再加水至刻度线
B.
 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的
 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为(2)“氧化”过程中溶液保持强碱性,写出
 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:(3)“除杂”后滤液的主要成分为
 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是(4)
 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是
您最近一年使用:0次
2024-03-02更新
|
64次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
名校
解题方法
3 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
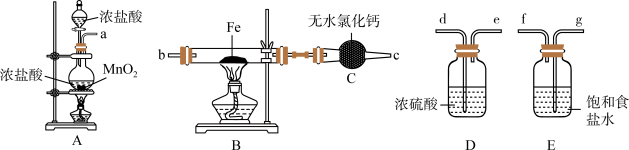
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
79次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
解题方法
4 . 氯化碘(ICl)是红棕色液体,易挥发,熔点为 ,沸点为
,沸点为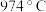 ,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
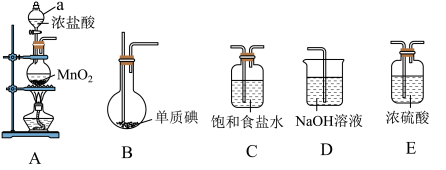
(1)a仪器名称___________ 。
(2)上述装置,按气流方向连接的顺序为___________ (装置可重复使用)。
(3)A装置中发生反应的化学方程式为___________ 。
(4)氟化氯与氯化碘都是卤素互化物,它可用于制备硝酸氯,原理为: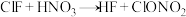 ,下列判断中正确的是___________。
,下列判断中正确的是___________。
(5)高铁酸钾 与
与 都是高效消毒剂,实验室可将氯气通入过量
都是高效消毒剂,实验室可将氯气通入过量 与
与 的混合溶液来制备
的混合溶液来制备 。向
。向 滴加盐酸可以生成氯气,说明氧化性:
滴加盐酸可以生成氯气,说明氧化性:
___________  (填“>”或“<”),而
(填“>”或“<”),而 的制备实验表明
的制备实验表明 和
和 的氧化性强弱关系相反,其原因是
的氧化性强弱关系相反,其原因是___________ 。
 ,沸点为
,沸点为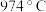 ,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
(1)a仪器名称
(2)上述装置,按气流方向连接的顺序为
(3)A装置中发生反应的化学方程式为
(4)氟化氯与氯化碘都是卤素互化物,它可用于制备硝酸氯,原理为:
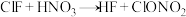 ,下列判断中正确的是___________。
,下列判断中正确的是___________。A. 和 和 熔融状态均能导电 熔融状态均能导电 |
B. 与 与 反应时,氯元素被还原 反应时,氯元素被还原 |
C.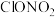 与水反应生成盐酸和硝酸 与水反应生成盐酸和硝酸 |
D. 化学性质与卤素单质相似,可以与锌反应 化学性质与卤素单质相似,可以与锌反应 |
(5)高铁酸钾
 与
与 都是高效消毒剂,实验室可将氯气通入过量
都是高效消毒剂,实验室可将氯气通入过量 与
与 的混合溶液来制备
的混合溶液来制备 。向
。向 滴加盐酸可以生成氯气,说明氧化性:
滴加盐酸可以生成氯气,说明氧化性:
 (填“>”或“<”),而
(填“>”或“<”),而 的制备实验表明
的制备实验表明 和
和 的氧化性强弱关系相反,其原因是
的氧化性强弱关系相反,其原因是
您最近一年使用:0次
解题方法
5 . 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。已知:铜与稀硝酸反应,金和稀硝酸不反应。回答下列问题:
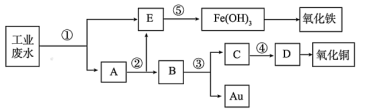
(1)图中标号处需加入的相应物质分别是①___________ 、②___________ (均写物质名称)。
(2)③处加入的物质为稀硝酸,化学反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,请用单线桥标明电子转移方向及数目___________ 。
(3)在浓度相等的条件下,Fe3+、Cu2+、Au3+氧化性由强到弱的顺序为___________ 。
(4)⑤处的总离子方程式为: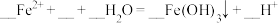 ,请补全缺项并配平
,请补全缺项并配平___________ ;该反应的现象为___________ 。

(1)图中标号处需加入的相应物质分别是①
(2)③处加入的物质为稀硝酸,化学反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,请用单线桥标明电子转移方向及数目
(3)在浓度相等的条件下,Fe3+、Cu2+、Au3+氧化性由强到弱的顺序为
(4)⑤处的总离子方程式为:
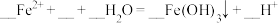 ,请补全缺项并配平
,请补全缺项并配平
您最近一年使用:0次
名校
解题方法
6 .  (五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
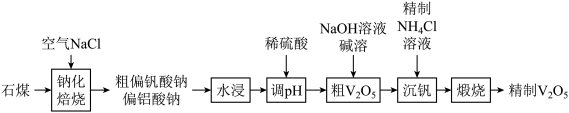
已知:① (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
②
 沉淀生成和溶解的
沉淀生成和溶解的 如表所示:
如表所示:
回答下列问题:
(1)V在元素周期表中的位置:___________ 。
(2)“钠化焙烧”过程中 转化为可溶性
转化为可溶性 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为___________ 。
(3)粗 中含有
中含有 ,可通过
,可通过 溶液碱溶除去,需调节
溶液碱溶除去,需调节 的范围为
的范围为___________ 。
(4)已知:室温下,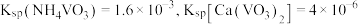 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的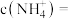
___________ 。
(5)产品纯度测定:将 产品溶于足量稀硫酸配成
产品溶于足量稀硫酸配成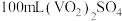 溶液。取
溶液。取 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用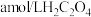 标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为
标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为 。已知:
。已知: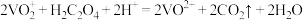 ,则该产品中
,则该产品中 的质量分数是
的质量分数是___________ %。
(6)钒的一种配合物的结构简式为 ,该配合物分子中含有的化学键类型有___________(填字母)。
,该配合物分子中含有的化学键类型有___________(填字母)。
 (五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:①
 (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。②

 沉淀生成和溶解的
沉淀生成和溶解的 如表所示:
如表所示:溶液 | ||||
| 物质 | 开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 |
 | 2.2 | 5.1 | 7.1 | 8.1 |
 | 3.3 | 4.7 | 8.7 | 12.8 |
(1)V在元素周期表中的位置:
(2)“钠化焙烧”过程中
 转化为可溶性
转化为可溶性 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为(3)粗
 中含有
中含有 ,可通过
,可通过 溶液碱溶除去,需调节
溶液碱溶除去,需调节 的范围为
的范围为(4)已知:室温下,
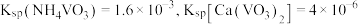 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的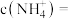
(5)产品纯度测定:将
 产品溶于足量稀硫酸配成
产品溶于足量稀硫酸配成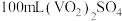 溶液。取
溶液。取 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用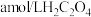 标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为
标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为 。已知:
。已知: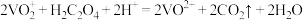 ,则该产品中
,则该产品中 的质量分数是
的质量分数是(6)钒的一种配合物的结构简式为
 ,该配合物分子中含有的化学键类型有___________(填字母)。
,该配合物分子中含有的化学键类型有___________(填字母)。| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
您最近一年使用:0次
2024-01-28更新
|
471次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
名校
解题方法
7 . 从干海带中提取碘的实验流程如下:
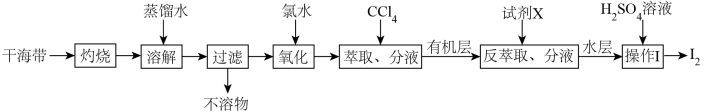
| A.氧化步骤中氯水可用过氧化氢代替 |
B.试剂X可以为 ,反萃取的离子方程式为: ,反萃取的离子方程式为: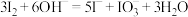 |
C. 可循环利用以有效提高干海带提碘的产率 可循环利用以有效提高干海带提碘的产率 |
| D.操作Ⅰ要用到普通漏斗、烧杯和玻璃棒 |
您最近一年使用:0次
2024-01-28更新
|
568次组卷
|
4卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
8 . 从酸性含铬废水(主要阴离子为 )中回收铬元素(
)中回收铬元素( )的部分工艺流程如图所示。
)的部分工艺流程如图所示。
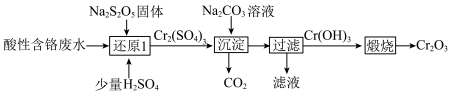
下列有关说法正确的是
 )中回收铬元素(
)中回收铬元素( )的部分工艺流程如图所示。
)的部分工艺流程如图所示。
下列有关说法正确的是
| A.“过滤”时需用玻璃棒搅拌 |
| B.“煅烧”过程中发生了氧化还原反应 |
C.若分别用 、 、 还原等量的 还原等量的 ,消耗 ,消耗 与 与 的物质的量之比为1∶3 的物质的量之比为1∶3 |
D.“还原1”时反应的离子方程式为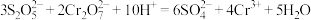 |
您最近一年使用:0次
2024-01-08更新
|
261次组卷
|
6卷引用:辽宁省朝阳市建平县第二高级中学2023-2024学年高一上学期1月期末化学试题
解题方法
9 . 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知K2FeO4在Fe3+催化下会分解,在强碱性条件下稳定。高铁酸钾(K2FeO4)生产流程如图:
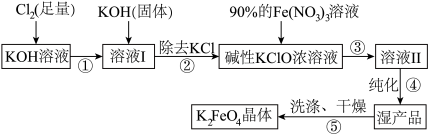
(1)在溶液Ⅰ中加入KOH固体的目的是 。
(2)写出③反应的离子方程式_______ 。
(3)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_______ 。
(4)K2FeO4在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为_______ (写出化学式)。
(5)K2FeO4净水时能吸附悬浮物的原因是_______ 。

(1)在溶液Ⅰ中加入KOH固体的目的是 。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高KClO产率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(2)写出③反应的离子方程式
(3)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是
(4)K2FeO4在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为
(5)K2FeO4净水时能吸附悬浮物的原因是
您最近一年使用:0次
10 . 高铁酸钾(K2FeO4)是一种既能杀菌 消毒、又能絮凝净水的水处理剂,工业制备高铁酸钾的离子方程式为Fe(OH)3+ClO-+OH-
 +Cl-+H2O (未配平)。下列有关说法不正确的是
+Cl-+H2O (未配平)。下列有关说法不正确的是

 +Cl-+H2O (未配平)。下列有关说法不正确的是
+Cl-+H2O (未配平)。下列有关说法不正确的是A.由上述反应可知,FeO 的氧化性强于ClO- 的氧化性强于ClO- |
| B.生成0.4molCl-时转移电子数0.8NA |
| C.上述反应中氧化剂和还原剂的物质的量之比为3∶2 |
D.K2FeO4处理水的原理可为:  |
您最近一年使用:0次
2023-11-17更新
|
306次组卷
|
3卷引用:辽宁省沈阳市重点高中五校协作体2023-2024学年高一上学期1月期末化学试题



