解题方法
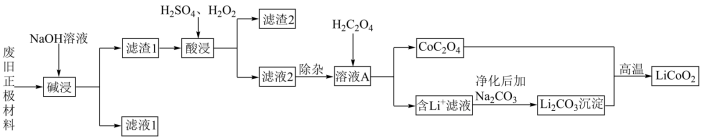
1 . 废旧锂离子电池材料的回收再生意义重大。一种回收废旧锂离子电池正极材料[含有钴酸锂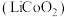 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸 的电离常数
的电离常数 ,
,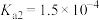 ;
;
②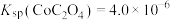 。
。
请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为_______ 。
(2)为提高“碱浸”效率可采取的措施有_______ (任写一条)。
(3)“滤渣2”的主要成分为_______ 。
(4)“酸浸”中发生反应的离子方程式为_______ 。
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是_______ 。
(6)常温下,溶液A中加入 产生
产生 沉淀:
沉淀: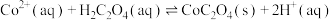 ,该反应的化学平衡常数
,该反应的化学平衡常数
_______ 。
(7)在空气中, 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为_______ 。
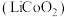 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸
 的电离常数
的电离常数 ,
,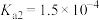 ;
;②
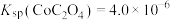 。
。请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为
(2)为提高“碱浸”效率可采取的措施有
(3)“滤渣2”的主要成分为
(4)“酸浸”中发生反应的离子方程式为
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是
| 反应温度/℃ | 60 | 70 | 80 | 90 |
| 钴的浸出率/% | 88 | 90.5 | 93 | 89 |
(6)常温下,溶液A中加入
 产生
产生 沉淀:
沉淀: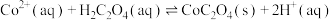 ,该反应的化学平衡常数
,该反应的化学平衡常数
(7)在空气中,
 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为
您最近一年使用:0次
解题方法
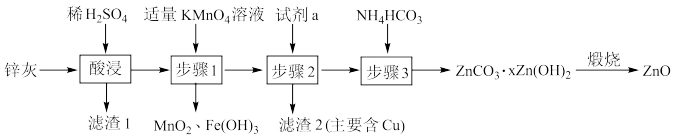
2 . 利用锌灰(主要成分为ZnO,含有CuO、PbO、 、FeO、
、FeO、 等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
 、FeO、
、FeO、 等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
A.为了提高酸浸效率,可采取适当升高温度、适当增大 溶液的浓度等措施 溶液的浓度等措施 |
B.滤渣1的主要成分为 、 、 |
C.步骤1中发生反应的离子方程式为: |
D.试剂a为ZnO或 |
您最近一年使用:0次
3 . 某同学做实验时白色衣服上沾了一些KMnO4,产生褐色斑点,如果用草酸(H2C2O4)的稀溶液洗涤马上可以复原,其离子方程式为: +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
 +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是| A.该反应的氧化产物是Mn2+ |
| B.离子方程式横线上的生成物是OH- |
| C.配平离子方程式,H+的计量数是6 |
| D.标准状况下,有5.6 LCO2生成时,转移电子的物质的量为0.5 mol |
您最近一年使用:0次
名校
解题方法
4 . 生活离不开化学.家庭厨卫中有许多中学化学常见的物质,括号内为厨卫商品的主要成分。
①食盐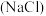 ②料酒(乙醇) ③食醋(乙酸) ④碱面
②料酒(乙醇) ③食醋(乙酸) ④碱面
⑤发酵粉( 和明矾) ⑥84消毒液
和明矾) ⑥84消毒液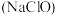 ⑦洁厕灵
⑦洁厕灵
回答下列问题:
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是______________ 。
(2)②③的主要成分可以归为一类物质,其分类的依据是______________(填正确答案标号)。
(3)明矾可做净水剂的理由是(用离子方程式表示)_________________ 。
(4)除去 固体中混有的少量
固体中混有的少量 杂质,应采取的最佳方法是
杂质,应采取的最佳方法是______________ 。
(5)相同条件下,等质量的 与
与 分别与足量的盐酸反应产生气体的体积比为
分别与足量的盐酸反应产生气体的体积比为____________ 。
(6)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由:__________________ 。
①食盐
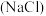 ②料酒(乙醇) ③食醋(乙酸) ④碱面
②料酒(乙醇) ③食醋(乙酸) ④碱面
⑤发酵粉(
 和明矾) ⑥84消毒液
和明矾) ⑥84消毒液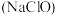 ⑦洁厕灵
⑦洁厕灵
回答下列问题:
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是
(2)②③的主要成分可以归为一类物质,其分类的依据是______________(填正确答案标号)。
| A.两种物质都是非电解质 | B.两种物质都是电解质 |
| C.两种物质都是含碳化合物 | D.两种物质都是氧化物 |
(4)除去
 固体中混有的少量
固体中混有的少量 杂质,应采取的最佳方法是
杂质,应采取的最佳方法是(5)相同条件下,等质量的
 与
与 分别与足量的盐酸反应产生气体的体积比为
分别与足量的盐酸反应产生气体的体积比为(6)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由:
您最近一年使用:0次
2023-02-19更新
|
102次组卷
|
2卷引用:辽宁省葫芦岛市普通高中2022-2023学年高一上学期学业质量监测(期末)考试化学试题
解题方法
5 . 纳米 是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含
是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含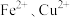 )为原料制备,实现变废为宝,路线如下:
)为原料制备,实现变废为宝,路线如下:
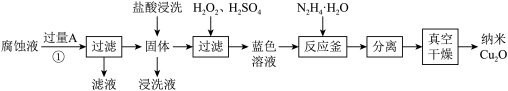
已知:a.当温度为60℃时,过氧化氢分解率为50%左右;
b. 中的
中的 元素为
元素为 价。
价。
请回答下列问题
(1)流程中的 为
为_______ (填化学式),①发生的反应的离子方程式为_______ ;
(2)“氧化”步骤为了加快反应速率可以适当升温,但不宜加热温度过高,原因是_______ ;
(3)为验证“反应釜”中反应已发生,可采用的实验操作是_______ ,从反应体系中分离出分散质_______ (填“能”或“不能”)选择过滤操作,理由是_______ ;
(4)发生反应时,“反应釜”中获得一种气体为空气主要成分,写出其中发生反应的离子方程式,并用单线桥法表示电子转移情况_______ ;
 是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含
是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含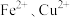 )为原料制备,实现变废为宝,路线如下:
)为原料制备,实现变废为宝,路线如下:
已知:a.当温度为60℃时,过氧化氢分解率为50%左右;
b.
 中的
中的 元素为
元素为 价。
价。请回答下列问题
(1)流程中的
 为
为(2)“氧化”步骤为了加快反应速率可以适当升温,但不宜加热温度过高,原因是
(3)为验证“反应釜”中反应已发生,可采用的实验操作是
(4)发生反应时,“反应釜”中获得一种气体为空气主要成分,写出其中发生反应的离子方程式,并用单线桥法表示电子转移情况
您最近一年使用:0次
名校
解题方法
6 . 二氧化氯( )是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法
)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法 发生器进行消毒的水中含有中等毒性的
发生器进行消毒的水中含有中等毒性的 ,进一步研究表明
,进一步研究表明 是由于
是由于 制备过程中未完全反应的
制备过程中未完全反应的 原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。
原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。
实验原理: 溶液(质量分数
溶液(质量分数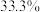 )与盐酸溶液(
)与盐酸溶液( 质量分数
质量分数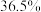 )经计量泵按
)经计量泵按 比例进入发生器连续进行反应,并在水射器的抽吸作用下,将
比例进入发生器连续进行反应,并在水射器的抽吸作用下,将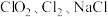 等产物和含有
等产物和含有 与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
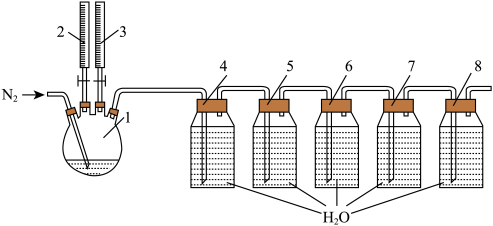
实验步骤:
i.将 溶液与盐酸溶液按
溶液与盐酸溶液按 比例加入烧瓶1中,产生黄绿色气体后通入高纯
比例加入烧瓶1中,产生黄绿色气体后通入高纯 ;
;
ⅱ.反应90分钟,将5个广口瓶内的液体和烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液;
iii.分别在反应温度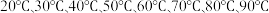 重复上述过程;
重复上述过程;
iv.测试复合二氧化氯消毒液中各组分浓度,收集整理数据。
(1)用来滴加反应液的仪器名称:_______ ;为确保实验准确性,控制反应温度,发生装置选择的加热方式:_______ 。
(2)烧瓶1中反应的化学方程式:_______ 。
(3)若已知所用盐酸的密度是 。则盐酸的浓度是:
。则盐酸的浓度是:_______ 。
(4)通入高纯 的作用:
的作用:_______ 。
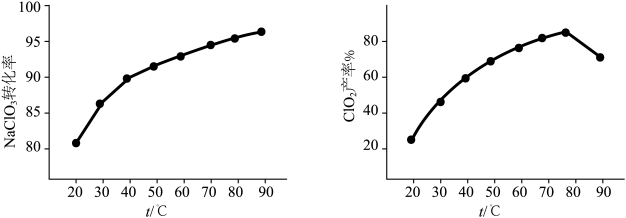
(5) 转化率及
转化率及 产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量
产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量_______ (填“升高”或“降低”):改变反应时间,重复实验, 产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析
产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析 时
时 产率降低的可能原因
产率降低的可能原因_______ 。
(6)二氧化氯可氧化 等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是
等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是_______ 。
a.含二氧化氯漱口水去除口腔异味 b.酒精消毒 c.明矾净水
 )是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法
)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法 发生器进行消毒的水中含有中等毒性的
发生器进行消毒的水中含有中等毒性的 ,进一步研究表明
,进一步研究表明 是由于
是由于 制备过程中未完全反应的
制备过程中未完全反应的 原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。
原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。实验原理:
 溶液(质量分数
溶液(质量分数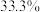 )与盐酸溶液(
)与盐酸溶液( 质量分数
质量分数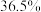 )经计量泵按
)经计量泵按 比例进入发生器连续进行反应,并在水射器的抽吸作用下,将
比例进入发生器连续进行反应,并在水射器的抽吸作用下,将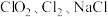 等产物和含有
等产物和含有 与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
实验步骤:
i.将
 溶液与盐酸溶液按
溶液与盐酸溶液按 比例加入烧瓶1中,产生黄绿色气体后通入高纯
比例加入烧瓶1中,产生黄绿色气体后通入高纯 ;
;ⅱ.反应90分钟,将5个广口瓶内的液体和烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液;
iii.分别在反应温度
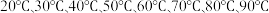 重复上述过程;
重复上述过程;iv.测试复合二氧化氯消毒液中各组分浓度,收集整理数据。
(1)用来滴加反应液的仪器名称:
(2)烧瓶1中反应的化学方程式:
(3)若已知所用盐酸的密度是
 。则盐酸的浓度是:
。则盐酸的浓度是:(4)通入高纯
 的作用:
的作用:(5)
 转化率及
转化率及 产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量
产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量 产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析
产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析 时
时 产率降低的可能原因
产率降低的可能原因
(6)二氧化氯可氧化
 等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是
等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是a.含二氧化氯漱口水去除口腔异味 b.酒精消毒 c.明矾净水
您最近一年使用:0次
名校
7 . 铁及其化合物在生产和生活中起到重要的作用。请回答下列问题:
(1)人体对 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起_______ 剂。
(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为_______ 。
(3)实验室中储存 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的_______ 。
(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量 )制备
)制备 。操作过程如下:
。操作过程如下:
i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。
①步骤ii中加入过量氧化剂 的目的是
的目的是_______ 。离子方程式为_______ 。
②设计实验验证操作i所得溶液中不含 ,简述实验操作及现象:
,简述实验操作及现象:_______ 。
③该小组同学认为即使操作i所得溶液中不含 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为_______ 。
(5)羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
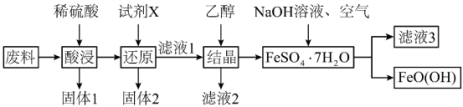
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
①“固体1”的主要成分是_______ 。
②“酸浸”时CuO与硫酸发生反应的离子方程式为_______ 。“试剂X”宜选择的是_______ 。
A.双氧水 B.铜粉 C.铁粉 D.钠块
(1)人体对
 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为
(3)实验室中储存
 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量
 )制备
)制备 。操作过程如下:
。操作过程如下:i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂
 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。①步骤ii中加入过量氧化剂
 的目的是
的目的是②设计实验验证操作i所得溶液中不含
 ,简述实验操作及现象:
,简述实验操作及现象:③该小组同学认为即使操作i所得溶液中不含
 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为(5)羟基氧化铁
 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。①“固体1”的主要成分是
②“酸浸”时CuO与硫酸发生反应的离子方程式为
A.双氧水 B.铜粉 C.铁粉 D.钠块
您最近一年使用:0次
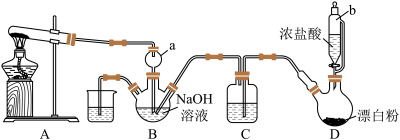
8 . 肼(N2H4),又称联氨,为无色油状液体,能很好地混溶于水中,与卤素、过氧化氢等强氧化剂作用能自燃,长期暴露在空气中或短时间受高温作用会爆炸分解,具有强烈的吸水性。实验室设计如图装置用氨和次氯酸钠反应制备肼,并探究肼的性质。
已知:硫酸肼(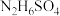 )为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
)为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
回答下列问题:
(1)仪器a的作用是_______ 。
(2)装置A的试管中盛放的试剂为_______ (填化学式)。
(3)装置C中盛放的试剂为_______ (填名称),其作用是_______ 。
(4)装置D中发生反应的化学方程式为_______ 。
(5)①探究性质。取装置B中溶液于试管中,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子方程式:_______ 。
②测定产品中肼的质量分数。称取 g装置B中溶液,加入适量
g装置B中溶液,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成100
保持在6.5左右),加水配成100 溶液,移取25.00
溶液,移取25.00 置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c
置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c 的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为
的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为_______ ,滴定终点平均消耗标准溶液V ,产品中肼的质量分数的表达式为
,产品中肼的质量分数的表达式为_______ 。

已知:硫酸肼(
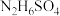 )为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
)为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。回答下列问题:
(1)仪器a的作用是
(2)装置A的试管中盛放的试剂为
(3)装置C中盛放的试剂为
(4)装置D中发生反应的化学方程式为
(5)①探究性质。取装置B中溶液于试管中,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子方程式:
②测定产品中肼的质量分数。称取
 g装置B中溶液,加入适量
g装置B中溶液,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成100
保持在6.5左右),加水配成100 溶液,移取25.00
溶液,移取25.00 置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c
置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c 的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为
的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为 ,产品中肼的质量分数的表达式为
,产品中肼的质量分数的表达式为
您最近一年使用:0次
名校
9 . 高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定,是一种新型多功能水处理剂。其生产工艺如图1所示:
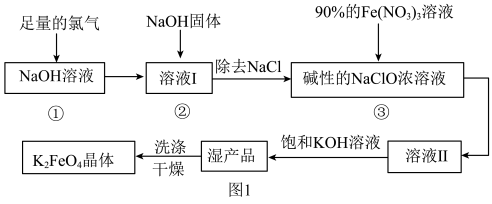
回答下列问题:
(1)Fe(NO3)3中 的空间结构名称为
的空间结构名称为_______ 氮原子的杂化轨道类型为_______
(2)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,取某温度下反应液,测得ClO-与 的物质的量浓度之比是2∶1,则Cl2与氢氧化钠溶液反应时,被氧化的氯原子与被还原的氯原子的物质的量之比为
的物质的量浓度之比是2∶1,则Cl2与氢氧化钠溶液反应时,被氧化的氯原子与被还原的氯原子的物质的量之比为_______ 。
(3)反应③的离子方程式为_______ ,制备时,两溶液混合的操作为_______ 。
(4)往溶液II中加入饱和KOH溶液得到湿产品的原因是_______ 。该工艺流程中可循环使用的物质是_______ (填化学式)。
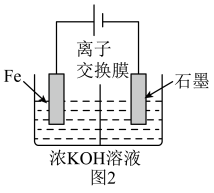
(5)高铁酸钾还可以通过电解法制备,其原理如图2所示:阳极的电极反应式为_______ 。

回答下列问题:
(1)Fe(NO3)3中
 的空间结构名称为
的空间结构名称为(2)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,取某温度下反应液,测得ClO-与
 的物质的量浓度之比是2∶1,则Cl2与氢氧化钠溶液反应时,被氧化的氯原子与被还原的氯原子的物质的量之比为
的物质的量浓度之比是2∶1,则Cl2与氢氧化钠溶液反应时,被氧化的氯原子与被还原的氯原子的物质的量之比为(3)反应③的离子方程式为
(4)往溶液II中加入饱和KOH溶液得到湿产品的原因是
(5)高铁酸钾还可以通过电解法制备,其原理如图2所示:阳极的电极反应式为

您最近一年使用:0次
2023-01-18更新
|
269次组卷
|
3卷引用:辽宁省辽河油田第二高级中学2022-2023学年高三上学期期末考试化学试题
辽宁省辽河油田第二高级中学2022-2023学年高三上学期期末考试化学试题(已下线)北京市海淀区2022届高三一模(工业流程题)湖南省常德市汉寿县第一中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
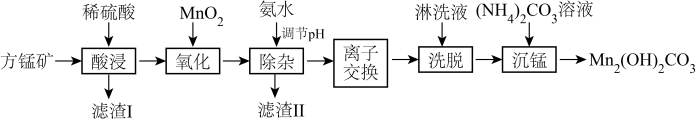
10 . 碱式碳酸锰[Mn2(OH)2CO3]是一种不溶于水的固体,是制造其他含锰化合物的原料。工业上以方锰矿(主要成分为MnO,还含有少量的Fe3O4、Al2O3、CaO、SiO2)为原料制备碱式碳酸锰。
25℃时,相关物质的Ksp如表:
回答下列问题:
(1)“酸浸”时,滤渣I的成分是_____ (填化学式)。
(2)“氧化”时,该反应的离子方程式为_____ 。
(3)“除杂”时,使用氨水的目的是将Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥_____ ;若Al3+沉淀完全时,则溶液中Fe3+的物质的量浓度为_____ mol•L-1通常认为溶液中的离子浓度≤1×10-5mol•L-1沉淀完全)。
(4)“离子交换”和“洗脱”时,发生反应:Mn2++2HR MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为_____ (填“硫酸”、“氢氧化钠溶液”或“蒸馏水)。
(5)沉锰时,反应的离子方程式为_____ ,过滤、洗涤、干燥,得到Mn2(OH)2CO3,检验沉淀是否洗涤干净的操作是_____ 。

25℃时,相关物质的Ksp如表:
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| Ksp | 2×10-13 | 5×10-17 | 3×10-39 | 1×10-32 | 6×10-6 |
(1)“酸浸”时,滤渣I的成分是
(2)“氧化”时,该反应的离子方程式为
(3)“除杂”时,使用氨水的目的是将Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥
(4)“离子交换”和“洗脱”时,发生反应:Mn2++2HR
 MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为(5)沉锰时,反应的离子方程式为
您最近一年使用:0次



