解题方法
1 . 钛白粉学名二氧化钛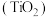 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
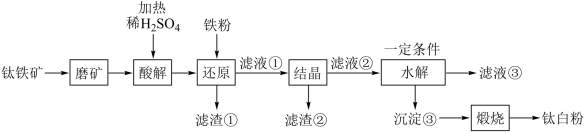
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。
② 不溶于水和稀酸。
不溶于水和稀酸。
(1)写出基态 原子的价层电子排布式
原子的价层电子排布式___________ 。
(2)磨矿的目的是___________ 。
(3)滤渣①的主要成分是___________ 。
(4)酸解过程中,写出 发生反应的化学方程式
发生反应的化学方程式___________ 。
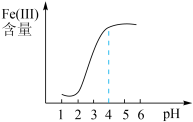
(5)还原过程中,加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:___________ 。
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为___________ 。
②一定量 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理___________ 。
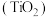 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以
 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。②
 不溶于水和稀酸。
不溶于水和稀酸。(1)写出基态
 原子的价层电子排布式
原子的价层电子排布式(2)磨矿的目的是
(3)滤渣①的主要成分是
(4)酸解过程中,写出
 发生反应的化学方程式
发生反应的化学方程式(5)还原过程中,加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为
②一定量
 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
您最近一年使用:0次
解题方法
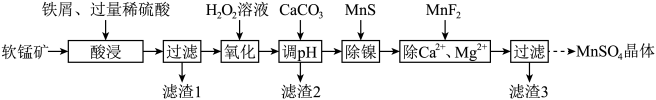
2 . 利用软锰矿(主要成分是 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下, ,
, ,
, ,
, 。
。
回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是_______ ;“酸浸”后溶液中检测到 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为________ ;“滤渣1”的主要成分为________ (填化学式)。
(2)“氧化”时发生反应的离子方程式为___________ ,“调pH”的目的是___________ 。
(3)“除镍”时,使用MnS作为沉淀剂的原因是___________ 。
(4)加入 使
使 、
、 的浓度均不高于
的浓度均不高于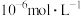 ,此时溶液中
,此时溶液中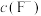 至少为
至少为_______  。
。
(5)硫酸锰的溶解度随温度变化关系如图所示,从“除 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是________ 。

 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下,
 ,
, ,
, ,
, 。
。回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是
 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为(2)“氧化”时发生反应的离子方程式为
(3)“除镍”时,使用MnS作为沉淀剂的原因是
(4)加入
 使
使 、
、 的浓度均不高于
的浓度均不高于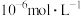 ,此时溶液中
,此时溶液中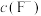 至少为
至少为 。
。(5)硫酸锰的溶解度随温度变化关系如图所示,从“除
 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是
您最近一年使用:0次
名校
解题方法
3 . 铈(Ce)是一种典型的稀土元素,属于国家战略资源。以某废料(主要含 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈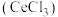 ,主要步骤如下:
,主要步骤如下:
(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
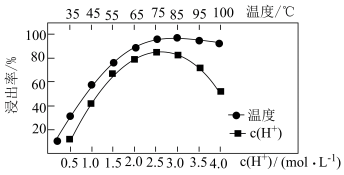
不溶于水,写出其发生反应的离子方程式:________ 。Ce的浸出率与 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为________ 。
(2)除杂:向浸出液中加入NaOH溶液调节pH除去 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度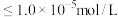 )。
)。
则 的
的
________ ,若浸取液中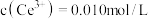 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是________ (加入NaOH溶液过程忽略体积变化)。
(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应: (水层)+3HT(有机层)
(水层)+3HT(有机层)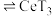 (有机层)
(有机层)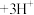 (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入_______ 能获得较纯的 溶液。
溶液。
结晶析出:将 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到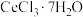 晶体。
晶体。
(4)加热脱水:将 固体和
固体和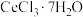 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是________ 。
(5)对 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵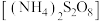 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用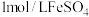 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为________ %(保留小数点后两位)。
 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈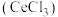 ,主要步骤如下:
,主要步骤如下:(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有
 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
不溶于水,写出其发生反应的离子方程式: 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为
(2)除杂:向浸出液中加入NaOH溶液调节pH除去
 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度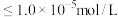 )。
)。沉淀 |
|
|
|
|
恰好完全沉淀时pH | 5.2 | 2.8 | 9.0 | 10.1 |
 的
的
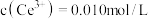 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应:
 (水层)+3HT(有机层)
(水层)+3HT(有机层)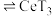 (有机层)
(有机层)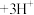 (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入 溶液。
溶液。结晶析出:将
 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到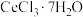 晶体。
晶体。(4)加热脱水:将
 固体和
固体和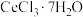 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是(5)对
 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵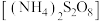 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用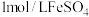 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为
您最近一年使用:0次
2023-08-08更新
|
432次组卷
|
2卷引用:辽宁省丹东市等2地大石桥市第三高级中学等2校2022-2023学年高三上学期1月期末考试化学试题
名校
解题方法
4 . 硫代硫酸钠( )常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
)常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
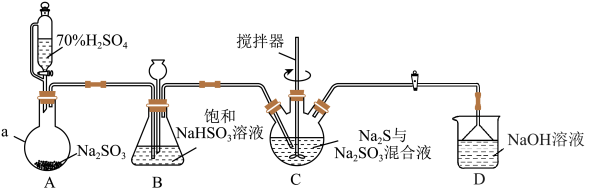
回答下列问题:
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若__________ ,则整个装置气密性良好。
(2)仪器C的名称是__________ ;装置D的作用是__________ 。
(3)装置A中发生反应的化学方程式为__________ 。
(4)装置C中的反应分两步:第一步通入 后溶液中
后溶液中 浓度明显增大,则第一步反应的离子方程式为
浓度明显增大,则第一步反应的离子方程式为__________ ;第二步反应为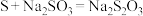 ,已知第二步反应相对较慢,则装置C中反应达到终点的现象是
,已知第二步反应相对较慢,则装置C中反应达到终点的现象是__________ 。
(5)将制得的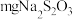 样品溶于水,加入
样品溶于水,加入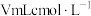 碘水溶液时,二者恰好完全反应(
碘水溶液时,二者恰好完全反应( ),则样品的纯度为
),则样品的纯度为__________ 。
 )常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
)常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
回答下列问题:
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若
(2)仪器C的名称是
(3)装置A中发生反应的化学方程式为
(4)装置C中的反应分两步:第一步通入
 后溶液中
后溶液中 浓度明显增大,则第一步反应的离子方程式为
浓度明显增大,则第一步反应的离子方程式为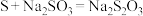 ,已知第二步反应相对较慢,则装置C中反应达到终点的现象是
,已知第二步反应相对较慢,则装置C中反应达到终点的现象是(5)将制得的
 样品溶于水,加入
样品溶于水,加入 碘水溶液时,二者恰好完全反应(
碘水溶液时,二者恰好完全反应( ),则样品的纯度为
),则样品的纯度为
您最近一年使用:0次
名校
解题方法
5 . 氮元素与人类的生命、生产等活动息息相关。
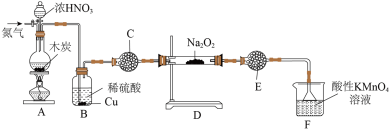
(1)亚硝酸钠( )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:① ;
;
②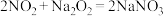
③酸性条件下, 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②装置B中的实验现象为___________ 。
③装置C的作用为___________ 。
④装置F中发生反应的离子方程式为___________ 。
(2)生物脱氮法流程如下:
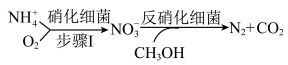
步骤I中若 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为___________ 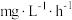 。
。
(3)目前,湿法 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一
已知:两组实验中 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为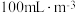
①图1是 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式___________ 。
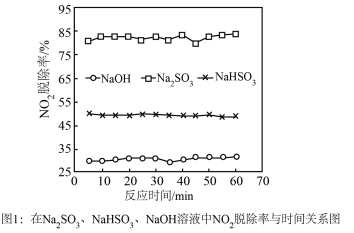
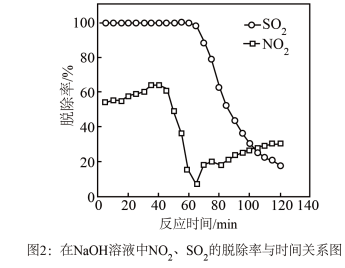
②实验发现,在相同实验条件下利用 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因___________ 。
(1)亚硝酸钠(
 )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:①
 ;
;②
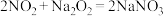
③酸性条件下,
 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为
②装置B中的实验现象为
③装置C的作用为
④装置F中发生反应的离子方程式为
(2)生物脱氮法流程如下:

步骤I中若
 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为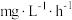 。
。(3)目前,湿法
 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一已知:两组实验中
 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为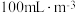
①图1是
 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式
②实验发现,在相同实验条件下利用
 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因
您最近一年使用:0次
2023-07-14更新
|
437次组卷
|
2卷引用:辽宁省辽南协作校2022-2023学年高一下学期期末考试化学试题
解题方法
6 . 某含镁废弃物中主要含有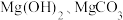 ,还含有少量的
,还含有少量的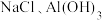 、
、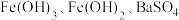 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:

已知:部分离子开始沉淀和完全沉淀的
回答下列问题:
(1)滤渣1的主要成分为_______ (填化学式),其阴离子空间构型为_______ 。
(2)“酸浸”时,发生反应的基本反应类型均为_______ ,所使用的稀盐酸的质量浓度为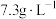 ,则其物质的量浓度为
,则其物质的量浓度为_______  。
。
(3)“氧化”时,反应的离子方程式为_______ 。
(4)“调 ”时,
”时, 的调节范围为
的调节范围为_______ (滤渣2中有两种氢氧化物)。
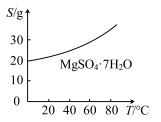
(5)已知 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括_______ 、过滤、洗涤、干燥。
(6)若测定 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
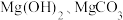 ,还含有少量的
,还含有少量的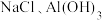 、
、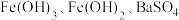 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:
已知:部分离子开始沉淀和完全沉淀的

| 氢氧化物 |  |  |  |
开始沉淀时的 | 4.0 | 8.4 | 1.9 |
完全沉淀时的 | 5.2 | 11.2 | 3.2 |
(1)滤渣1的主要成分为
(2)“酸浸”时,发生反应的基本反应类型均为
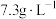 ,则其物质的量浓度为
,则其物质的量浓度为 。
。(3)“氧化”时,反应的离子方程式为
(4)“调
 ”时,
”时, 的调节范围为
的调节范围为(5)已知
 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括
(6)若测定
 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。| A | B | C | D |
 |  |  |  |
| 天平 | 坩埚 | 马弗炉(一种加热设备) | 分液漏斗 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-12更新
|
94次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
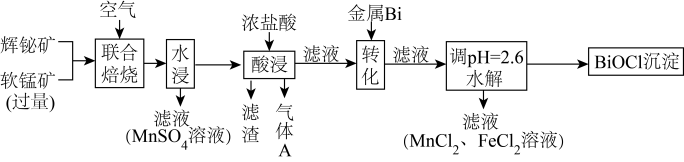
7 . 某工厂采用联合焙烧法以辉铋矿(主要成分为 ,含有
,含有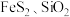 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )为原料制备
)为原料制备 和
和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的 分解为
分解为 ,
,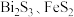 转变为
转变为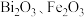 ;
;
②金属活动性: ;
;
③常温下,相关金属离子形成氢氧化物的 范围如下:
范围如下:
回答下列问题:
(1)写出“联合焙烧”时 和
和 反应生成
反应生成 的化学方程式:
的化学方程式:_______ 。
(2) 在空气中单独焙烧生成
在空气中单独焙烧生成 ,同时产生一种气体产物,若用过量的
,同时产生一种气体产物,若用过量的 溶液吸收该气体,则所得溶液的溶质为
溶液吸收该气体,则所得溶液的溶质为_______ 。
(3)“酸浸”时 转化为
转化为 ,则生成的气体A为
,则生成的气体A为_______ (填化学式)
(4)“转化”时加入金属 的目的是
的目的是_______ (用离子方程式表示)
(5)若沉淀完全时溶液中的金属离子浓度为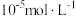 ,则由表中数据计算可得:
,则由表中数据计算可得: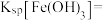
_______ 。
(6)水解生成 的离子方程式为
的离子方程式为_______ 、
(7)若取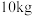 铋含量为
铋含量为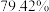 的辉铋矿,经过上述流程(铋元素在整个流程中损失率为
的辉铋矿,经过上述流程(铋元素在整个流程中损失率为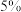 ),计算可制得
),计算可制得 固体的质量约为
固体的质量约为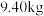 ,实测干燥的
,实测干燥的 产品产量高于计算值的原因是
产品产量高于计算值的原因是_______ 。
 ,含有
,含有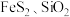 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )为原料制备
)为原料制备 和
和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为 ,
,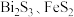 转变为
转变为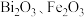 ;
;②金属活动性:
 ;
;③常温下,相关金属离子形成氢氧化物的
 范围如下:
范围如下:| 离子 | 开始沉淀 | 完全沉淀 |
 | 6.3 | 8.3 |
 | 1.6 | 3.1 |
 | 8.1 | 10.1 |
(1)写出“联合焙烧”时
 和
和 反应生成
反应生成 的化学方程式:
的化学方程式:(2)
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,同时产生一种气体产物,若用过量的
,同时产生一种气体产物,若用过量的 溶液吸收该气体,则所得溶液的溶质为
溶液吸收该气体,则所得溶液的溶质为(3)“酸浸”时
 转化为
转化为 ,则生成的气体A为
,则生成的气体A为(4)“转化”时加入金属
 的目的是
的目的是(5)若沉淀完全时溶液中的金属离子浓度为
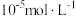 ,则由表中数据计算可得:
,则由表中数据计算可得: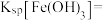
(6)水解生成
 的离子方程式为
的离子方程式为(7)若取
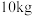 铋含量为
铋含量为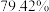 的辉铋矿,经过上述流程(铋元素在整个流程中损失率为
的辉铋矿,经过上述流程(铋元素在整个流程中损失率为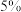 ),计算可制得
),计算可制得 固体的质量约为
固体的质量约为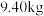 ,实测干燥的
,实测干燥的 产品产量高于计算值的原因是
产品产量高于计算值的原因是
您最近一年使用:0次
8 . 硫酸氧钒(VOSO4)对高血糖、高血脂有治疗作用,也是钒电池不可或缺的电解质。制备 的实验流程如下:
的实验流程如下:
①向仪器a中加入 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;
②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到 溶液(蓝黑色);
溶液(蓝黑色);
③ 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。
实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是_______ ,用仪器b滴加浓硫酸时,_______ (填“需要”或“不需要”)打开上端的玻璃塞。
(2)反应中最适宜的加热方式为_______ ,在a中反应生成
_______ (“是”或“不是”)氧化还原反应。
(3)反应液由橙红色变为蓝黑色的化学方程式为_______ 。
(4)纯度测定:准确称取 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用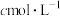 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为_______ %。
(5)性质探究:查阅资料后,有同学对 的热分解提出了两种猜想:
的热分解提出了两种猜想:
猜想ⅰ. ;
;
猜想ⅱ.
欲采用如下装置探究:
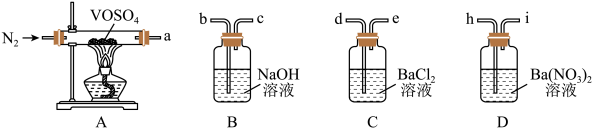
选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→_______ ;若气体流经的装置均有气泡产生,则上述所选必要装置中可观察的现象为_______ ,证明猜想ⅱ正确。
 的实验流程如下:
的实验流程如下:①向仪器a中加入
 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到
 溶液(蓝黑色);
溶液(蓝黑色);③
 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是
(2)反应中最适宜的加热方式为

(3)反应液由橙红色变为蓝黑色的化学方程式为
(4)纯度测定:准确称取
 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用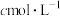 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为(5)性质探究:查阅资料后,有同学对
 的热分解提出了两种猜想:
的热分解提出了两种猜想:猜想ⅰ.
 ;
;猜想ⅱ.

欲采用如下装置探究:

选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→
您最近一年使用:0次
2023-02-08更新
|
311次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高三上学期1月期末化学试题
名校
9 . 钒(V)广泛应用于冶金、化工、航天等领域。一种以钒渣(主要成分是 、
、 、
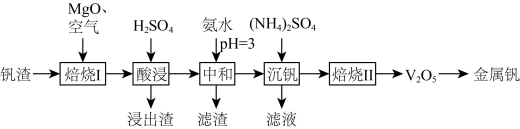
、 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示:
已知:① 具有强氧化性,主要存在于pH<2的溶液中,pH>2时转化成酸式多钒酸盐。
具有强氧化性,主要存在于pH<2的溶液中,pH>2时转化成酸式多钒酸盐。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)基态V原子的价电子轨道表示式为_______ 。
(2)“焙烧Ⅰ”中 (Fe为+2价)转化为
(Fe为+2价)转化为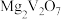 和
和 的化学方程式为
的化学方程式为_______ 。
(3)“酸浸”所得浸出液中除含有 、
、 外,还含有的金属阳离子有
外,还含有的金属阳离子有_______ 。
(4)“沉钒”可得到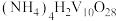 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为_______ 。
(5)“沉钒”所得滤液中加入氨水调节溶液pH=x,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制x=
,应控制x=_______ 。
(6)溶液A经加氨沉淀除镁后,溶液中的溶质可再生循环到_______ 工序使用。
(7)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如下图所示:

①该钒的硫化物的化学式是_______ 。
②该钒的硫化物的晶体中,与每个V原子最近且等距的S原子的个数是_______ 。
 、
、 、
、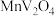 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示:
已知:①
 具有强氧化性,主要存在于pH<2的溶液中,pH>2时转化成酸式多钒酸盐。
具有强氧化性,主要存在于pH<2的溶液中,pH>2时转化成酸式多钒酸盐。②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时 的pH 的pH | 1.9 | 7.0 | 8.1 | 8.9 |
沉淀完全时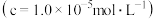 的pH 的pH | 3.2 | 9.0 | 10.1 | 10.9 |
(1)基态V原子的价电子轨道表示式为
(2)“焙烧Ⅰ”中
 (Fe为+2价)转化为
(Fe为+2价)转化为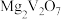 和
和 的化学方程式为
的化学方程式为(3)“酸浸”所得浸出液中除含有
 、
、 外,还含有的金属阳离子有
外,还含有的金属阳离子有(4)“沉钒”可得到
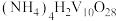 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为(5)“沉钒”所得滤液中加入氨水调节溶液pH=x,过滤得到
 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制x=
,应控制x=(6)溶液A经加氨沉淀除镁后,溶液中的溶质可再生循环到
(7)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如下图所示:

①该钒的硫化物的化学式是
②该钒的硫化物的晶体中,与每个V原子最近且等距的S原子的个数是
您最近一年使用:0次
名校
解题方法
10 . 某溶液仅含 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
B.加入稀硫酸发生反应的离子方程式为: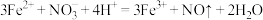 |
C.该溶液中一定有 |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
您最近一年使用:0次




