解题方法
1 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和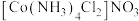 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,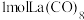 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和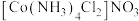 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是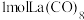 含
含 键。
键。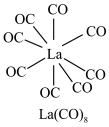
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)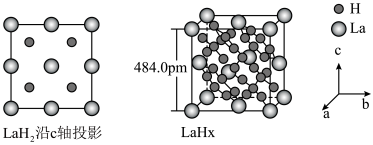
您最近一年使用:0次
2 . 以废料铅膏( 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细 ,实现铅循环再利用的流程如下:
,实现铅循环再利用的流程如下: ,
, 。②
。② 溶解在
溶解在 溶液中(杂质不溶于
溶液中(杂质不溶于 )的溶解度曲线如图所示:
)的溶解度曲线如图所示:
 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细 ,实现铅循环再利用的流程如下:
,实现铅循环再利用的流程如下: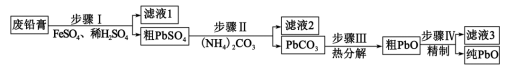
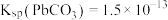 ,
,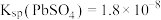 。②
。② 溶解在
溶解在 溶液中(杂质不溶于
溶液中(杂质不溶于 )的溶解度曲线如图所示:
)的溶解度曲线如图所示:
A.步骤Ⅰ发生的主要反应有 |
B.步骤Ⅱ,若滤出的 沉淀中混有 沉淀中混有 ,该滤液中 ,该滤液中 |
| C.过程中为提高产品产率,滤液3应循环使用 |
D.精制的操作是在 用碱溶解,然后趁热过滤、洗涤、干燥 用碱溶解,然后趁热过滤、洗涤、干燥 |
您最近一年使用:0次
解题方法
3 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4 2H2O实验流程如下:
2H2O实验流程如下:
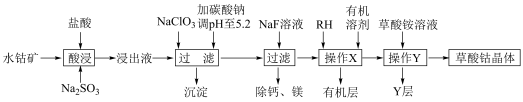
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出1种能提高酸浸速率的措施___________ ,“沉淀”的化学式为___________ 。
(2)操作X所用的玻璃仪器的名称为___________ 。
(3)“酸浸”过程中加入Na2SO3的目的是将___________ 还原(填离子符号);NaClO3的作用是将浸出液中的Fe2+氧化,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液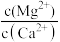 =
=___________ 。
 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出1种能提高酸浸速率的措施
(2)操作X所用的玻璃仪器的名称为
(3)“酸浸”过程中加入Na2SO3的目的是将
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
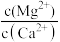 =
=
您最近一年使用:0次
解题方法
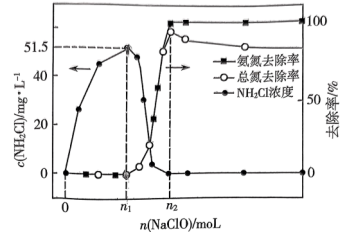
4 . 工业上可用次氯酸盐将氨氮废水转化为 实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的
实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的 混合(混合溶液体积为
混合(混合溶液体积为 ),测得溶液中氨氮(氨、
),测得溶液中氨氮(氨、 )和总氮(氨氮和
)和总氮(氨氮和 的总和)的去除率及
的总和)的去除率及 的浓度与
的浓度与 的加入量关系如图所示。
的加入量关系如图所示。
在此过程中发生的反应为:
①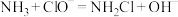
②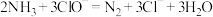
③
已知: 中氮元素为
中氮元素为 价。下列说法正确的是
价。下列说法正确的是
 实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的
实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的 混合(混合溶液体积为
混合(混合溶液体积为 ),测得溶液中氨氮(氨、
),测得溶液中氨氮(氨、 )和总氮(氨氮和
)和总氮(氨氮和 的总和)的去除率及
的总和)的去除率及 的浓度与
的浓度与 的加入量关系如图所示。
的加入量关系如图所示。
在此过程中发生的反应为:
①
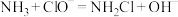
②
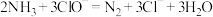
③

已知:
 中氮元素为
中氮元素为 价。下列说法正确的是
价。下列说法正确的是A.当 时,反应①中转移电子的物质的量为 时,反应①中转移电子的物质的量为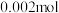 |
B.当 时, 时, |
C. |
D.当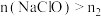 时, 时,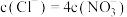 |
您最近一年使用:0次
解题方法
5 . 硝酸铈(Ⅳ)铵的化学式为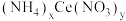 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。___________ ,装置C的作用是___________ 。该实验以氮化钙和水制备NH3应选择装置___________ (填“A”或“D”)。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为___________ 。装置B中发生反应的离子方程式为___________ 。
(3)该实验装置存在的一处缺陷为___________ 。
步骤二:制备硝酸铈(Ⅳ)铵___________ 。
(5)“烘干”采取自然干燥的原因为___________ 。
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用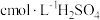 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
(6)计算y=___________ (用上述字母表示)。
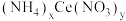 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。
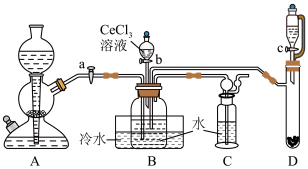
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为
(3)该实验装置存在的一处缺陷为
步骤二:制备硝酸铈(Ⅳ)铵

(5)“烘干”采取自然干燥的原因为
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用
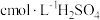 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。(6)计算y=
您最近一年使用:0次
2024-02-02更新
|
256次组卷
|
3卷引用:山东省青岛市黄岛区2023-2024学年高三上学期期末考试化学试题
名校
解题方法
6 . 铊是一种有毒有害的重金属元素,对人体有较大的危害。湿法炼锌工业废水中的主要阳离子有 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液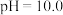 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示:
②萃取的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4
请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为___________ 。
(2)“滤渣”的主要成分是___________ (填化学式),通常在“分步沉淀”时加入絮凝剂,其目的是___________ 。
(3)请从化学平衡的角度解释“反萃取”过程中加入 的原理和目的
的原理和目的___________ 。
(4)“分步沉淀”时,沉淀第二种离子时调节溶液 的范围为
的范围为___________ ,当其恰好完全沉淀,则溶液中先沉淀的离子浓度为___________ 。
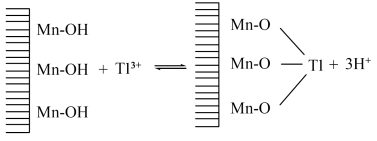
(5)废水中 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为___________ (填“阳离子”或“阴离子”)交换树脂,若使吸附剂再生,且回收 ,可将离子交换树脂浸入
,可将离子交换树脂浸入___________ 溶液。
a. b.
b. c.
c.
 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: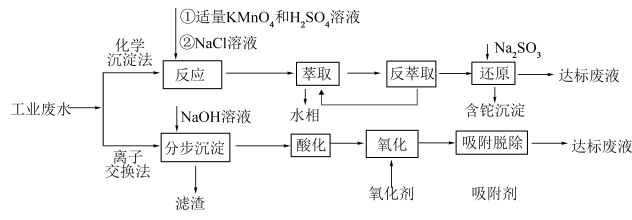
 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液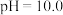 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示: | 离子 |  |  |  |
开始沉淀的 | 2.7 | 6.4 | 1.4 |
沉淀完全的 | 3.7 | 8.0 | 2.8 |

 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为
(2)“滤渣”的主要成分是
(3)请从化学平衡的角度解释“反萃取”过程中加入
 的原理和目的
的原理和目的(4)“分步沉淀”时,沉淀第二种离子时调节溶液
 的范围为
的范围为(5)废水中
 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为 ,可将离子交换树脂浸入
,可将离子交换树脂浸入a.
 b.
b. c.
c.
您最近一年使用:0次
2024-01-13更新
|
850次组卷
|
4卷引用:山东省济宁市2023-2024学年高三上学期1月期末化学试题
山东省济宁市2023-2024学年高三上学期1月期末化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2024届陕西省西安中学高三下学期三模理综试题-高中化学(已下线)T27-工业流程题
解题方法
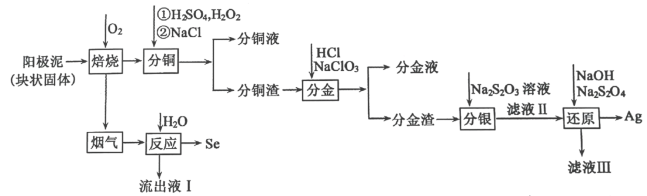
7 . 电解精炼铜的阳极泥中含有 等杂质,工业生产上从其中提取银和硒的流程如图所示:
等杂质,工业生产上从其中提取银和硒的流程如图所示:
已知: 在碱性条件下很稳定,有很强的络合能力,与
在碱性条件下很稳定,有很强的络合能力,与 形成配离子
形成配离子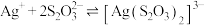 ,常温下该反应的平衡常数
,常温下该反应的平衡常数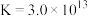 。
。
回答下列问题:
(1)加快“焙烧”速率可采取的一种措施为___________ 。
(2)流出液Ⅰ中溶质的主要成分是___________ ,分铜液中主要的金属阳离子是___________ 。
(3)“分铜”时,反应温度不能过高,原因是___________ ,加入氯化钠的主要目的是___________ 。
(4)“分金”时 转化成
转化成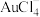 的离子方程式为
的离子方程式为___________ 。
(5)“分银”时发生的反应为 ,该反应中平衡常数
,该反应中平衡常数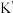
___________ [已知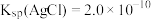 ]。
]。
(6)“还原”过程中 没有参与氧化还原过程,“滤液Ⅲ”中主要含有
没有参与氧化还原过程,“滤液Ⅲ”中主要含有 ,若制得
,若制得 银,则消耗
银,则消耗
___________  。
。
 等杂质,工业生产上从其中提取银和硒的流程如图所示:
等杂质,工业生产上从其中提取银和硒的流程如图所示:
已知:
 在碱性条件下很稳定,有很强的络合能力,与
在碱性条件下很稳定,有很强的络合能力,与 形成配离子
形成配离子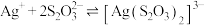 ,常温下该反应的平衡常数
,常温下该反应的平衡常数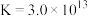 。
。回答下列问题:
(1)加快“焙烧”速率可采取的一种措施为
(2)流出液Ⅰ中溶质的主要成分是
(3)“分铜”时,反应温度不能过高,原因是
(4)“分金”时
 转化成
转化成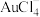 的离子方程式为
的离子方程式为(5)“分银”时发生的反应为
 ,该反应中平衡常数
,该反应中平衡常数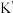
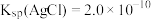 ]。
]。(6)“还原”过程中
 没有参与氧化还原过程,“滤液Ⅲ”中主要含有
没有参与氧化还原过程,“滤液Ⅲ”中主要含有 ,若制得
,若制得 银,则消耗
银,则消耗
 。
。
您最近一年使用:0次
名校
解题方法
8 . 硝酸厂烟气中的大量NO经还原法可转化为无害物质。常温下,将NO与 的混合气体通入
的混合气体通入 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是
 的混合气体通入
的混合气体通入 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是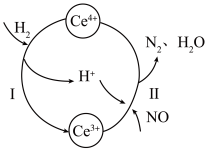
A.该转化过程的实质为NO被 还原 还原 |
| B.反应I中氧化剂与还原剂的物质的量之比为1∶2 |
C.反应II的离子反应方程式为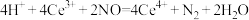 |
D.反应过程中混合溶液内 和 和 的总数不变 的总数不变 |
您最近一年使用:0次
2023-11-29更新
|
671次组卷
|
5卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试化学模拟卷(二)
名校
解题方法
9 . 分类思想是化学学科学习与研究的一种极为重要的思维方式。回答下列向题:
(1)有如下几种物质: 、
、 、
、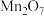 、
、 、
、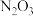 五种成盐氧化物,按化学性质可将它们分成
五种成盐氧化物,按化学性质可将它们分成________ (填“二”或“三”)类,写出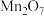 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
(2)磷能形成多种具有独特性质的物质。
①如磷能形成红磷、白磷、黑磷等多种单质,它们互为________ (填相互关系)。白磷有剧毒,硫酸铜可作为白磷中毒的解毒剂,请配平相应的化学方程式:________
____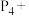 ______
______ _____
_____ _____
_____ ____
____ _____
_____
②磷的一种组成为 的盐,能与盐酸反应,但不能与
的盐,能与盐酸反应,但不能与 溶液反应,下列有关
溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是________ (填字母)。
A. 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐
C.均具有较强的还原性 D. 是三元弱酸
是三元弱酸
(1)有如下几种物质:
 、
、 、
、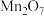 、
、 、
、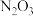 五种成盐氧化物,按化学性质可将它们分成
五种成盐氧化物,按化学性质可将它们分成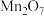 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:(2)磷能形成多种具有独特性质的物质。
①如磷能形成红磷、白磷、黑磷等多种单质,它们互为
____
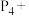 ______
______ _____
_____ _____
_____ ____
____ _____
_____
②磷的一种组成为
 的盐,能与盐酸反应,但不能与
的盐,能与盐酸反应,但不能与 溶液反应,下列有关
溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是A.
 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐C.均具有较强的还原性 D.
 是三元弱酸
是三元弱酸
您最近一年使用:0次
2023-11-13更新
|
280次组卷
|
2卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试化学模拟卷(二)
10 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______ _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) ___________
若反应生成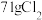 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: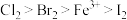 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: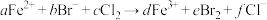 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①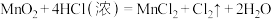
②
③
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
 _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) 若反应生成
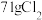 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
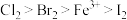 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: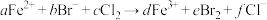 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
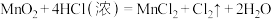
②

③

④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
2023-10-11更新
|
800次组卷
|
3卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试化学模拟卷(二)



