名校
1 . 钒(V)广泛应用于冶金、化工、航天等领域。一种以钒渣(主要成分是 、
、 、
、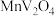 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示:
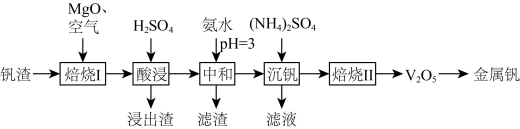
已知:① 具有强氧化性,主要存在于pH<2的溶液中,pH>2时转化成酸式多钒酸盐。
具有强氧化性,主要存在于pH<2的溶液中,pH>2时转化成酸式多钒酸盐。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)基态V原子的价电子轨道表示式为_______ 。
(2)“焙烧Ⅰ”中 (Fe为+2价)转化为
(Fe为+2价)转化为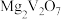 和
和 的化学方程式为
的化学方程式为_______ 。
(3)“酸浸”所得浸出液中除含有 、
、 外,还含有的金属阳离子有
外,还含有的金属阳离子有_______ 。
(4)“沉钒”可得到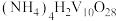 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为_______ 。
(5)“沉钒”所得滤液中加入氨水调节溶液pH=x,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制x=
,应控制x=_______ 。
(6)溶液A经加氨沉淀除镁后,溶液中的溶质可再生循环到_______ 工序使用。
(7)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如下图所示:

①该钒的硫化物的化学式是_______ 。
②该钒的硫化物的晶体中,与每个V原子最近且等距的S原子的个数是_______ 。
 、
、 、
、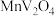 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示:
已知:①
 具有强氧化性,主要存在于pH<2的溶液中,pH>2时转化成酸式多钒酸盐。
具有强氧化性,主要存在于pH<2的溶液中,pH>2时转化成酸式多钒酸盐。②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时 的pH 的pH | 1.9 | 7.0 | 8.1 | 8.9 |
沉淀完全时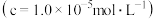 的pH 的pH | 3.2 | 9.0 | 10.1 | 10.9 |
(1)基态V原子的价电子轨道表示式为
(2)“焙烧Ⅰ”中
 (Fe为+2价)转化为
(Fe为+2价)转化为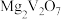 和
和 的化学方程式为
的化学方程式为(3)“酸浸”所得浸出液中除含有
 、
、 外,还含有的金属阳离子有
外,还含有的金属阳离子有(4)“沉钒”可得到
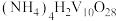 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为(5)“沉钒”所得滤液中加入氨水调节溶液pH=x,过滤得到
 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制x=
,应控制x=(6)溶液A经加氨沉淀除镁后,溶液中的溶质可再生循环到
(7)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如下图所示:

①该钒的硫化物的化学式是
②该钒的硫化物的晶体中,与每个V原子最近且等距的S原子的个数是
您最近一年使用:0次
名校
解题方法
2 . 某溶液仅含 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
B.加入稀硫酸发生反应的离子方程式为: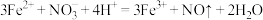 |
C.该溶液中一定有 |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
您最近一年使用:0次
解题方法
3 . 探究化学反应速率的影响因素,对工农业生产有着非常重要的意义。为探究反应速率与 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
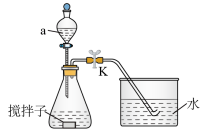
实验步骤:往锥形瓶中加入一定体积的
 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
 所需时间。回答下列问题:
所需时间。回答下列问题:
(1)仪器a的名称为_______ 。
(2)若需控制体系的温度为36℃,采取的合理加热方式为_______ 。
(3)每组实验过程的实验数据如下表所示:
i.
_______ ,
_______ 。
ii.该反应的速率方程为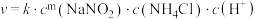 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=_______ (填整数)。
iii.醋酸的作用是_______ 。
(4)如果用同浓度的盐酸代替醋酸进行实验1, 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为_______ 。
 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
实验步骤:往锥形瓶中加入一定体积的

 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集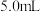
 所需时间。回答下列问题:
所需时间。回答下列问题:(1)仪器a的名称为
(2)若需控制体系的温度为36℃,采取的合理加热方式为
(3)每组实验过程的实验数据如下表所示:
| 实验编号 |  | 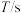 | |||
 溶液 溶液 |  溶液 溶液 | 醋酸 | 水 | ||
| 1 | 4.0 |  | 4.0 | 8.0 | 340 |
| 2 | 6.0 | 4.0 | 4.0 |  | 151 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 85 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |


ii.该反应的速率方程为
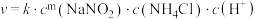 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=iii.醋酸的作用是
(4)如果用同浓度的盐酸代替醋酸进行实验1,
 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为
您最近一年使用:0次
2022-12-17更新
|
235次组卷
|
2卷引用:辽宁省鞍山市一般高中协作校2022-2023学年高一下学期期末考试化学试题
解题方法
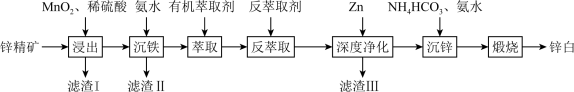
4 . 氧化锌又称锌白,作为添加剂在多种材料和产品中有广泛应用,一种以锌精矿(主要成分是ZnS,还有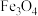 、CuO、
、CuO、 等杂质)为原料制备锌白的工艺流程如下:
等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的 如下表:
如下表:
回答下列问题:
(1)滤渣Ⅰ的主要成分除过量 外,还有S和
外,还有S和_______ (填化学式)。“浸出”时, 氧化ZnS的离子方程式为
氧化ZnS的离子方程式为_______ 。
(2)“沉铁”时,滴加氨水需要调节pH最低为_______ (通常认为残留在溶液中离子浓度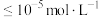 时,沉淀完全)。
时,沉淀完全)。
(3)“萃取,反萃取”时发生的反应是 。有机萃取剂能分离
。有机萃取剂能分离 和
和 ,为了提高反萃取效率,反萃取剂应该呈
,为了提高反萃取效率,反萃取剂应该呈_______ (填“酸”“碱”或“中”)性。
(4)“深度净化”中加Zn的目的是_______ 。
(5)“沉锌”时,恰好完全反应,过滤、洗涤得到碱式碳酸锌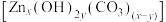 ,反应的离子方程式为
,反应的离子方程式为_______ 。检验沉淀洗涤干净的方法是_______ 。
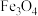 、CuO、
、CuO、 等杂质)为原料制备锌白的工艺流程如下:
等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的
 如下表:
如下表:| 物质 |  |  |  |  |  |
 | 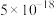 | 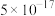 | 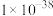 | 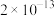 |  |
(1)滤渣Ⅰ的主要成分除过量
 外,还有S和
外,还有S和 氧化ZnS的离子方程式为
氧化ZnS的离子方程式为(2)“沉铁”时,滴加氨水需要调节pH最低为
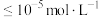 时,沉淀完全)。
时,沉淀完全)。(3)“萃取,反萃取”时发生的反应是
 。有机萃取剂能分离
。有机萃取剂能分离 和
和 ,为了提高反萃取效率,反萃取剂应该呈
,为了提高反萃取效率,反萃取剂应该呈(4)“深度净化”中加Zn的目的是
(5)“沉锌”时,恰好完全反应,过滤、洗涤得到碱式碳酸锌
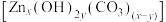 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
5 . 氮的氧化物和硫的氧化物是主要的大气污染物,烟气脱硫脱硝是环境治理的热点问题。回答下列问题:
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为___ 。
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO 。
。
①KMnO4脱硫(SO2)的离子方程式为___ 。
②KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为___ 。
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:

图a和图b中可知脱硫脱硝最佳条件是___ 。
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO
 。
。①KMnO4脱硫(SO2)的离子方程式为
②KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:

图a和图b中可知脱硫脱硝最佳条件是
您最近一年使用:0次
6 . 钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
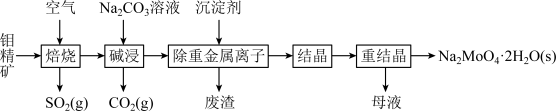
(1)提高焙烧效率的方法有:_____________ (写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________ 。氧化产物是________________ 。
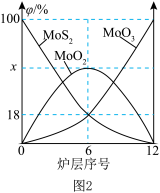
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________ 。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________ 。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为______________________ 。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________ 。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕

(1)提高焙烧效率的方法有:
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是

(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度
您最近一年使用:0次
2020-01-13更新
|
790次组卷
|
7卷引用:辽宁省协作校2021-2022高三上学期期末考试化学试题
解题方法
7 . 磷单质及其化合物有广泛应用。结合所学知识回答下列问题:
(1)磷酸的结构式为 ,三聚磷酸可视为两个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是一种常用的延长混凝土凝结时间的缓凝剂,其化学式为
,三聚磷酸可视为两个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是一种常用的延长混凝土凝结时间的缓凝剂,其化学式为_____ 。
(2)工业制备PH3的工艺流程如下(部分操作和条件略):
Ⅰ.向黄磷(P4)中加入过量浓NaOH溶液,产生PH3气体和次磷酸钠(NaH2PO2)溶液;
Ⅱ.向NaH2PO2溶液加入过量的稀硫酸,得到次磷酸(H3PO2);
Ⅲ.次磷酸(H3PO2)不稳定,受热易分解产生PH3气体和磷酸(H3PO4)。
①黄磷和烧碱溶液反应的离子方程式为_____ ,根据题意判断次磷酸属于_____ (填“一”“二”或“三”)元酸。
②次磷酸受热分解的化学方程式为_____ 。
③起始时有1mol P4参加反应,则整个工业流程中共生成_____ mol PH3(不考虑产物的损失)。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生下述反应,请配平:
_____ Ni2++ H2PO2﹣+ ═ Ni++ H2PO3﹣+ 。
(1)磷酸的结构式为
 ,三聚磷酸可视为两个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是一种常用的延长混凝土凝结时间的缓凝剂,其化学式为
,三聚磷酸可视为两个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是一种常用的延长混凝土凝结时间的缓凝剂,其化学式为(2)工业制备PH3的工艺流程如下(部分操作和条件略):
Ⅰ.向黄磷(P4)中加入过量浓NaOH溶液,产生PH3气体和次磷酸钠(NaH2PO2)溶液;
Ⅱ.向NaH2PO2溶液加入过量的稀硫酸,得到次磷酸(H3PO2);
Ⅲ.次磷酸(H3PO2)不稳定,受热易分解产生PH3气体和磷酸(H3PO4)。
①黄磷和烧碱溶液反应的离子方程式为
②次磷酸受热分解的化学方程式为
③起始时有1mol P4参加反应,则整个工业流程中共生成
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生下述反应,请配平:
您最近一年使用:0次
名校
8 . 工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________ 。
(2)副产品A的化学式是_______ 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=____ 〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是_______ ;沉锰工序中判断沉淀已经洗涤干净的实验操作是______ 。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________ 。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:__FeS2+___MnO2+___=___Fe3++__Mn2++____SO42-+____,___________

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)
(2)副产品A的化学式是
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:__FeS2+___MnO2+___=___Fe3++__Mn2++____SO42-+____,
您最近一年使用:0次
2018-01-27更新
|
780次组卷
|
3卷引用:辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题
9 . (1)白色固体PCl5受热即挥发并发生分解:PCl5(g)  PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为________ 。
(2)下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO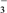 >I-,氧化性IO
>I-,氧化性IO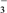 >I2>SO
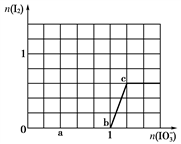
>I2>SO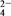 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为________ mol。
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为:_____________________ ,该过程中被氧化的元素是 ___________ ,当产生标准状况下2.24L 时,共转移电子
时,共转移电子_______ mol。
 PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为(2)下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO
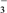 >I-,氧化性IO
>I-,氧化性IO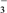 >I2>SO
>I2>SO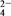 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为:
 时,共转移电子
时,共转移电子
您最近一年使用:0次
名校
10 . 二氧化氯(ClO2)在水处理等方面有广泛应用,制备ClO2有下列两种方法:Na2SO4
方法一:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+______ +2H2O
方法二:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(1)方法一中空白处的物质的化学式是________ (该化学方程式已配平),反应的还原剂是______ 。若反应中电子转移数为0.1NA,则产生的气体标准状况下的体积为______ L。
(2)方法二中盐酸表现的性质是________ ,该反应的还原产物是_______ 。
(3)根据方法二,实验室用NaClO3和8mol/L的盐酸反应即可反应制得ClO2。若使用12mol/L盐酸配制8mol/L的盐酸,实验室中需用到的计量仪器有________ 。所用的浓盐酸长时间放置在密闭性不好的容器中,最终所配制的盐酸的浓度有无变化?__________ (填“偏高”、“偏低”或“无影响”)
方法一:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+
方法二:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(1)方法一中空白处的物质的化学式是
(2)方法二中盐酸表现的性质是
(3)根据方法二,实验室用NaClO3和8mol/L的盐酸反应即可反应制得ClO2。若使用12mol/L盐酸配制8mol/L的盐酸,实验室中需用到的计量仪器有
您最近一年使用:0次



