名校
1 . 高铁酸钾 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在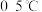 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:

回答下列问题:
(1)配制 溶液。
溶液。
①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和_______ ,需要用托盘天平称量 固体
固体_______ g。
②下列操作可能导致上述 溶液浓度偏大的是
溶液浓度偏大的是_______ (填字母)。
A.摇匀后发现液面低于刻度线,再加水至刻度线
B. 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤
C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为_______ (从物质性质角度)。
(2)“氧化”过程中溶液保持强碱性,写出 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:_______ 。
(3)“除杂”后滤液的主要成分为 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是_______ 。
(4) 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是_______ 。
 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在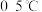 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
回答下列问题:
(1)配制
 溶液。
溶液。①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和
 固体
固体②下列操作可能导致上述
 溶液浓度偏大的是
溶液浓度偏大的是A.摇匀后发现液面低于刻度线,再加水至刻度线
B.
 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的
 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为(2)“氧化”过程中溶液保持强碱性,写出
 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:(3)“除杂”后滤液的主要成分为
 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是(4)
 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是
您最近一年使用:0次
2024-03-02更新
|
64次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
名校
解题方法
2 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
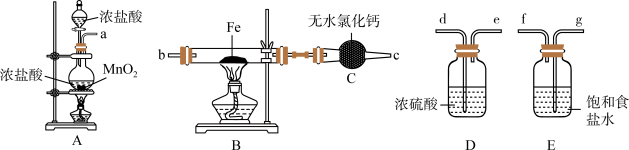
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
79次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
解题方法
3 . 氯化碘(ICl)是红棕色液体,易挥发,熔点为 ,沸点为
,沸点为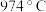 ,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
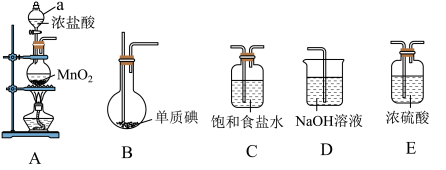
(1)a仪器名称___________ 。
(2)上述装置,按气流方向连接的顺序为___________ (装置可重复使用)。
(3)A装置中发生反应的化学方程式为___________ 。
(4)氟化氯与氯化碘都是卤素互化物,它可用于制备硝酸氯,原理为: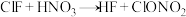 ,下列判断中正确的是___________。
,下列判断中正确的是___________。
(5)高铁酸钾 与
与 都是高效消毒剂,实验室可将氯气通入过量
都是高效消毒剂,实验室可将氯气通入过量 与
与 的混合溶液来制备
的混合溶液来制备 。向
。向 滴加盐酸可以生成氯气,说明氧化性:
滴加盐酸可以生成氯气,说明氧化性:
___________  (填“>”或“<”),而
(填“>”或“<”),而 的制备实验表明
的制备实验表明 和
和 的氧化性强弱关系相反,其原因是
的氧化性强弱关系相反,其原因是___________ 。
 ,沸点为
,沸点为 ,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
(1)a仪器名称
(2)上述装置,按气流方向连接的顺序为
(3)A装置中发生反应的化学方程式为
(4)氟化氯与氯化碘都是卤素互化物,它可用于制备硝酸氯,原理为:
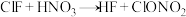 ,下列判断中正确的是___________。
,下列判断中正确的是___________。A. 和 和 熔融状态均能导电 熔融状态均能导电 |
B. 与 与 反应时,氯元素被还原 反应时,氯元素被还原 |
C.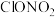 与水反应生成盐酸和硝酸 与水反应生成盐酸和硝酸 |
D. 化学性质与卤素单质相似,可以与锌反应 化学性质与卤素单质相似,可以与锌反应 |
(5)高铁酸钾
 与
与 都是高效消毒剂,实验室可将氯气通入过量
都是高效消毒剂,实验室可将氯气通入过量 与
与 的混合溶液来制备
的混合溶液来制备 。向
。向 滴加盐酸可以生成氯气,说明氧化性:
滴加盐酸可以生成氯气,说明氧化性:
 (填“>”或“<”),而
(填“>”或“<”),而 的制备实验表明
的制备实验表明 和
和 的氧化性强弱关系相反,其原因是
的氧化性强弱关系相反,其原因是
您最近一年使用:0次
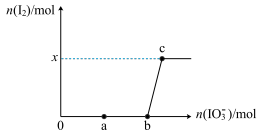
4 . 往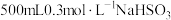 溶液中逐滴加入KIO3溶液,加入的KIO3和生成的I2的物质的量的关系曲线如图所示(不考虑物质与水发生的反应及弱电解质的电离)。
溶液中逐滴加入KIO3溶液,加入的KIO3和生成的I2的物质的量的关系曲线如图所示(不考虑物质与水发生的反应及弱电解质的电离)。
回答下列问题:
(1)NaHSO3在水中的电离方程式为___________ 。
(2)a点溶液的pH___________ (填“>”、“<”或“=”)7,判断的理由为___________ (用离子方程式表示)。
(3)b点溶液中所含的阳离子有___________ (填离子符号)。
(4)b→c的离子方程式为___________ 。
(5)往c点溶液中加入淀粉溶液,可以观察到的现象为___________ 。
(6)x=___________ 。
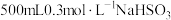 溶液中逐滴加入KIO3溶液,加入的KIO3和生成的I2的物质的量的关系曲线如图所示(不考虑物质与水发生的反应及弱电解质的电离)。
溶液中逐滴加入KIO3溶液,加入的KIO3和生成的I2的物质的量的关系曲线如图所示(不考虑物质与水发生的反应及弱电解质的电离)。
回答下列问题:
(1)NaHSO3在水中的电离方程式为
(2)a点溶液的pH
(3)b点溶液中所含的阳离子有
(4)b→c的离子方程式为
(5)往c点溶液中加入淀粉溶液,可以观察到的现象为
(6)x=
您最近一年使用:0次
5 . 某工厂制备Cr(OH)3的工艺流程如图所示:
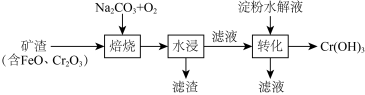
已知:焙烧后Cr元素以+6价的形式存在。
下列说法正确的是

已知:焙烧后Cr元素以+6价的形式存在。
下列说法正确的是
| A.Na2CO3俗称水玻璃 |
| B.FeO、Cr2O3、O2均不溶于稀盐酸 |
C.焙烧时发生反应的化学方程式可能为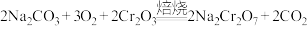 |
| D.淀粉水解液能产生丁达尔效应,且其在转化时的主要作用为作催化剂 |
您最近一年使用:0次
6 . 将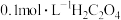 溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
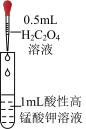
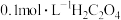 溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
| A.H2C2O4属于二元强酸 |
| B.该反应中,每生成0.2molC=O键,转移的电子的物质的量为0.1mol |
| C.当胶头滴管中的溶液全部滴加完,一段时间后,试管中溶液的颜色由紫色变为无色 |
D.该反应的化学方程式为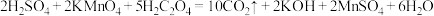 |
您最近一年使用:0次
2023-07-25更新
|
77次组卷
|
2卷引用:辽宁省部分学校2022-2023学年高二下学期期末考试化学试题
7 . 溴、碘主要存在于海水里,有“海洋元素”的美称。我国海带产量位居世界第一,海带除供食用外,还可大量用于制碘。从海带中提取碘单质的工艺流程如图。请回答下列问题:
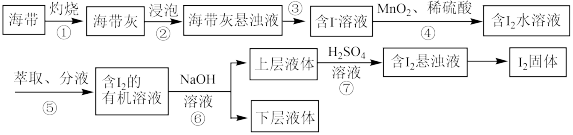
(1)溴、碘均为第ⅦA族元素,位于元素周期表前五周期的第ⅦA族元素对应的最简单氢化物中沸点最高的是_____ (填氢化物的化学式),位于元素周期表前五周期的第ⅦA族元素对应的单质的氧化性由强到弱的顺序为_____ (填化学式), 的空间结构为
的空间结构为_____ 。
(2)步骤④发生反应的离子方程式为_____ (已知: 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用_____ (填标号)代替。
A. B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

“萃取、分液”的具体操作如下:
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用_____ 吸收含溴单质的空气来达到富集溴元素的目的。

(1)溴、碘均为第ⅦA族元素,位于元素周期表前五周期的第ⅦA族元素对应的最简单氢化物中沸点最高的是
 的空间结构为
的空间结构为(2)步骤④发生反应的离子方程式为
 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用A.
 B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

“萃取、分液”的具体操作如下:
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用
您最近一年使用:0次
解题方法
8 . 海水中蕴藏着大量资源,利用海水可提取溴和镁,主要工业生产流程如下图所示:
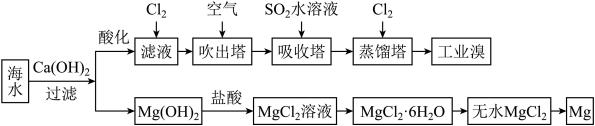
请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为___________ 。
(2)提取溴的过程中,经过两次 的转化,其目的是
的转化,其目的是___________ 。
(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
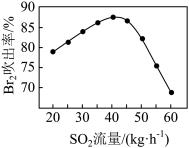
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是___________ 。
(4)工业上也可用 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。________
___________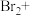 ___________
___________ ___________
___________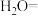 __________
__________
 ___________
___________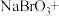 ___________
___________
(5)从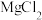 溶液中得到
溶液中得到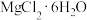 晶体的主要操作为
晶体的主要操作为___________ 、___________ 、过滤、洗涤、干燥(在HCl气流的保护下)。
(6)工业上用无水氯化镁得到金属镁的冶炼方法为___________ 。
(7)请写出上述过程中可以循环利用的一种物质___________ 。(写出化学式)。

请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为
(2)提取溴的过程中,经过两次
 的转化,其目的是
的转化,其目的是(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是(4)工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。___________
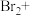 ___________
___________ ___________
___________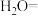 __________
__________
 ___________
___________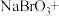 ___________
___________
(5)从
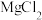 溶液中得到
溶液中得到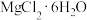 晶体的主要操作为
晶体的主要操作为(6)工业上用无水氯化镁得到金属镁的冶炼方法为
(7)请写出上述过程中可以循环利用的一种物质
您最近一年使用:0次
解题方法
9 . 某含镁废弃物中主要含有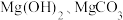 ,还含有少量的
,还含有少量的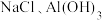 、
、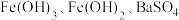 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:

已知:部分离子开始沉淀和完全沉淀的
回答下列问题:
(1)滤渣1的主要成分为_______ (填化学式),其阴离子空间构型为_______ 。
(2)“酸浸”时,发生反应的基本反应类型均为_______ ,所使用的稀盐酸的质量浓度为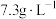 ,则其物质的量浓度为
,则其物质的量浓度为_______  。
。
(3)“氧化”时,反应的离子方程式为_______ 。
(4)“调 ”时,
”时, 的调节范围为
的调节范围为_______ (滤渣2中有两种氢氧化物)。
(5)已知 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括_______ 、过滤、洗涤、干燥。
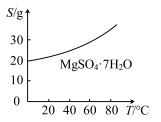
(6)若测定 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
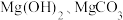 ,还含有少量的
,还含有少量的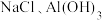 、
、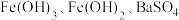 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:
已知:部分离子开始沉淀和完全沉淀的

| 氢氧化物 |  |  |  |
开始沉淀时的 | 4.0 | 8.4 | 1.9 |
完全沉淀时的 | 5.2 | 11.2 | 3.2 |
(1)滤渣1的主要成分为
(2)“酸浸”时,发生反应的基本反应类型均为
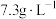 ,则其物质的量浓度为
,则其物质的量浓度为 。
。(3)“氧化”时,反应的离子方程式为
(4)“调
 ”时,
”时, 的调节范围为
的调节范围为(5)已知
 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括
(6)若测定
 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。| A | B | C | D |
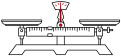 | 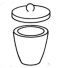 |  |  |
| 天平 | 坩埚 | 马弗炉(一种加热设备) | 分液漏斗 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-12更新
|
94次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
解题方法
10 . 氯元素的单质及其化合物在生产、生活中均有重要用途。请结合相关知识回答下列问题:
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式___________ ,使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因___________ 。
(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯( )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式___________ ,该反应中氧化剂与还原剂物质的量之比为___________ 。
(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应: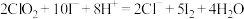 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: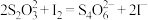 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:___________ 。
(4)实验室要配制1L 0.2 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:
①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为___________ (填序号),定容的具体操作是___________ 。
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯(
 )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应:
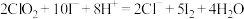 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: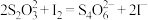 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:(4)实验室要配制1L 0.2
 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为
您最近一年使用:0次



