解题方法
1 . 海水中蕴藏着大量资源,利用海水可提取溴和镁,主要工业生产流程如下图所示:
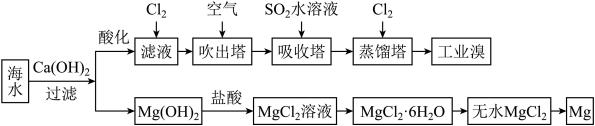
请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为___________ 。
(2)提取溴的过程中,经过两次 的转化,其目的是
的转化,其目的是___________ 。
(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
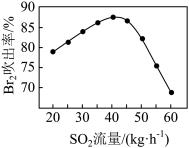
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是___________ 。
(4)工业上也可用 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。________
___________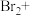 ___________
___________ ___________
___________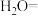 __________
__________
 ___________
___________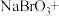 ___________
___________
(5)从 溶液中得到
溶液中得到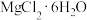 晶体的主要操作为
晶体的主要操作为___________ 、___________ 、过滤、洗涤、干燥(在HCl气流的保护下)。
(6)工业上用无水氯化镁得到金属镁的冶炼方法为___________ 。
(7)请写出上述过程中可以循环利用的一种物质___________ 。(写出化学式)。

请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为
(2)提取溴的过程中,经过两次
 的转化,其目的是
的转化,其目的是(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是(4)工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。___________
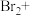 ___________
___________ ___________
___________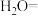 __________
__________
 ___________
___________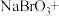 ___________
___________
(5)从
 溶液中得到
溶液中得到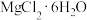 晶体的主要操作为
晶体的主要操作为(6)工业上用无水氯化镁得到金属镁的冶炼方法为
(7)请写出上述过程中可以循环利用的一种物质
您最近一年使用:0次
解题方法
2 . 某含镁废弃物中主要含有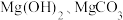 ,还含有少量的
,还含有少量的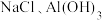 、
、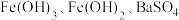 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:

已知:部分离子开始沉淀和完全沉淀的
回答下列问题:
(1)滤渣1的主要成分为_______ (填化学式),其阴离子空间构型为_______ 。
(2)“酸浸”时,发生反应的基本反应类型均为_______ ,所使用的稀盐酸的质量浓度为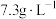 ,则其物质的量浓度为
,则其物质的量浓度为_______  。
。
(3)“氧化”时,反应的离子方程式为_______ 。
(4)“调 ”时,
”时, 的调节范围为
的调节范围为_______ (滤渣2中有两种氢氧化物)。
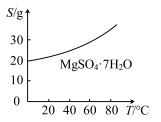
(5)已知 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括_______ 、过滤、洗涤、干燥。
(6)若测定 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
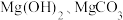 ,还含有少量的
,还含有少量的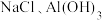 、
、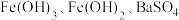 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:
已知:部分离子开始沉淀和完全沉淀的

| 氢氧化物 |  |  |  |
开始沉淀时的 | 4.0 | 8.4 | 1.9 |
完全沉淀时的 | 5.2 | 11.2 | 3.2 |
(1)滤渣1的主要成分为
(2)“酸浸”时,发生反应的基本反应类型均为
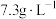 ,则其物质的量浓度为
,则其物质的量浓度为 。
。(3)“氧化”时,反应的离子方程式为
(4)“调
 ”时,
”时, 的调节范围为
的调节范围为(5)已知
 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括
(6)若测定
 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。| A | B | C | D |
 |  |  |  |
| 天平 | 坩埚 | 马弗炉(一种加热设备) | 分液漏斗 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-12更新
|
106次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
解题方法
3 . 氯元素的单质及其化合物在生产、生活中均有重要用途。请结合相关知识回答下列问题:
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式___________ ,使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因___________ 。
(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯( )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式___________ ,该反应中氧化剂与还原剂物质的量之比为___________ 。
(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应: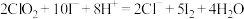 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: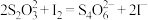 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:___________ 。
(4)实验室要配制1L 0.2 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:
①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为___________ (填序号),定容的具体操作是___________ 。
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯(
 )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应:
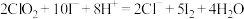 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: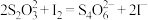 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:(4)实验室要配制1L 0.2
 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为
您最近一年使用:0次
4 . 氯元素形成的单质或化合物用途广泛。
(1)氯元素在周期表中的位置_____ 。
(2)工业上可用钢瓶储运液氯,在加注液氯前要对钢瓶进行充分干燥的原因是_____ (填合适的化学方程式)。
如图是氯的价类二维图:

其中C是一种新型净水剂,其合成路线如图:
(3)C为______ (填化学式)。
(4)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:Zn+Cu2+=Zn2++Cu的氧化半反应可以表示为:Zn-2e-=Zn2+,电解时生成d的氧化半反应式为______ 。
(5)“a的合成塔”中发生反应的化学方程式为______ 。
(6)“c的发生器”中发生反应的离子方程式为_____ (写出正确的离子方程式并用单线桥法分析电子转移的情况)。
(7)实验测得等物质的量的f、O3、H2O2具有相同的漂白能力,原因是_____ 。
(1)氯元素在周期表中的位置
(2)工业上可用钢瓶储运液氯,在加注液氯前要对钢瓶进行充分干燥的原因是
如图是氯的价类二维图:

其中C是一种新型净水剂,其合成路线如图:

(3)C为
(4)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:Zn+Cu2+=Zn2++Cu的氧化半反应可以表示为:Zn-2e-=Zn2+,电解时生成d的氧化半反应式为
(5)“a的合成塔”中发生反应的化学方程式为
(6)“c的发生器”中发生反应的离子方程式为
(7)实验测得等物质的量的f、O3、H2O2具有相同的漂白能力,原因是
您最近一年使用:0次
解题方法
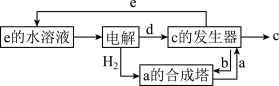
5 . I.A、B、C、D、E为中学常见化学物质,它们之间可发生如图所示的转化,反应条件和部分产物已略去。其中A、C、E含有同一种元素X;A、D是常见金属单质,B是一种黄绿色气体。
(1)物质B的化学式为_______ ;物质C中元素X的价态为_______ 。
(2)反应②可用于蚀刻铜电路板,其化学方程式为_______ 。
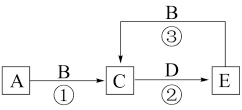
II.高铁酸钠是钠的六价铁酸盐,化学式为 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(3)装置A中,盛装浓盐酸的仪器名称为_______ ;若不考虑本实验条件限制,制备 时还可以将
时还可以将 替换为
替换为_______ (写出一种即可)。
(4)装置B中盛装液体的作用为_______ 。
(5)先向装置C的三颈烧瓶中通入一段时间 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。

(1)物质B的化学式为
(2)反应②可用于蚀刻铜电路板,其化学方程式为
II.高铁酸钠是钠的六价铁酸盐,化学式为
 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(3)装置A中,盛装浓盐酸的仪器名称为
 时还可以将
时还可以将 替换为
替换为(4)装置B中盛装液体的作用为
(5)先向装置C的三颈烧瓶中通入一段时间
 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为
您最近一年使用:0次
解题方法
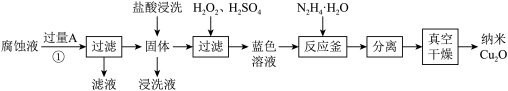
6 . 纳米 是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含
是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含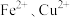 )为原料制备,实现变废为宝,路线如下:
)为原料制备,实现变废为宝,路线如下:
已知:a.当温度为60℃时,过氧化氢分解率为50%左右;
b. 中的
中的 元素为
元素为 价。
价。
请回答下列问题
(1)流程中的 为
为_______ (填化学式),①发生的反应的离子方程式为_______ ;
(2)“氧化”步骤为了加快反应速率可以适当升温,但不宜加热温度过高,原因是_______ ;
(3)为验证“反应釜”中反应已发生,可采用的实验操作是_______ ,从反应体系中分离出分散质_______ (填“能”或“不能”)选择过滤操作,理由是_______ ;
(4)发生反应时,“反应釜”中获得一种气体为空气主要成分,写出其中发生反应的离子方程式,并用单线桥法表示电子转移情况_______ ;
 是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含
是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含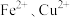 )为原料制备,实现变废为宝,路线如下:
)为原料制备,实现变废为宝,路线如下:
已知:a.当温度为60℃时,过氧化氢分解率为50%左右;
b.
 中的
中的 元素为
元素为 价。
价。请回答下列问题
(1)流程中的
 为
为(2)“氧化”步骤为了加快反应速率可以适当升温,但不宜加热温度过高,原因是
(3)为验证“反应釜”中反应已发生,可采用的实验操作是
(4)发生反应时,“反应釜”中获得一种气体为空气主要成分,写出其中发生反应的离子方程式,并用单线桥法表示电子转移情况
您最近一年使用:0次
名校
解题方法
7 . 二氧化氯( )是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法
)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法 发生器进行消毒的水中含有中等毒性的
发生器进行消毒的水中含有中等毒性的 ,进一步研究表明
,进一步研究表明 是由于
是由于 制备过程中未完全反应的
制备过程中未完全反应的 原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。
原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。
实验原理: 溶液(质量分数
溶液(质量分数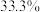 )与盐酸溶液(
)与盐酸溶液( 质量分数
质量分数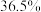 )经计量泵按
)经计量泵按 比例进入发生器连续进行反应,并在水射器的抽吸作用下,将
比例进入发生器连续进行反应,并在水射器的抽吸作用下,将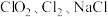 等产物和含有
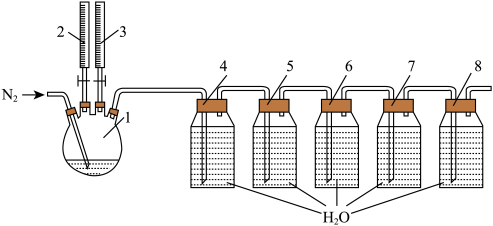
等产物和含有 与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
实验步骤:
i.将 溶液与盐酸溶液按
溶液与盐酸溶液按 比例加入烧瓶1中,产生黄绿色气体后通入高纯
比例加入烧瓶1中,产生黄绿色气体后通入高纯 ;
;
ⅱ.反应90分钟,将5个广口瓶内的液体和烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液;
iii.分别在反应温度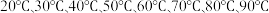 重复上述过程;
重复上述过程;
iv.测试复合二氧化氯消毒液中各组分浓度,收集整理数据。
(1)用来滴加反应液的仪器名称:_______ ;为确保实验准确性,控制反应温度,发生装置选择的加热方式:_______ 。
(2)烧瓶1中反应的化学方程式:_______ 。
(3)若已知所用盐酸的密度是 。则盐酸的浓度是:
。则盐酸的浓度是:_______ 。
(4)通入高纯 的作用:
的作用:_______ 。
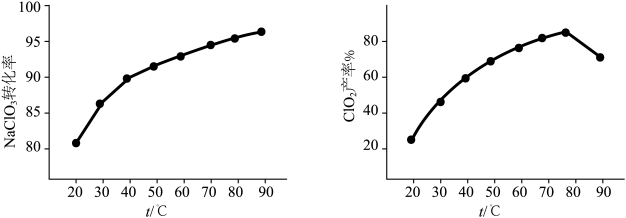
(5) 转化率及
转化率及 产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量
产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量_______ (填“升高”或“降低”):改变反应时间,重复实验, 产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析
产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析 时
时 产率降低的可能原因
产率降低的可能原因_______ 。
(6)二氧化氯可氧化 等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是
等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是_______ 。
a.含二氧化氯漱口水去除口腔异味 b.酒精消毒 c.明矾净水
 )是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法
)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法 发生器进行消毒的水中含有中等毒性的
发生器进行消毒的水中含有中等毒性的 ,进一步研究表明
,进一步研究表明 是由于
是由于 制备过程中未完全反应的
制备过程中未完全反应的 原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。
原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。实验原理:
 溶液(质量分数
溶液(质量分数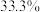 )与盐酸溶液(
)与盐酸溶液( 质量分数
质量分数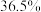 )经计量泵按
)经计量泵按 比例进入发生器连续进行反应,并在水射器的抽吸作用下,将
比例进入发生器连续进行反应,并在水射器的抽吸作用下,将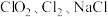 等产物和含有
等产物和含有 与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
实验步骤:
i.将
 溶液与盐酸溶液按
溶液与盐酸溶液按 比例加入烧瓶1中,产生黄绿色气体后通入高纯
比例加入烧瓶1中,产生黄绿色气体后通入高纯 ;
;ⅱ.反应90分钟,将5个广口瓶内的液体和烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液;
iii.分别在反应温度
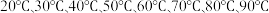 重复上述过程;
重复上述过程;iv.测试复合二氧化氯消毒液中各组分浓度,收集整理数据。
(1)用来滴加反应液的仪器名称:
(2)烧瓶1中反应的化学方程式:
(3)若已知所用盐酸的密度是
 。则盐酸的浓度是:
。则盐酸的浓度是:(4)通入高纯
 的作用:
的作用:(5)
 转化率及
转化率及 产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量
产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量 产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析
产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析 时
时 产率降低的可能原因
产率降低的可能原因
(6)二氧化氯可氧化
 等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是
等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是a.含二氧化氯漱口水去除口腔异味 b.酒精消毒 c.明矾净水
您最近一年使用:0次
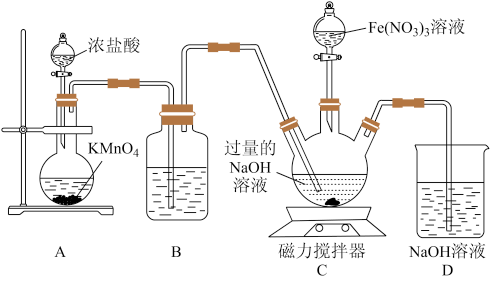
8 . 硫酸氧钒(VOSO4)对高血糖、高血脂有治疗作用,也是钒电池不可或缺的电解质。制备 的实验流程如下:
的实验流程如下:
①向仪器a中加入 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;
②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到 溶液(蓝黑色);
溶液(蓝黑色);
③ 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。
实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是_______ ,用仪器b滴加浓硫酸时,_______ (填“需要”或“不需要”)打开上端的玻璃塞。
(2)反应中最适宜的加热方式为_______ ,在a中反应生成
_______ (“是”或“不是”)氧化还原反应。
(3)反应液由橙红色变为蓝黑色的化学方程式为_______ 。
(4)纯度测定:准确称取 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用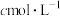 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为_______ %。
(5)性质探究:查阅资料后,有同学对 的热分解提出了两种猜想:
的热分解提出了两种猜想:
猜想ⅰ. ;
;
猜想ⅱ.
欲采用如下装置探究:
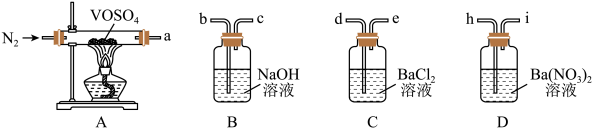
选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→_______ ;若气体流经的装置均有气泡产生,则上述所选必要装置中可观察的现象为_______ ,证明猜想ⅱ正确。
 的实验流程如下:
的实验流程如下:①向仪器a中加入
 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到
 溶液(蓝黑色);
溶液(蓝黑色);③
 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是
(2)反应中最适宜的加热方式为

(3)反应液由橙红色变为蓝黑色的化学方程式为
(4)纯度测定:准确称取
 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用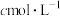 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为(5)性质探究:查阅资料后,有同学对
 的热分解提出了两种猜想:
的热分解提出了两种猜想:猜想ⅰ.
 ;
;猜想ⅱ.

欲采用如下装置探究:

选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→
您最近一年使用:0次
2023-02-08更新
|
312次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高三上学期1月期末化学试题
名校
9 . V(钒)能形成多种不同颜色的离子,其转化关系如图所示(注:图中所加试剂均足量),下列说法正确的是
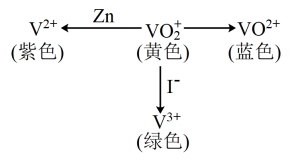

| A.图中转化关系只有部分存在电子转移 |
| B.由图中转化可知,I-比Zn还原性强 |
C.可加入氧化剂实现 溶液由黄色转化为蓝色 溶液由黄色转化为蓝色 |
D.V(钒)有 、 、 、 、 、 、 等多种化合价 等多种化合价 |
您最近一年使用:0次
2022-09-02更新
|
537次组卷
|
5卷引用:辽宁省鞍山市普通高中2021-2022学年高一上学期期末质量监测化学试题
解题方法
10 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为主要原料制备硫酸的工艺流程如下图所示:
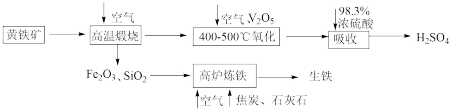
回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是_______ ;煅烧时发生反应的化学方程式为_______ 。
(2)“氧化”时,发生反应的化学方程式为_______ 。
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是_______ 。
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:_______ ;若投入Fe2O3的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中Fe2O3的转化率为_______ 。

回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是
(2)“氧化”时,发生反应的化学方程式为
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:
您最近一年使用:0次
2022-07-12更新
|
316次组卷
|
2卷引用:辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题



