解题方法
1 . 某校化学实验小组学生为了验证非金属元素氯的非金属性强于硫和氮,设计了一套实验装置如图(已知氯气能把氨气氧化生成氮气和氯化氢)。
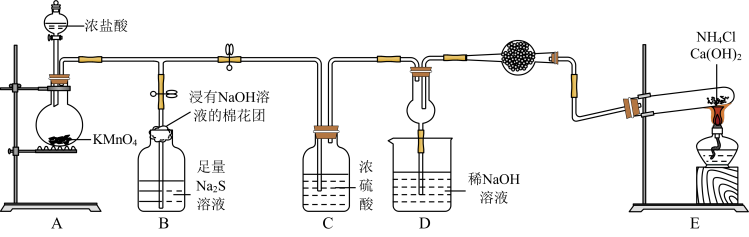
回答下列问题:
(1)配平A中反应的化学方程式:_______ _______HCl(浓)+_______KMnO4=_______MnCl2+_______KCl+_______Cl2↑+_______ H2O。该反应中氧化剂与还原剂物质的量之比为_______ 。
(2)B中浸有NaOH溶液的棉花团的作用为_______ ;B中的现象为_______ ,由该现象得非金属性:Cl>>S。
(3)E中反应化学方程式为_______ 。
(4)D中出现白烟,涉及的反应化学方程式为_______ 、_______ 。
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为_______ (填名称)。
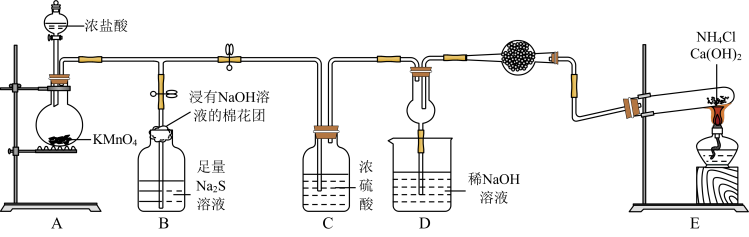
回答下列问题:
(1)配平A中反应的化学方程式:
(2)B中浸有NaOH溶液的棉花团的作用为
(3)E中反应化学方程式为
(4)D中出现白烟,涉及的反应化学方程式为
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为
您最近一年使用:0次
2022-07-14更新
|
232次组卷
|
2卷引用:辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题
解题方法
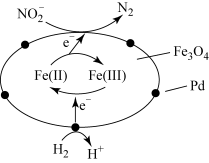
2 . 在催化剂作用下,H2可处理废水中的NO ,反应原理如图所示。下列说法错误的是
,反应原理如图所示。下列说法错误的是
 ,反应原理如图所示。下列说法错误的是
,反应原理如图所示。下列说法错误的是
| A.Fe3O4具有传递电子的作用 |
| B.Pd和Fe3O4均是该过程的催化剂 |
| C.处理后的废水中酸性增强 |
D.每消耗67.2L(标准状况下)H2,可还原2molNO |
您最近一年使用:0次
解题方法
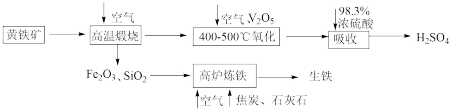
3 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为主要原料制备硫酸的工艺流程如下图所示:
回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是_______ ;煅烧时发生反应的化学方程式为_______ 。
(2)“氧化”时,发生反应的化学方程式为_______ 。
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是_______ 。
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:_______ ;若投入Fe2O3的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中Fe2O3的转化率为_______ 。

回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是
(2)“氧化”时,发生反应的化学方程式为
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:
您最近一年使用:0次
2022-07-12更新
|
313次组卷
|
2卷引用:辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题
名校
解题方法
4 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
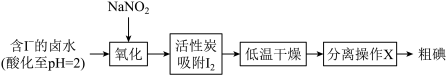
已知:pH=2时,I.NaNO2溶液只能将I-氧化为I2,同时生成NO
II.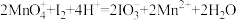
①氧化过程的离子方程式为_______ 。
②根据I2的特性,分离操作X应为_______ 、冷却结晶。
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是_______ 。
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:
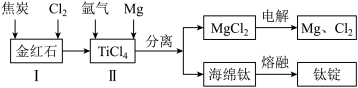
①I在高温条件下进行,产物中有一种可燃性无色气体。I中反应的化学方程式为_______ 。
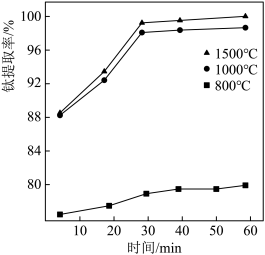
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为_______ ℃。
③II中氩气的作用是_______ 。
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有_______ (填化学式)。
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:

已知:pH=2时,I.NaNO2溶液只能将I-氧化为I2,同时生成NO
II.
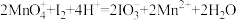
①氧化过程的离子方程式为
②根据I2的特性,分离操作X应为
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:

①I在高温条件下进行,产物中有一种可燃性无色气体。I中反应的化学方程式为
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

③II中氩气的作用是
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有
您最近一年使用:0次
2022-07-12更新
|
547次组卷
|
4卷引用:辽宁省锦州市2021-2022学年高一下学期期末考试化学试卷
名校
5 . 在酸性条件下,黄铁矿( )催化氧化的反应方程式为
)催化氧化的反应方程式为 。实现该反应的物质间转化如图所示。下列分析错误的是
。实现该反应的物质间转化如图所示。下列分析错误的是
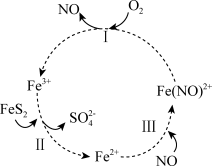
 )催化氧化的反应方程式为
)催化氧化的反应方程式为 。实现该反应的物质间转化如图所示。下列分析错误的是
。实现该反应的物质间转化如图所示。下列分析错误的是
A.反应Ⅰ的离子方程式为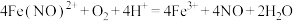 |
B.反应Ⅱ的氧化剂是 |
C.反应Ⅲ的离子方程式为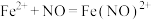 ,该反应是氧化还原反应 ,该反应是氧化还原反应 |
| D.在酸性条件下,黄铁矿催化氧化中NO作催化剂 |
您最近一年使用:0次
2022-05-28更新
|
2158次组卷
|
11卷引用:辽宁省葫芦岛市普通高中2022-2023学年高一上学期学业质量监测(期末)考试化学试题
辽宁省葫芦岛市普通高中2022-2023学年高一上学期学业质量监测(期末)考试化学试题江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题(已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)(已下线)1.3.3 氧化还原反应方程式配平(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)安徽省舒城中学2022-2023学年高一上学期第二次月考化学试题湖北省襄阳市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学(丹河校区)2022-2023学年高一上学期第二次调研考试化学试题山西省实验中学2022-2023学年高一上学期第一次月考化学试题江西省万载中学创新班2022-2023学年高一下学期期中考试化学试题四川省成都市成华区某校2023-2024学年高一上学期12月月考化学试题宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题
名校
解题方法
6 . 某兴趣小组利用经过初步处理的含有Fe2+的废液制备硫酸亚铁晶体的流程如图:____ ,若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为____ 。
(2)加入铁粉的作用是____ 。
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:____ 。
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为____ 。
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为____ ,该反应中每产生1molFe2O3,转移的电子数为____ NA。

(2)加入铁粉的作用是
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为
您最近一年使用:0次
2022-03-16更新
|
216次组卷
|
2卷引用:辽宁省渤海大学附属高级中学2021-2022学年高一上学期期末质量检测化学试题
7 . 化学上常用标准电极电势数据φθ(氧化型/还原型)比较物质氧化能力。φθ值越高,氧化型物质氧化能力越强,φθ值与体系pH有关。利用表格所给数据分析,以下说法错误的是
| 氧化型/还原型 | φθ(Co3+/Co2+) | φθ(HClO/Cl— |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φθ[Co(OH)3/Co(OH)2] | φθ(ClO—/Cl—) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
2022-02-22更新
|
2297次组卷
|
14卷引用:辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题
辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题辽宁省大连市第二十四中学2023-2024学年高一上学期第二次统测化学试卷 河南省信阳市2022届高三第二次质量检测化学试题(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题广东省广州市真光中学2022-2023学年高一上学期期中考化学试题湖南省株洲市九方中学2022-2023学年高一上学期期中考试化学试题河北省衡水中学2023届高三上学期三调考试化学试题 浙江省杭州第十四中学2023-2024学年高一上学期期中阶段性测试化学试题
名校
解题方法
8 . 纳米级四氧化三铁是应用最为广泛的软磁性材料之一。 共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图所示:
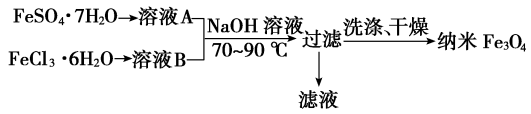
下列说法错误的是

下列说法错误的是
| A.该制备反应类型不属于氧化还原反应 |
| B.共沉淀法中FeSO4·7H2O和FeCl3·6H2O的物质的量之比最好应为1:2 |
| C.若滤液进行焰色反应,火焰为黄色则说明氢氧化钠过量了 |
D.另一种水热法制备Fe3O4纳米颗粒的反应3Fe2++2S2O +O2+xOH-=Fe3O4↓+S4O +O2+xOH-=Fe3O4↓+S4O +2H2O每消耗3 molOH-,则有1.5 mol Fe2+被氧化 +2H2O每消耗3 molOH-,则有1.5 mol Fe2+被氧化 |
您最近一年使用:0次
2022-01-23更新
|
1011次组卷
|
6卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
9 . 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
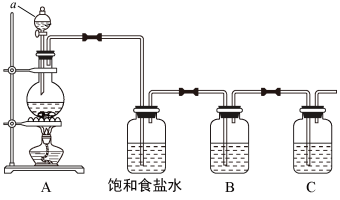
(1)仪器a的名称为___________
(2)请写出A装置中发生反应的化学方程式___________ 。
(3)饱和食盐水的作用是___________ 。
(4)装置B中盛放的试剂是___________ (选填下列所给试剂的编号),反应离子方程式是___________ 。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
(5)还有哪些事实能够说明氯元素的非金属性比疏元素的非金属性强___________ (填编号)
① 比
比 稳定
稳定
② 氧化性比
氧化性比 强
强
③ 酸性比
酸性比 强
强
④ 酸性比
酸性比 强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥ 与铁反应生成
与铁反应生成 ,而S与铁反应生成
,而S与铁反应生成

(1)仪器a的名称为
(2)请写出A装置中发生反应的化学方程式
(3)饱和食盐水的作用是
(4)装置B中盛放的试剂是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液(5)还有哪些事实能够说明氯元素的非金属性比疏元素的非金属性强
①
 比
比 稳定
稳定 ②
 氧化性比
氧化性比 强
强 ③
 酸性比
酸性比 强
强④
 酸性比
酸性比 强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子⑥
 与铁反应生成
与铁反应生成 ,而S与铁反应生成
,而S与铁反应生成
您最近一年使用:0次
解题方法
10 . 某钴矿石的主要成分有 、
、 、
、 、
、 、
、 和
和 等。由该矿石粉制备
等。由该矿石粉制备 固体的方法如图(部分催化剂已略)。
固体的方法如图(部分催化剂已略)。
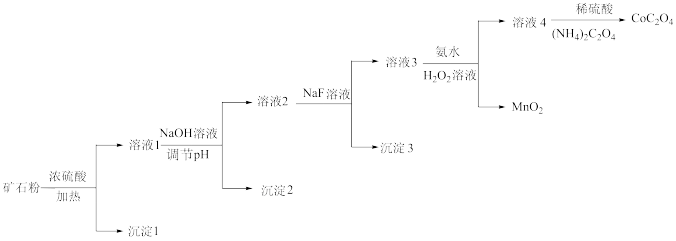
已知:金属离子沉淀的 :
:
(1) 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
(2)向溶液1中加入 溶液,将
溶液,将 转化为
转化为 沉淀,应调节
沉淀,应调节 至少大于
至少大于_______ 。
(3)向溶液2中加入 溶液,去除的离子是
溶液,去除的离子是_______ 。
(4)向溶液3中加入氨水和过氧化氢溶液,将 转化为
转化为 。该反应的离子方程式为:
。该反应的离子方程式为:_______ 。
(5)溶液4中,若将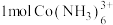 全部转化为
全部转化为 沉淀,需要消耗
沉淀,需要消耗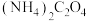
_______  。
。
(6)关于上述流程,下列说法正确的是_______ (填序号)。
a.若矿石粉中存在少量 ,经上述流程也可制得纯度相同的
,经上述流程也可制得纯度相同的
b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
 、
、 、
、 、
、 、
、 和
和 等。由该矿石粉制备
等。由该矿石粉制备 固体的方法如图(部分催化剂已略)。
固体的方法如图(部分催化剂已略)。
已知:金属离子沉淀的
 :
: |  |  |  |  | |
| 开始沉淀时 | 1.5 | 6.3 | 8.9 | 8.2 | 7.4 |
| 完全沉淀时 | 2.8 | 8.3 | 10.9 | 10.2 | 9.4 |
 原子的核外电子排布式为
原子的核外电子排布式为(2)向溶液1中加入
 溶液,将
溶液,将 转化为
转化为 沉淀,应调节
沉淀,应调节 至少大于
至少大于(3)向溶液2中加入
 溶液,去除的离子是
溶液,去除的离子是(4)向溶液3中加入氨水和过氧化氢溶液,将
 转化为
转化为 。该反应的离子方程式为:
。该反应的离子方程式为:(5)溶液4中,若将
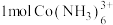 全部转化为
全部转化为 沉淀,需要消耗
沉淀,需要消耗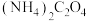
 。
。(6)关于上述流程,下列说法正确的是
a.若矿石粉中存在少量
 ,经上述流程也可制得纯度相同的
,经上述流程也可制得纯度相同的
b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
您最近一年使用:0次



