1 . Ⅰ、下表为元素周期表的一部分,请回答有关问题
(1)①和②的简单气态氢化物的稳定性较弱的是___________ (填化学式)。②和③形成的一种化合物为淡黄色固体,该化合物的电子式为___________ 。
(2)元素③、④、⑤的离子半径由大到小的顺序为___________ (填离子符号)。
(3)写出实验室制取⑤单质的化学方程式___________ 。
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
(4)元素X在周期表中的位置是___________ 。
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式___________ 。
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式___________ 。
(7)下列说法能够证明Y的金属性比Z强的是___________ 。
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ |
(2)元素③、④、⑤的离子半径由大到小的顺序为
(3)写出实验室制取⑤单质的化学方程式
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 元素的最高正价与最低负价的代数和为6 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式
(7)下列说法能够证明Y的金属性比Z强的是
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
您最近一年使用:0次
2 . 高铁酸钾(K2FeO4)是新型高效净水剂,某实验小组制备K2FeO4并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为_______ 。
②请在B方框内将除杂装置补充完整,并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中主要反应的化学方程式为_______ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
由方案Ⅰ中溶液变红可知a中含有的离子为_______ ,但该离子的产生不能判断一定是由Cl-还原K2FeO4得到的,该离子还可能由_______ 产生(用离子方程式表示)。
②根据K2FeO4的制备实验得出:氧化性Cl2_______  (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为
②请在B方框内将除杂装置补充完整,并标明所用试剂
③C中得到紫色固体和溶液。C中主要反应的化学方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
3 . 次磷酸钙[Ca(H2PO2)2,该化合物中H是+1价,O是-2价]可用作阻燃剂,食品添加剂和动物营养剂,制备次磷酸钙的反应化学方程式为:Ca(OH)2+P4+H2O→Ca(H2PO2)2+PH3↑(未配平),下列说法错误的是
| A.Ca(H2PO2)2为氧化产物 |
| B.氧化剂与还原剂物质的量之比为1:3 |
| C.生成1molPH3消耗31gP4 |
| D.次磷酸钙具有还原性 |
您最近一年使用:0次
2021-01-15更新
|
261次组卷
|
2卷引用:辽宁省丹东市2020-2021学年高一上学期期末考试化学试题
4 . 钨冶炼渣主要含锰、铁、钙、镁、硅的氧化物及少量重金属盐。工业上利用钨冶炼渣制备电池级硫酸锰(含MnSO4的质量分数98%以上)的工艺如图所示。
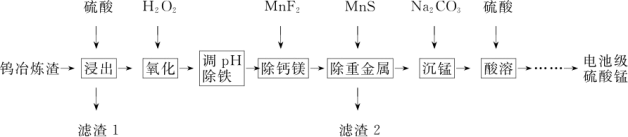
回答下列问题:
(1)为提高钨冶炼渣的浸出速率,可采用的方法有___________ (写出2种)。“滤渣 1”的主要成分是___________ 。
(2)写出“氧化”步骤的离子方程式___________ 。
(3)“调 pH除铁”步骤中的最优试剂是___________ 。
A.H2SO4 B.CO2 C.NaOH D.MnCO3
(4)为使Ca2+和 Mg2+完全沉淀,除去钙镁后的溶液中c(F-)应不低于___________ mol/L。[已知:Ksp(CaF2)=1.6×10-10,Ksp(MgF2)=9×10-11]。
(5)“沉锰”步骤的化学方程式为___________ 。

回答下列问题:
(1)为提高钨冶炼渣的浸出速率,可采用的方法有
(2)写出“氧化”步骤的离子方程式
(3)“调 pH除铁”步骤中的最优试剂是
A.H2SO4 B.CO2 C.NaOH D.MnCO3
(4)为使Ca2+和 Mg2+完全沉淀,除去钙镁后的溶液中c(F-)应不低于
(5)“沉锰”步骤的化学方程式为
您最近一年使用:0次
2021-01-14更新
|
283次组卷
|
4卷引用:辽宁省2020-2021学年高二上学期期末考试化学试题
5 . 过氧化氢的水溶液俗称双氧水,它的用途很广泛,常用于消毒、杀菌、漂白等。回答下列问题:
(1)过氧化氢的性质
①酸性条件下H2O2可将Fe2+转化成Fe3+,说明H2O2具有__ 性。
②常温下,H2O2显弱酸性(Ka1=2.40×10-12、Ka2=1.05×10-25),不能使甲基橙指示剂褪色,则向4.0mol•L-1的H2O2溶液中滴加甲基橙,溶液显__ 色。(甲基橙在pH小于3.1时显红色,3.1~4.4时显橙色,大于4.4时显黄色)
(2)过氧化氢含量的测定实验
某兴趣小组同学用0.1mol•L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定达到终点的现象是__ 。
②用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表:
试样中过氧化氢的浓度为__ mol•L-1。
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上。实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛(HCHO)溶液依次加入质量分数为30%~70%的过氧化氢溶液中。该反应的化学方程式为__ 。
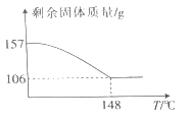
(4)过氧化氢与碳酸钠的加合物Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白。现称取157gNa2CO3•xH2O2晶体加热,实验结果如图所示,则该晶体的组成为__ (x精确到0.1)
(1)过氧化氢的性质
①酸性条件下H2O2可将Fe2+转化成Fe3+,说明H2O2具有
②常温下,H2O2显弱酸性(Ka1=2.40×10-12、Ka2=1.05×10-25),不能使甲基橙指示剂褪色,则向4.0mol•L-1的H2O2溶液中滴加甲基橙,溶液显
(2)过氧化氢含量的测定实验
某兴趣小组同学用0.1mol•L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO
 +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。①滴定达到终点的现象是
②用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(酸性KMnO4标准溶液)/mL | 17.10 | 18.10 | 18.00 | 17.90 |
试样中过氧化氢的浓度为
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上。实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛(HCHO)溶液依次加入质量分数为30%~70%的过氧化氢溶液中。该反应的化学方程式为
(4)过氧化氢与碳酸钠的加合物Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白。现称取157gNa2CO3•xH2O2晶体加热,实验结果如图所示,则该晶体的组成为

您最近一年使用:0次
解题方法
6 . 过氧化氢法制备亚氯酸钠(NaClO2)的流程如图1:
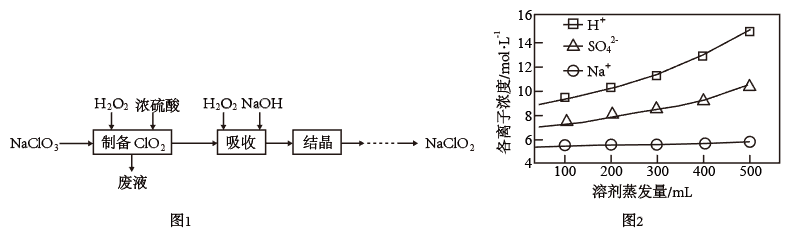
已知:①NaClO2常温下稳定,潮湿的NaClO2加热到130℃分解。
②ClO2气体在碱性溶液中会转化为ClO 和ClO
和ClO 。
。
(1)制备ClO2气体的化学方程式为_______ 。
(2)取1L废液,蒸发结晶,测定不同蒸发量下,残留液中各离子的浓度如图2,则析出的晶体为_______ (填化学式)。
(3)吸收时的主要反应为2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O。
①吸收时,需控制反应温度为3℃,可采取的措施为_______ 。
②温度过高,产品的纯度会降低,主要原因是_______ 。
(4)从NaClO2溶液获得产品的可行措施有_______ (填序号)。
a.减压蒸发 b.溶液雾状喷出干燥 c.300℃热空气烘干
(5)准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知ClO +4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O =2I-+S4O
=2I-+S4O ),该样品中NaClO2的纯度为
),该样品中NaClO2的纯度为_______ (用含m、c、V的代数式表示)。

已知:①NaClO2常温下稳定,潮湿的NaClO2加热到130℃分解。
②ClO2气体在碱性溶液中会转化为ClO
 和ClO
和ClO 。
。(1)制备ClO2气体的化学方程式为
(2)取1L废液,蒸发结晶,测定不同蒸发量下,残留液中各离子的浓度如图2,则析出的晶体为
(3)吸收时的主要反应为2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O。
①吸收时,需控制反应温度为3℃,可采取的措施为
②温度过高,产品的纯度会降低,主要原因是
(4)从NaClO2溶液获得产品的可行措施有
a.减压蒸发 b.溶液雾状喷出干燥 c.300℃热空气烘干
(5)准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知ClO
 +4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O =2I-+S4O
=2I-+S4O ),该样品中NaClO2的纯度为
),该样品中NaClO2的纯度为
您最近一年使用:0次
名校
解题方法
7 . 铬是人体必需的微量元素,对维持人体正常的生理功能有着重要的作用。铬是胰岛素不可缺少的辅助成分,它参与糖代谢过程,能够促进脂肪和蛋白质的合成,对于人体的生长发育起着积极的促进作用。虽然铬对维护人体健康有着十分重要的作用,但食用不当也会带来很大的危害。由于无机铬很不容易被人体所吸收,铬只有以有机化合物的形式进入人体内才能被吸收。而在铬的化合物中,六价铬具有很强的毒性,尤以铬酸盐和重铬酸盐的毒性最为突出。
(1)铬原子的基态电子排布式为_______ 。
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为_______ ;
②CS2属于_______ (填极性”或“非极性”)分子,其电子式为_______ ;
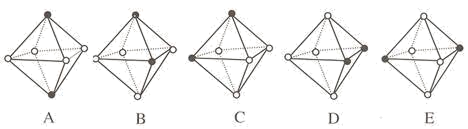
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665gCrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为_______ (填化学式)。下列是暗绿色晶体配离子的空间结构(中心原子位于正八面体的中心,已省去),其中B与_______ 具有完全相同的结构。(填字母)
(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III),调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以Cr2O 存在。试写出在酸性条件下硫酸亚铁还原Cr2O
存在。试写出在酸性条件下硫酸亚铁还原Cr2O 的离子方程式并配平
的离子方程式并配平_______ 。
②根据上述结果可确定铁氧磁体中x=_______ 。
(1)铬原子的基态电子排布式为
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为
②CS2属于
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665gCrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为

(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III),调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以Cr2O
 存在。试写出在酸性条件下硫酸亚铁还原Cr2O
存在。试写出在酸性条件下硫酸亚铁还原Cr2O 的离子方程式并配平
的离子方程式并配平②根据上述结果可确定铁氧磁体中x=
您最近一年使用:0次
2021-01-09更新
|
379次组卷
|
2卷引用:辽宁省五校2021届高三上学期期末联考化学试题
8 . 磷酸亚铁锂是锂离子电池中常用的正极材料, (磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、
(磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、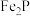 及
及 )制备
)制备 的工艺流程如下:
的工艺流程如下:
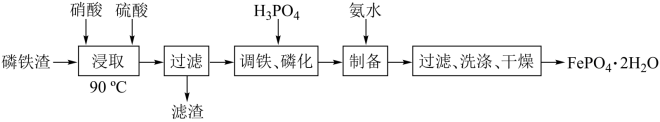
已知 溶于强酸。
溶于强酸。
(1)锂在元素周期表中的位置为___________ 。 的电离方程式为
的电离方程式为___________ 。
(2)“浸取”时,在密闭反应器中依次加入硝酸、硫酸,硝酸首先分解生成 和
和 ,
, 将铁和磷分别氧化为
将铁和磷分别氧化为 、
、 。
。
①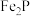 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②加入硫酸的目的是___________ 。
(3)“制备”时发生反应的离子方程式为___________ ;上述流程制得的 中含有的杂质是
中含有的杂质是___________ 。
(4) 与
与 及C在高温条件下生成
及C在高温条件下生成 和等物质的量的
和等物质的量的 、CO,该反应中还原剂与氧化剂的物质的量之比为
、CO,该反应中还原剂与氧化剂的物质的量之比为___________ 。
 (磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、
(磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、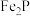 及
及 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知
 溶于强酸。
溶于强酸。(1)锂在元素周期表中的位置为
 的电离方程式为
的电离方程式为(2)“浸取”时,在密闭反应器中依次加入硝酸、硫酸,硝酸首先分解生成
 和
和 ,
, 将铁和磷分别氧化为
将铁和磷分别氧化为 、
、 。
。①
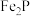 与
与 反应的化学方程式为
反应的化学方程式为②加入硫酸的目的是
(3)“制备”时发生反应的离子方程式为
 中含有的杂质是
中含有的杂质是(4)
 与
与 及C在高温条件下生成
及C在高温条件下生成 和等物质的量的
和等物质的量的 、CO,该反应中还原剂与氧化剂的物质的量之比为
、CO,该反应中还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
解题方法
9 . 中国传统绘画颜料迄今已有七千多年的历史,如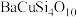 (中国蓝)、
(中国蓝)、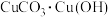 2(石绿),
2(石绿), (绛矾)、
(绛矾)、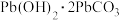 (铅白)等。下列说法错误的是
(铅白)等。下列说法错误的是
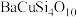 (中国蓝)、
(中国蓝)、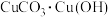 2(石绿),
2(石绿), (绛矾)、
(绛矾)、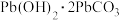 (铅白)等。下列说法错误的是
(铅白)等。下列说法错误的是A.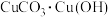 2难溶于水和强酸 2难溶于水和强酸 |
B.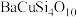 属于硅酸盐 属于硅酸盐 |
C.青矾 有“烧之赤色,故名绛矾矣”,该过程中发生了氧化还原反应 有“烧之赤色,故名绛矾矣”,该过程中发生了氧化还原反应 |
D. 修复发黑(PbS)的铅白绘画的原理为 修复发黑(PbS)的铅白绘画的原理为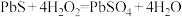 |
您最近一年使用:0次
2021-01-08更新
|
338次组卷
|
3卷引用:辽宁省辽阳市2021届高三上学期期末考试化学试题
名校
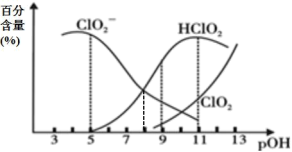
10 . 亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、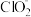 、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
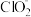 、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
A.HClO2的电离平衡常数的数值Ka=1 10-8 10-8 |
B.pOH=11时,ClO 部分转化成ClO2和Cl-离子的方程式为:5ClO 部分转化成ClO2和Cl-离子的方程式为:5ClO +2H2O=4ClO2+Cl-+4OH- +2H2O=4ClO2+Cl-+4OH- |
| C.ClO2与SO2混合后,气体漂白纸浆效果更好 |
| D.同浓度HClO2溶液和NaClO2溶液等体积混合(不考虑ClO2和Cl-),则混合溶液中有:c(Na+)+c(OH-)=c(H+)+c(HClO2) |
您最近一年使用:0次
2021-01-05更新
|
822次组卷
|
4卷引用:辽宁省沈阳市第二中学2021-2022学年高二上学期期末考试化学试题



