1 . Ⅰ、下表为元素周期表的一部分,请回答有关问题
(1)①和②的简单气态氢化物的稳定性较弱的是___________ (填化学式)。②和③形成的一种化合物为淡黄色固体,该化合物的电子式为___________ 。
(2)元素③、④、⑤的离子半径由大到小的顺序为___________ (填离子符号)。
(3)写出实验室制取⑤单质的化学方程式___________ 。
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
(4)元素X在周期表中的位置是___________ 。
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式___________ 。
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式___________ 。
(7)下列说法能够证明Y的金属性比Z强的是___________ 。
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ |
(2)元素③、④、⑤的离子半径由大到小的顺序为
(3)写出实验室制取⑤单质的化学方程式
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 元素的最高正价与最低负价的代数和为6 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式
(7)下列说法能够证明Y的金属性比Z强的是
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
您最近一年使用:0次
名校
解题方法
2 . 在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析下列一组有现象变化的化学反应。
(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:_______ 。
(2)Ⅲ中加碱时出现的现象是_______ 。
(3)Ⅳ中加酸时出现的现象是_______ ,用离子方程式解释产生此现象的原因:_______ 。
(4)滴加试剂顺序的变化会影响溶液中的现象和发生的反应。请继续分析以下实验。
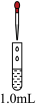
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0mL0.1mol·L-1Fe(NO3)2溶液中_______ ,如果溶液变红色,说明溶液中含有Fe3+,证明加酸时溶液中发生了反应。(请将上述操作补充完整)
②推测溶液中产生Fe3+的可能原因有两种:
a._______ 。
b._______ 。
| 实验及操作 | 现象 | ||
| 装置 | 试管 | 滴管 | |
 | 饱和Na2SiO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol·L-1NaOH溶液;再滴加1.5mL1.0mol·L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol·L-1AlCl3溶液 | Ⅱ.加碱时_______;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol·L-1Fe(NO3)2溶液 | Ⅲ.加碱时_______;加酸后得到棕黄色溶液 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后_______ | ||
(2)Ⅲ中加碱时出现的现象是
(3)Ⅳ中加酸时出现的现象是
(4)滴加试剂顺序的变化会影响溶液中的现象和发生的反应。请继续分析以下实验。
| 实验及操作 | 现象 | ||
| 装置 | 试管 | 滴管 | |
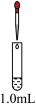 | 0.1mol·L-1Fe(NO3)2溶液 | 先滴加1.5mL1.0mol·L-1H2SO4溶液;再滴加1.0mL0.5mol·L-1NaOH溶液 | Ⅴ.加酸时溶液有明显现象;加碱后溶液依然没有明显变化 |
②推测溶液中产生Fe3+的可能原因有两种:
a.
b.
您最近一年使用:0次
3 . 硫酸氧钒(VOSO4)对高血糖、高血脂有治疗作用,也是钒电池不可或缺的电解质。制备 的实验流程如下:
的实验流程如下:
①向仪器a中加入 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;
②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到 溶液(蓝黑色);
溶液(蓝黑色);
③ 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。
实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是_______ ,用仪器b滴加浓硫酸时,_______ (填“需要”或“不需要”)打开上端的玻璃塞。
(2)反应中最适宜的加热方式为_______ ,在a中反应生成
_______ (“是”或“不是”)氧化还原反应。
(3)反应液由橙红色变为蓝黑色的化学方程式为_______ 。
(4)纯度测定:准确称取 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用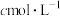 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为_______ %。
(5)性质探究:查阅资料后,有同学对 的热分解提出了两种猜想:
的热分解提出了两种猜想:
猜想ⅰ. ;
;
猜想ⅱ.
欲采用如下装置探究:
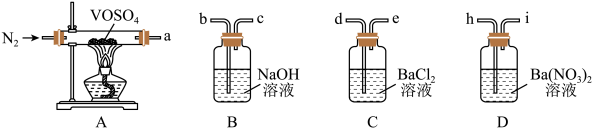
选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→_______ ;若气体流经的装置均有气泡产生,则上述所选必要装置中可观察的现象为_______ ,证明猜想ⅱ正确。
 的实验流程如下:
的实验流程如下:①向仪器a中加入
 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到
 溶液(蓝黑色);
溶液(蓝黑色);③
 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是
(2)反应中最适宜的加热方式为

(3)反应液由橙红色变为蓝黑色的化学方程式为
(4)纯度测定:准确称取
 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用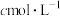 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为(5)性质探究:查阅资料后,有同学对
 的热分解提出了两种猜想:
的热分解提出了两种猜想:猜想ⅰ.
 ;
;猜想ⅱ.

欲采用如下装置探究:

选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→
您最近一年使用:0次
2023-02-08更新
|
311次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高三上学期1月期末化学试题
解题方法
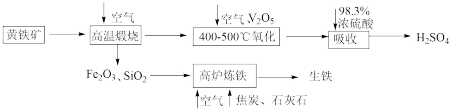
4 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为主要原料制备硫酸的工艺流程如下图所示:
回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是_______ ;煅烧时发生反应的化学方程式为_______ 。
(2)“氧化”时,发生反应的化学方程式为_______ 。
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是_______ 。
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:_______ ;若投入Fe2O3的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中Fe2O3的转化率为_______ 。

回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是
(2)“氧化”时,发生反应的化学方程式为
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:
您最近一年使用:0次
2022-07-12更新
|
313次组卷
|
2卷引用:辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题
5 . 高铁酸钾(K2FeO4)是新型高效净水剂,某实验小组制备K2FeO4并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为_______ 。
②请在B方框内将除杂装置补充完整,并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中主要反应的化学方程式为_______ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
由方案Ⅰ中溶液变红可知a中含有的离子为_______ ,但该离子的产生不能判断一定是由Cl-还原K2FeO4得到的,该离子还可能由_______ 产生(用离子方程式表示)。
②根据K2FeO4的制备实验得出:氧化性Cl2_______  (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为
②请在B方框内将除杂装置补充完整,并标明所用试剂
③C中得到紫色固体和溶液。C中主要反应的化学方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
6 . 现有部分元素的性质与原子(或分子)结构如下表:
请根据表中信息回答下列问题
(1)元素T在周期表中位于第_____ 周期第_____ 族
(2)元素T与X相比,原子半径较大的是________ (用元素符号表示);
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为_________ 该化合物与水反应方程式:_____________________
(4)元素Y与元素Z相比,金属性较强的是________ (用元素符号表示);
下列表述中能证明这一事实的是________ (填序号)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:____________________________________________ 。
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
(1)元素T在周期表中位于第
(2)元素T与X相比,原子半径较大的是
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为
(4)元素Y与元素Z相比,金属性较强的是
下列表述中能证明这一事实的是
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:
您最近一年使用:0次
7 . 水热法制备 纳米颗粒的反应如下(反应条件忽略):
纳米颗粒的反应如下(反应条件忽略):
 。下列说法错误的是
。下列说法错误的是
 纳米颗粒的反应如下(反应条件忽略):
纳米颗粒的反应如下(反应条件忽略):
 。下列说法错误的是
。下列说法错误的是A.该反应中 作氧化剂 作氧化剂 | B.该反应中 和 和 都是还原剂 都是还原剂 |
C.3个 参加反应时有1个 参加反应时有1个 被氧化 被氧化 | D.离子方程式中 |
您最近一年使用:0次
名校
解题方法
8 . 从干海带中提取碘的实验流程如下:
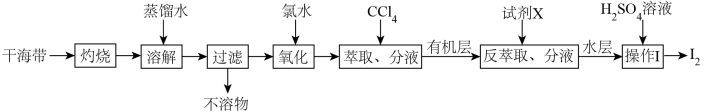
| A.氧化步骤中氯水可用过氧化氢代替 |
B.试剂X可以为 ,反萃取的离子方程式为: ,反萃取的离子方程式为: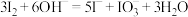 |
C. 可循环利用以有效提高干海带提碘的产率 可循环利用以有效提高干海带提碘的产率 |
| D.操作Ⅰ要用到普通漏斗、烧杯和玻璃棒 |
您最近一年使用:0次
2024-01-28更新
|
568次组卷
|
4卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
9 . 氮氧化物(NOx)会对生态系统和人体健康造成危害。一种以沸石笼作为载体对NOₓ进行催化还原的原理如图所示。下列说法错误的是
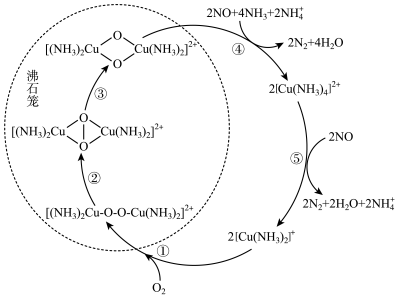
| A.反应①每消耗lmolO2, 转移 2mol电子 |
| B.反应⑤中[Cu(NH3)4]2+作还原剂 |
| C.反应④有σ键和π键的形成 |
D.脱除NO 的总反应可表示为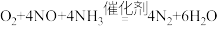 |
您最近一年使用:0次
2023-10-19更新
|
287次组卷
|
4卷引用:辽宁省沈阳市辽中区第一私立高级中学2023-2024学年高二上学期1月期末化学试题
10 . 以黄铁矿(主要成分为 ,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
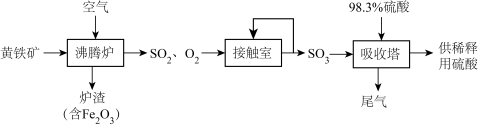
 ,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
| A.将黄铁矿粉碎,可加快其在沸腾炉中的化学反应速率 |
B.沸腾炉中发生反应的化学方程式为: |
C.接触室中排放出的 、 、 循环利用,可提高原料利用率 循环利用,可提高原料利用率 |
D.依据上述流程,当最终生成 时,共转移 时,共转移 电子 电子 |
您最近一年使用:0次



