1 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,发生_____ (填“氧化”或“还原”)反应,则该反应的还原剂是________ 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为____ 。
(3)根据上述反应可推知________ (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_____________
 +
+
(1)已知KBrO3在反应中得到电子,发生
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为
(3)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。
 +
+
您最近一年使用:0次
名校
2 . 铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是______________ ,区别该液体和FeCl3溶液的方法是______________ 。
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,氧化产物为
Fe3O4+6SO2,氧化产物为________ ,若有3mol FeS2参加反应,转移________ mol电子。
(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
___ FeSO4+____ KNO3+___ H2SO4═____ K2SO4+_____ Fe2(SO4)3+__ NO↑+_____ H2O。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________ g。
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
 Fe3O4+6SO2,氧化产物为
Fe3O4+6SO2,氧化产物为(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
您最近一年使用:0次
2020-04-27更新
|
279次组卷
|
2卷引用:辽宁省丹东市2017-2018学年高一上学期期末质量监测化学试题
解题方法
3 . 某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是


| A.当有3molClO-参加反应时,则有1molN2生成 |
| B.HCO3-作为碱性介质参与反应 |
| C.当有5molClO-参加反应时,则有1molN2生成 |
| D.若生成2.24LN2,则转移电子0.6mol |
您最近一年使用:0次
4 . 黄铁矿(FeS2)中-1价硫元素在酸性条件下可以与ClO3-发生反应,其离子方程式如下
_____ ClO3-+_____ FeS2+_____H+=_____ClO2↑+_____Fe3++_____ SO42-+_____H2O(未配平):下列说法正确的是
_____ ClO3-+_____ FeS2+_____H+=_____ClO2↑+_____Fe3++_____ SO42-+_____H2O(未配平):下列说法正确的是
| A. ClO3-是氧化剂,Fe3+是还原产物 |
| B. ClO3-的氧化性强于Fe3+ |
| C.生成l mol SO42-时,转移7mol 电子 |
| D.取反应后的溶液加KSCN溶液,可观察到有红色沉淀产生 |
您最近一年使用:0次
2020-02-20更新
|
469次组卷
|
3卷引用:辽宁师范大学附属中学2017-2018学年高一上学期期末考试化学试题
辽宁师范大学附属中学2017-2018学年高一上学期期末考试化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的规律:先后律、强弱律【精编选择25题】(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
5 . 铁是应用最广泛的金属,铁的卤化物,氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)铁元素在周期表中的位置为_______ 。
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=_____ 。
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为_____ 。
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为________ 。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_______ 。
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式__________ 。
(1)铁元素在周期表中的位置为
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式
您最近一年使用:0次
名校
解题方法
6 . 硫元素的几种化合物存在下列转化关系:
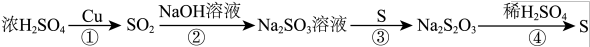
下列判断正确的是
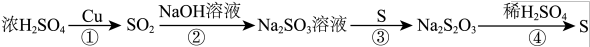
下列判断正确的是
| A.反应①中生成的SO2具有还原性,故可作漂白剂 |
| B.反应④中当消耗1mol稀硫酸时,电子转移为6mol |
| C.可以用CS2清洗做过实验③后附着在试管壁上的硫 |
| D.反应④生成S的原子利用率是100% |
您最近一年使用:0次
2020-02-05更新
|
164次组卷
|
2卷引用:辽宁省丹东市2019—2020学年高三上学期期末考试理综化学试题
7 . 钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
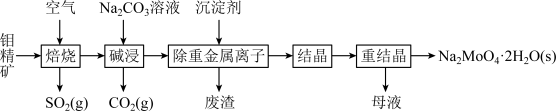
(1)提高焙烧效率的方法有:_____________ (写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________ 。氧化产物是________________ 。
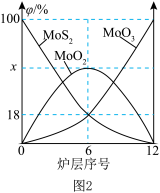
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________ 。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________ 。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为______________________ 。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________ 。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕

(1)提高焙烧效率的方法有:
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是

(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度
您最近一年使用:0次
2020-01-13更新
|
790次组卷
|
7卷引用:辽宁省协作校2021-2022高三上学期期末考试化学试题
名校
解题方法
8 . 一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
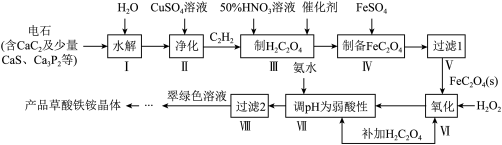
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________ ,硝酸的浓度及反应温度都不宜过高,是因为____________ .
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________ .
(6)步骤VIII由滤液制得产品的操作为____________ 、____________ 、过滤、洗涤、干燥。

回答下列问题:
(1)CaC2的电子式为
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是
(5)步骤Ⅵ、VII补加草酸的目的是
(6)步骤VIII由滤液制得产品的操作为
您最近一年使用:0次
2020-01-09更新
|
333次组卷
|
3卷引用:辽宁省辽阳市2020届高三上学期期末考试化学试题
名校
解题方法
9 . 从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是______________ (用离子方程式表示)。
(2)向FeSO4溶液中滴加氨水的现象为______________________ ,请用化学用语解释出现此现象的原因___________________ ;_____________________
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:____ Fe2+____ NO3-+____ H+ = ___ Fe3++____ NO↑+_____ H2O(在横线上写上化学计量数)
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为_______
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________ 。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________ L。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是
(2)向FeSO4溶液中滴加氨水的现象为
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)
您最近一年使用:0次
2020-01-08更新
|
186次组卷
|
2卷引用:辽宁省锦州市滨海实验中学2019-2020学年高一上学期期末考试化学试题(2019新人教版)
13-14高三上·福建厦门·阶段练习
名校
解题方法
10 . 氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种“反应物”在40~50 ℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。下列有关推断中错误的是( )
| A.这里的"另一种反应物"具有还原性 | B.CuH可作氧化剂、还原剂 |
C.CuH+Cl2 CuCl+HCl(燃烧) CuCl+HCl(燃烧) | D.CuH+HCl CuCl+H2↑(常温) CuCl+H2↑(常温) |
您最近一年使用:0次
2020-01-01更新
|
75次组卷
|
14卷引用:2016届辽宁省大石桥市第二高级中学高三上期末化学试卷
2016届辽宁省大石桥市第二高级中学高三上期末化学试卷(已下线)2014届福建省厦门外国语学校高三上学期第一次月考化学试卷2015届山东省枣庄市六中高三下学期开学初检测试题理综化学试卷2015-2016学年山东省济宁市微山一中高一上12月阶段测化学试卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第4讲 用途广泛的金属材料及开发利用金属矿物【押题专练】【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题甘肃省武威市第一中学2019届高三上学期10月月考化学试题湖南省浏阳市六校联考2019届高三上学期期中考试化学试题河北唐山市区县联考2020届高三上学期第一次段考化学试题(已下线)考点07 元素化合物综合——《备战2020年高考精选考点专项突破题集》湖南省衡阳县三中2019-2020学年高一上学期期中考试化学试题(已下线)专题3.4 金属材料及金属矿物的开发利用(练)——2020年高考化学一轮复习讲练测安徽省六安市舒城中学2020-2021学年高一上学期第四次月考(12月)化学试题山东省临沂临港经济开发区第一中学2023-2024学年高一上学期阶段检测化学试题



