解题方法
1 . 酸性或碱性溶液中铝均可与NO 发生氧化还原反应,转化关系如图:
发生氧化还原反应,转化关系如图:
已知:气体D和A溶液反应生成白色沉淀,气体D和F反应可生成盐。

请回答下列问题:
(1)写出铝在碱性条件下与NO 反应的离子方程式
反应的离子方程式_________ 。
(2)在酸性条件下,被还原的NO 与Al的物质的量之比是
与Al的物质的量之比是_______ 。
(3)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C和E都转化为无毒的气态单质,请写出D和C反应的化学方程式:____________ 。
 发生氧化还原反应,转化关系如图:
发生氧化还原反应,转化关系如图:已知:气体D和A溶液反应生成白色沉淀,气体D和F反应可生成盐。

请回答下列问题:
(1)写出铝在碱性条件下与NO
 反应的离子方程式
反应的离子方程式(2)在酸性条件下,被还原的NO
 与Al的物质的量之比是
与Al的物质的量之比是(3)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C和E都转化为无毒的气态单质,请写出D和C反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 二氧化氯(ClO2)是世界卫生组织(WHO)公认的新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。经大量实验研究表明,ClO2对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用,研究表明,ClO2在浓度低于100mg·L−1时不会对人体产生任何的影响。在“新冠”疫情防控中ClO2也被广泛的用于公共场所的消杀。下列关于ClO2的说法正确的是
| A.ClO2能用于消毒是因为它是氯的最高价氧化物 |
| B.在进行消毒作业时使用的ClO2溶液浓度越大越好 |
| C.ClO2杀菌力强,是一种比“84”性能更优越的消毒剂 |
| D.ClO2可与NaOH在一条件下发生反应,产物只有NaClO3和H2O |
您最近一年使用:0次
2020-06-06更新
|
506次组卷
|
6卷引用:辽宁省铁岭市调兵山市第二高级中学2019~2020学年高一下学期期末考试化学试题
辽宁省铁岭市调兵山市第二高级中学2019~2020学年高一下学期期末考试化学试题湖北省黄冈市罗田县第一中学2019-2020学年高一下学期期中考试化学试题荆、荆、襄、宜四地七校考试联盟2019-2020学年高一下学期期中联考化学试题(已下线)1.3.4 氧化还原反应方程式的配平-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)专题39 氯的氧化物、含氧酸及含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)第12讲 富集在海水中的元素——卤素(讲)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
3 . 高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程。
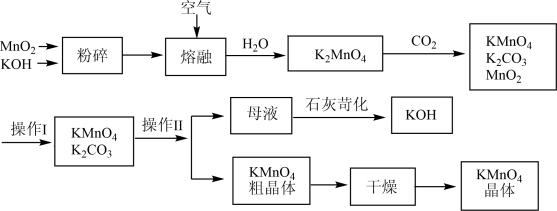
(1)上述流程中可以循环使用的物质有________ 、________ (写化学式)。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________ (填代号)。
a.84消毒液(NaClO溶液) b.75%酒精c.苯酚
(3)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________ molKMnO4。
(4)操作Ⅰ的名称是________ ;操作Ⅱ根据KMnO4和K2CO3两物质在________ (填性质)上的差异,采用________ (填操作步骤)、趁热过滤得到KMnO4粗晶体。

(1)上述流程中可以循环使用的物质有
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是
a.84消毒液(NaClO溶液) b.75%酒精c.苯酚
(3)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得
(4)操作Ⅰ的名称是
您最近一年使用:0次
2020-04-27更新
|
494次组卷
|
2卷引用:辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题
4 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,发生_____ (填“氧化”或“还原”)反应,则该反应的还原剂是________ 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为____ 。
(3)根据上述反应可推知________ (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_____________
 +
+
(1)已知KBrO3在反应中得到电子,发生
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为
(3)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。
 +
+
您最近一年使用:0次
名校
5 . 铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是______________ ,区别该液体和FeCl3溶液的方法是______________ 。
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,氧化产物为
Fe3O4+6SO2,氧化产物为________ ,若有3mol FeS2参加反应,转移________ mol电子。
(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
___ FeSO4+____ KNO3+___ H2SO4═____ K2SO4+_____ Fe2(SO4)3+__ NO↑+_____ H2O。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________ g。
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
 Fe3O4+6SO2,氧化产物为
Fe3O4+6SO2,氧化产物为(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
您最近一年使用:0次
2020-04-27更新
|
282次组卷
|
2卷引用:辽宁省丹东市2017-2018学年高一上学期期末质量监测化学试题
6 . 黄铁矿(FeS2)中-1价硫元素在酸性条件下可以与ClO3-发生反应,其离子方程式如下
_____ ClO3-+_____ FeS2+_____H+=_____ClO2↑+_____Fe3++_____ SO42-+_____H2O(未配平):下列说法正确的是
_____ ClO3-+_____ FeS2+_____H+=_____ClO2↑+_____Fe3++_____ SO42-+_____H2O(未配平):下列说法正确的是
| A. ClO3-是氧化剂,Fe3+是还原产物 |
| B. ClO3-的氧化性强于Fe3+ |
| C.生成l mol SO42-时,转移7mol 电子 |
| D.取反应后的溶液加KSCN溶液,可观察到有红色沉淀产生 |
您最近一年使用:0次
2020-02-20更新
|
569次组卷
|
3卷引用:辽宁师范大学附属中学2017-2018学年高一上学期期末考试化学试题
辽宁师范大学附属中学2017-2018学年高一上学期期末考试化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的规律:先后律、强弱律【精编选择25题】(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
7 . 铁是应用最广泛的金属,铁的卤化物,氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)铁元素在周期表中的位置为_______ 。
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=_____ 。
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为_____ 。
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为________ 。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_______ 。
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式__________ 。
(1)铁元素在周期表中的位置为
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式
您最近一年使用:0次
名校
解题方法
8 . 硫元素的几种化合物存在下列转化关系:
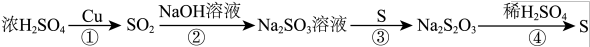
下列判断正确的是
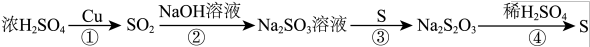
下列判断正确的是
| A.反应①中生成的SO2具有还原性,故可作漂白剂 |
| B.反应④中当消耗1mol稀硫酸时,电子转移为6mol |
| C.可以用CS2清洗做过实验③后附着在试管壁上的硫 |
| D.反应④生成S的原子利用率是100% |
您最近一年使用:0次
2020-02-05更新
|
170次组卷
|
2卷引用:辽宁省丹东市2019—2020学年高三上学期期末考试理综化学试题
9 . 钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
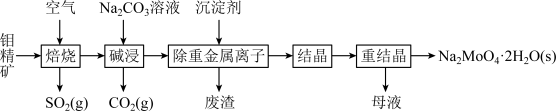
(1)提高焙烧效率的方法有:_____________ (写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________ 。氧化产物是________________ 。
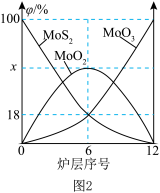
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________ 。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________ 。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为______________________ 。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________ 。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕

(1)提高焙烧效率的方法有:
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是

(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度
您最近一年使用:0次
2020-01-13更新
|
799次组卷
|
7卷引用:辽宁省协作校2021-2022高三上学期期末考试化学试题
名校
解题方法
10 . 一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
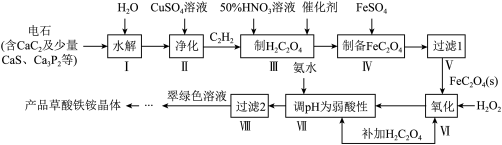
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________ ,硝酸的浓度及反应温度都不宜过高,是因为____________ .
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________ .
(6)步骤VIII由滤液制得产品的操作为____________ 、____________ 、过滤、洗涤、干燥。

回答下列问题:
(1)CaC2的电子式为
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是
(5)步骤Ⅵ、VII补加草酸的目的是
(6)步骤VIII由滤液制得产品的操作为
您最近一年使用:0次
2020-01-09更新
|
337次组卷
|
3卷引用:辽宁省辽阳市2020届高三上学期期末考试化学试题



