真题
名校
1 . 若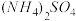 在强热时分解的产物是
在强热时分解的产物是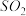 、
、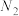 、
、 和
和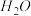 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为
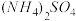 在强热时分解的产物是
在强热时分解的产物是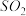 、
、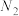 、
、 和
和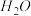 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
您最近一年使用:0次
2019-01-30更新
|
1495次组卷
|
28卷引用:2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷
(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011-2012学年四川省巴中市四县中高一上期期末联考化学试卷贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题河北省易县中学2018-2019学年高二下学期期末考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题云南省剑川县第一中学2019-2020学年高一上学期期末考试化学试题宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题2010年普通高等学校招生统一考试理综试题化学部分(全国卷II)(已下线)2011-2012学年云南省玉溪一中高二上学期期中考试化学(理)试卷(已下线)2011-2012年江西省吉安一中高一上学期期中考试化学试卷(已下线)2012届福建省厦门市翔安一中高三11月份月考化学试卷(已下线)2012届山东省济宁市鱼台二中高三11月月考化学试卷(已下线)2015届黑龙江省哈师大附中高三第一次月考化学试卷2015-2016学年河北省武邑中学高一下周考化学试卷甘肃省兰州市第一中学2018届高三8月月考化学试题山西省康杰中学2018届高三上学期第一次月考化学试卷【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题云南省昭通鲁甸县二中2019-2020学年高一10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2020届高三上学期第一次月考化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷2020届高三化学总复习考点强化练习:物质及其变化(已下线)【浙江新东方】36新疆新和县实验中学2020-2021学年高三上学期期中考试化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题黑龙江省大庆外国语学校2021-2022学年高一下学期开学考试化学试题微专题(三)——氧化还原反应方程式的配平与书写宁夏银川市唐徕中学2023-2024学年高三上学期9月月考化学试题
9-10高三·江西宜春·阶段练习
解题方法
2 . 有一未完成的离子方程式为:□□+XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为
| A.+7 | B.+4 | C.+5 | D.+1 |
您最近一年使用:0次
名校
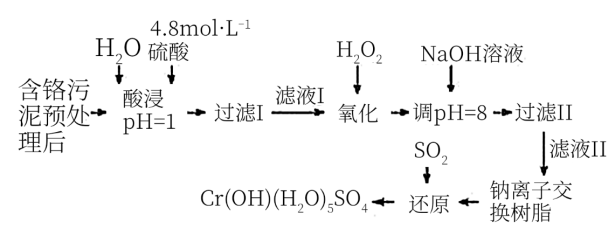
3 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸__ mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________ 。
(2)酸浸时,为了提高浸取率可采取的措施有____________________ 。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式_________________ 。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_______ ;但溶液的pH不能超过8,其理由是________________________ 。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____ 。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________ 。
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸
(2)酸浸时,为了提高浸取率可采取的措施有
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的ph | 2.7 | — | — | — |
| 沉淀完全时的ph | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:
您最近一年使用:0次
2019-01-09更新
|
262次组卷
|
4卷引用:辽宁省锦州市联合校2020届高三上学期期末考试化学试题
解题方法
4 . 铜的离子除了铜离子(Cu2+)外,自然界中还存在亚铜离子(Cu+)。Cu+在水溶液中没有Cu2+稳定,易在酸性条件下发生反应:2Cu+═Cu2++Cu。+1价铜的化合物通常是难溶物,如Cu2O、CuI、CuCl、Cu2S、等。
回答下列问题:
(1) 在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成难溶物的颜色为________ ;若继续加热,出现黑色物质,判断这种物质的化学式为________________ 。
(2) 在CuCl2溶液中滴加过量KI溶液,可发生如下反应:
a.2Cu2++4I-═2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2
为顺利观察到CuI、CuCl白色沉淀,可以加入下列试剂中的________ 。
A.乙醇 B.苯 C.盐酸溶液 D.NaCl溶液
(3) Cu2S在稀H2SO4酸化下与氧气反应生成CuSO4,该反应的化学方程式为________________________________ ;该反应的还原剂为________________ ,当1 mol O2发生反应时,还原剂所失电子的物质的量为________ mol,其中被S元素还原的O2的物质的量为________ mol。
回答下列问题:
(1) 在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成难溶物的颜色为
(2) 在CuCl2溶液中滴加过量KI溶液,可发生如下反应:
a.2Cu2++4I-═2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2
为顺利观察到CuI、CuCl白色沉淀,可以加入下列试剂中的
A.乙醇 B.苯 C.盐酸溶液 D.NaCl溶液
(3) Cu2S在稀H2SO4酸化下与氧气反应生成CuSO4,该反应的化学方程式为
您最近一年使用:0次
9-10高三·河南周口·阶段练习
名校
5 . 在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+ 2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol
④M为OH-⑤SnCl62-是氧化产物
①氧化剂是H3AsO3②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol
④M为OH-⑤SnCl62-是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.①③ |
您最近一年使用:0次
2018-03-09更新
|
245次组卷
|
7卷引用:2011-2012学年辽宁省实验中学分校高二下学期期末考试化学试卷
(已下线)2011-2012学年辽宁省实验中学分校高二下学期期末考试化学试卷(已下线)2010年河南省郸城县第一高级中学高三第二次月考化学试卷福建省厦门第一中学2016-2017学年高二下学期开学考试理综-化学试题2016-2017学年湖南省长沙市第一中学高二下学期第一次模块检测化学试卷河南省郑州市第一中学2017-2018学年高一下学期入学考试化学试题江西省吉安市吉水中学2019届高三10月月考化学试题江西省余干县新时代学校2020-2021学年高一上学期阶段测试(二)化学试题
名校
6 . I.(1)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备ClO2,化学方程式是_____________________________________ 。
(2)科学家又研究出了一种新的制备ClO2方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,该反应的离子方程式为_____________________________________ 。
II.向50mL0.018 mol·L-1的AgNO3溶液中加入50mL0.020 mol·L-1的盐酸,生成沉淀。如果AgCl的Ksp=l.0×10-10,试求:
(1)沉淀生成后溶液中c(Ag+)为_____________________ 。
(2)沉淀生成后溶液的pH是_____________________ 。
(2)科学家又研究出了一种新的制备ClO2方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,该反应的离子方程式为
II.向50mL0.018 mol·L-1的AgNO3溶液中加入50mL0.020 mol·L-1的盐酸,生成沉淀。如果AgCl的Ksp=l.0×10-10,试求:
(1)沉淀生成后溶液中c(Ag+)为
(2)沉淀生成后溶液的pH是
您最近一年使用:0次
名校
7 . 工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________ 。
(2)副产品A的化学式是_______ 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=____ 〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是_______ ;沉锰工序中判断沉淀已经洗涤干净的实验操作是______ 。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________ 。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:__FeS2+___MnO2+___=___Fe3++__Mn2++____SO42-+____,___________

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)
(2)副产品A的化学式是
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:__FeS2+___MnO2+___=___Fe3++__Mn2++____SO42-+____,
您最近一年使用:0次
2018-01-27更新
|
780次组卷
|
3卷引用:辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题
名校
8 . 水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子:NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
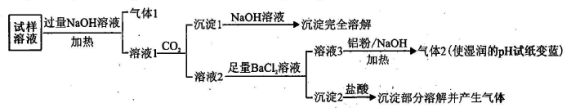
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1”的电子式为_________ 。
(2)生成“沉淀1”的离子方程式为________ 。
(3)“沉淀2”的成分是___________ (填化学式)。
(4)“溶液3→气体2”的离子方程式为_________ 。
(5)根据上述实验可推断该地区大气颗粒物中_________ 含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的污染主体如下表:
根据实验结果可判断该地区大气颗粒物污染主体有___________ 。

已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1”的电子式为
(2)生成“沉淀1”的离子方程式为
(3)“沉淀2”的成分是
(4)“溶液3→气体2”的离子方程式为
(5)根据上述实验可推断该地区大气颗粒物中
(6)已知大气颗粒物中各元素的污染主体如下表:
| 元素 | N | S | Na、Mg、Cl | Al | Ca |
| 污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
您最近一年使用:0次
2018-01-20更新
|
287次组卷
|
6卷引用:辽宁省大石桥2018届高三上学期期末质检化学试题
辽宁省大石桥2018届高三上学期期末质检化学试题福建省厦门市2018届高三上学期期末质检化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题18 以离子性质为基础的无机推断题【全国百强校】福建省厦门外国语学校2019届高三上学期第一次月考化学试题【全国百强校】江西省新余市第四中学2019届高三上学期10月月考化学试题【全国百强校】内蒙古自治区赤峰市第二中学2019届高三上学期第三次月考化学试题
9 . 用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如图所示:
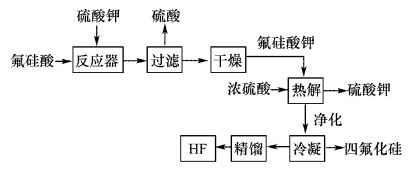
已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。
(1)写出反应器中的化学方程式:________________ 。
(2)在实验室过滤操作中所用的玻璃仪器有_____________ ,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:____________ 。
(3)该流程中哪些物质可以循环使用:_____________ 。(用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:__________________ 。

已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。
(1)写出反应器中的化学方程式:
(2)在实验室过滤操作中所用的玻璃仪器有
(3)该流程中哪些物质可以循环使用:
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:
您最近一年使用:0次
2018-01-20更新
|
184次组卷
|
2卷引用:辽宁省大连市2017-2018学年高一上学期期末考试化学试题
10 . 某废水中含有CN-和Cr2O72- 等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:

回答下列问题:
(1)步骤②中,CN- 被ClO-氧化为CNO-的离子方程式为____________ 。
(2)步骤③的反应的离子方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________ mol电子。
(3)含Cr 3+废水可以加入熟石灰进一步处理,目的是___________________ 。

回答下列问题:
(1)步骤②中,CN- 被ClO-氧化为CNO-的离子方程式为
(2)步骤③的反应的离子方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去
(3)含Cr 3+废水可以加入熟石灰进一步处理,目的是
您最近一年使用:0次
2018-01-20更新
|
212次组卷
|
2卷引用:辽宁省大连市2017-2018学年高一上学期期末考试化学试题



