解题方法
1 . 某含镁废弃物中主要含有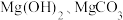 ,还含有少量的
,还含有少量的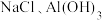 、
、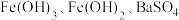 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:

已知:部分离子开始沉淀和完全沉淀的
回答下列问题:
(1)滤渣1的主要成分为_______ (填化学式),其阴离子空间构型为_______ 。
(2)“酸浸”时,发生反应的基本反应类型均为_______ ,所使用的稀盐酸的质量浓度为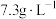 ,则其物质的量浓度为
,则其物质的量浓度为_______  。
。
(3)“氧化”时,反应的离子方程式为_______ 。
(4)“调 ”时,
”时, 的调节范围为
的调节范围为_______ (滤渣2中有两种氢氧化物)。
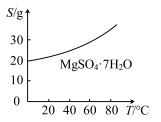
(5)已知 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括_______ 、过滤、洗涤、干燥。
(6)若测定 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
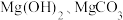 ,还含有少量的
,还含有少量的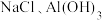 、
、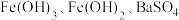 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:
已知:部分离子开始沉淀和完全沉淀的

| 氢氧化物 |  |  |  |
开始沉淀时的 | 4.0 | 8.4 | 1.9 |
完全沉淀时的 | 5.2 | 11.2 | 3.2 |
(1)滤渣1的主要成分为
(2)“酸浸”时,发生反应的基本反应类型均为
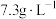 ,则其物质的量浓度为
,则其物质的量浓度为 。
。(3)“氧化”时,反应的离子方程式为
(4)“调
 ”时,
”时, 的调节范围为
的调节范围为(5)已知
 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括
(6)若测定
 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。| A | B | C | D |
 |  |  |  |
| 天平 | 坩埚 | 马弗炉(一种加热设备) | 分液漏斗 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-12更新
|
94次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
2 . 化学是一门实用性很强的科学,请根据题意填空:
(1)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装___________ (填“浓硫酸”或“浓盐酸”)。
(2)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是___________ (填化学式)。
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成一定条件下该反应的化学方程式:2NO+2CO 2CO2+
2CO2+__________ 。
(4)“厉害了,我的国”,2017年4月:“天舟一号”成功对接,12月:大型客机C919(如下图)第二次在上海浦东机场试飞成功,实现了我国航空领域的新突破。
请回答下列问题:

①铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是___________ (填字母序号)。
A.密度小 强度好 B.密度大 硬度大 C.熔点低 硬度小
②铝的金属活动性比铁的___________ (填“强”或“弱”),空气中,铝比铁具有更好的抗腐蚀性,原因是___________ (用化学反应方程式解释)。
③高温结构陶瓷可用于制造汽车发动机,通常所用的材料是氮化硅(Si3N4),该化合物中硅元素的化合价为___________ 。
(1)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装
(2)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成一定条件下该反应的化学方程式:2NO+2CO
 2CO2+
2CO2+(4)“厉害了,我的国”,2017年4月:“天舟一号”成功对接,12月:大型客机C919(如下图)第二次在上海浦东机场试飞成功,实现了我国航空领域的新突破。
请回答下列问题:

①铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是
A.密度小 强度好 B.密度大 硬度大 C.熔点低 硬度小
②铝的金属活动性比铁的
③高温结构陶瓷可用于制造汽车发动机,通常所用的材料是氮化硅(Si3N4),该化合物中硅元素的化合价为
您最近一年使用:0次
解题方法
3 . 氯元素的单质及其化合物在生产、生活中均有重要用途。请结合相关知识回答下列问题:
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式___________ ,使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因___________ 。
(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯( )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式___________ ,该反应中氧化剂与还原剂物质的量之比为___________ 。
(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应: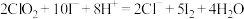 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: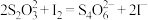 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:___________ 。
(4)实验室要配制1L 0.2 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:
①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为___________ (填序号),定容的具体操作是___________ 。
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯(
 )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应:
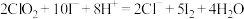 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: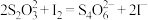 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:(4)实验室要配制1L 0.2
 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为
您最近一年使用:0次
4 . 氯元素形成的单质或化合物用途广泛。
(1)氯元素在周期表中的位置_____ 。
(2)工业上可用钢瓶储运液氯,在加注液氯前要对钢瓶进行充分干燥的原因是_____ (填合适的化学方程式)。
如图是氯的价类二维图:

其中C是一种新型净水剂,其合成路线如图:
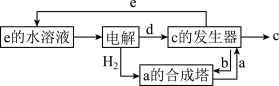
(3)C为______ (填化学式)。
(4)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:Zn+Cu2+=Zn2++Cu的氧化半反应可以表示为:Zn-2e-=Zn2+,电解时生成d的氧化半反应式为______ 。
(5)“a的合成塔”中发生反应的化学方程式为______ 。
(6)“c的发生器”中发生反应的离子方程式为_____ (写出正确的离子方程式并用单线桥法分析电子转移的情况)。
(7)实验测得等物质的量的f、O3、H2O2具有相同的漂白能力,原因是_____ 。
(1)氯元素在周期表中的位置
(2)工业上可用钢瓶储运液氯,在加注液氯前要对钢瓶进行充分干燥的原因是
如图是氯的价类二维图:

其中C是一种新型净水剂,其合成路线如图:

(3)C为
(4)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:Zn+Cu2+=Zn2++Cu的氧化半反应可以表示为:Zn-2e-=Zn2+,电解时生成d的氧化半反应式为
(5)“a的合成塔”中发生反应的化学方程式为
(6)“c的发生器”中发生反应的离子方程式为
(7)实验测得等物质的量的f、O3、H2O2具有相同的漂白能力,原因是
您最近一年使用:0次
解题方法
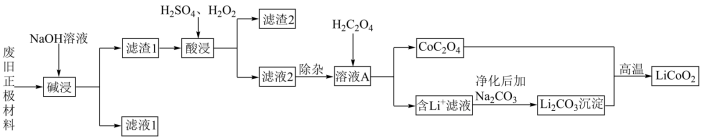
5 . 废旧锂离子电池材料的回收再生意义重大。一种回收废旧锂离子电池正极材料[含有钴酸锂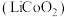 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸 的电离常数
的电离常数 ,
,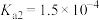 ;
;
②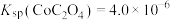 。
。
请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为_______ 。
(2)为提高“碱浸”效率可采取的措施有_______ (任写一条)。
(3)“滤渣2”的主要成分为_______ 。
(4)“酸浸”中发生反应的离子方程式为_______ 。
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是_______ 。
(6)常温下,溶液A中加入 产生
产生 沉淀:
沉淀: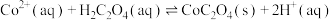 ,该反应的化学平衡常数
,该反应的化学平衡常数
_______ 。
(7)在空气中, 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为_______ 。
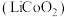 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸
 的电离常数
的电离常数 ,
,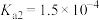 ;
;②
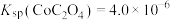 。
。请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为
(2)为提高“碱浸”效率可采取的措施有
(3)“滤渣2”的主要成分为
(4)“酸浸”中发生反应的离子方程式为
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是
| 反应温度/℃ | 60 | 70 | 80 | 90 |
| 钴的浸出率/% | 88 | 90.5 | 93 | 89 |
(6)常温下,溶液A中加入
 产生
产生 沉淀:
沉淀: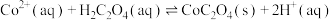 ,该反应的化学平衡常数
,该反应的化学平衡常数
(7)在空气中,
 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为
您最近一年使用:0次
解题方法
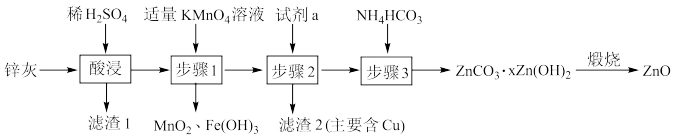
6 . 利用锌灰(主要成分为ZnO,含有CuO、PbO、 、FeO、
、FeO、 等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
 、FeO、
、FeO、 等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
A.为了提高酸浸效率,可采取适当升高温度、适当增大 溶液的浓度等措施 溶液的浓度等措施 |
B.滤渣1的主要成分为 、 、 |
C.步骤1中发生反应的离子方程式为: |
D.试剂a为ZnO或 |
您最近一年使用:0次
解题方法
7 . I.A、B、C、D、E为中学常见化学物质,它们之间可发生如图所示的转化,反应条件和部分产物已略去。其中A、C、E含有同一种元素X;A、D是常见金属单质,B是一种黄绿色气体。
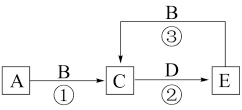
(1)物质B的化学式为_______ ;物质C中元素X的价态为_______ 。
(2)反应②可用于蚀刻铜电路板,其化学方程式为_______ 。
II.高铁酸钠是钠的六价铁酸盐,化学式为 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
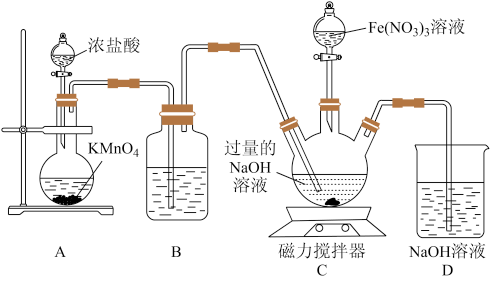
(3)装置A中,盛装浓盐酸的仪器名称为_______ ;若不考虑本实验条件限制,制备 时还可以将
时还可以将 替换为
替换为_______ (写出一种即可)。
(4)装置B中盛装液体的作用为_______ 。
(5)先向装置C的三颈烧瓶中通入一段时间 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。

(1)物质B的化学式为
(2)反应②可用于蚀刻铜电路板,其化学方程式为
II.高铁酸钠是钠的六价铁酸盐,化学式为
 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(3)装置A中,盛装浓盐酸的仪器名称为
 时还可以将
时还可以将 替换为
替换为(4)装置B中盛装液体的作用为
(5)先向装置C的三颈烧瓶中通入一段时间
 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为
您最近一年使用:0次
8 . 某同学做实验时白色衣服上沾了一些KMnO4,产生褐色斑点,如果用草酸(H2C2O4)的稀溶液洗涤马上可以复原,其离子方程式为: +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
 +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是| A.该反应的氧化产物是Mn2+ |
| B.离子方程式横线上的生成物是OH- |
| C.配平离子方程式,H+的计量数是6 |
| D.标准状况下,有5.6 LCO2生成时,转移电子的物质的量为0.5 mol |
您最近一年使用:0次
解题方法
9 . 下列过程对应的离子反应方程式书写正确的是
A. 溶液与过量澄清石灰水混合: 溶液与过量澄清石灰水混合: |
B.明矾溶液与过量氨水混合: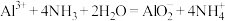 |
C.用 溶液吸收少量 溶液吸收少量 : : |
D.向水垢中滴加足量醋酸: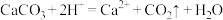 |
您最近一年使用:0次
2023-02-24更新
|
378次组卷
|
2卷引用:辽宁省葫芦岛市2022-2023学年高三上学期期末学业质量监测化学试题
名校
解题方法
10 . 生活离不开化学.家庭厨卫中有许多中学化学常见的物质,括号内为厨卫商品的主要成分。
①食盐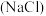 ②料酒(乙醇) ③食醋(乙酸) ④碱面
②料酒(乙醇) ③食醋(乙酸) ④碱面
⑤发酵粉( 和明矾) ⑥84消毒液
和明矾) ⑥84消毒液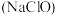 ⑦洁厕灵
⑦洁厕灵
回答下列问题:
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是______________ 。
(2)②③的主要成分可以归为一类物质,其分类的依据是______________(填正确答案标号)。
(3)明矾可做净水剂的理由是(用离子方程式表示)_________________ 。
(4)除去 固体中混有的少量
固体中混有的少量 杂质,应采取的最佳方法是
杂质,应采取的最佳方法是______________ 。
(5)相同条件下,等质量的 与
与 分别与足量的盐酸反应产生气体的体积比为
分别与足量的盐酸反应产生气体的体积比为____________ 。
(6)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由:__________________ 。
①食盐
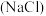 ②料酒(乙醇) ③食醋(乙酸) ④碱面
②料酒(乙醇) ③食醋(乙酸) ④碱面
⑤发酵粉(
 和明矾) ⑥84消毒液
和明矾) ⑥84消毒液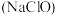 ⑦洁厕灵
⑦洁厕灵
回答下列问题:
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是
(2)②③的主要成分可以归为一类物质,其分类的依据是______________(填正确答案标号)。
| A.两种物质都是非电解质 | B.两种物质都是电解质 |
| C.两种物质都是含碳化合物 | D.两种物质都是氧化物 |
(4)除去
 固体中混有的少量
固体中混有的少量 杂质,应采取的最佳方法是
杂质,应采取的最佳方法是(5)相同条件下,等质量的
 与
与 分别与足量的盐酸反应产生气体的体积比为
分别与足量的盐酸反应产生气体的体积比为(6)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由:
您最近一年使用:0次
2023-02-19更新
|
102次组卷
|
2卷引用:辽宁省葫芦岛市普通高中2022-2023学年高一上学期学业质量监测(期末)考试化学试题



