名校
1 . 二氧化氯(ClO2)常用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。
已知:① 是黄绿色气体,易溶于水但不与水反应,沸点为11℃,有毒。
是黄绿色气体,易溶于水但不与水反应,沸点为11℃,有毒。
②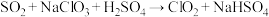 (未配平)。
(未配平)。
③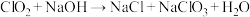 (未配平)。
(未配平)。
Ⅰ.设计如下装置制备 :
:

(1)装置B中反应的氧化剂与还原剂的物质的量之比为___________ 。
(2) 易溶于水但不与水发生化学反应,从分子结构的角度解释其易溶于水的原因
易溶于水但不与水发生化学反应,从分子结构的角度解释其易溶于水的原因___________ 。
(3)欲制备并收集一定量的 ,上图中装置的连接顺序为a→
,上图中装置的连接顺序为a→___________ 。
Ⅱ.探究 与
与 的反应:
的反应:
将上述收集到的 用
用 稀释以增强其稳定性,并将适量的稀释后的
稀释以增强其稳定性,并将适量的稀释后的 通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。
通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。
(4)请补全表格中的空白。

(5) 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
已知:①
 是黄绿色气体,易溶于水但不与水反应,沸点为11℃,有毒。
是黄绿色气体,易溶于水但不与水反应,沸点为11℃,有毒。②
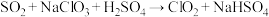 (未配平)。
(未配平)。③
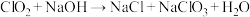 (未配平)。
(未配平)。Ⅰ.设计如下装置制备
 :
:
(1)装置B中反应的氧化剂与还原剂的物质的量之比为
(2)
 易溶于水但不与水发生化学反应,从分子结构的角度解释其易溶于水的原因
易溶于水但不与水发生化学反应,从分子结构的角度解释其易溶于水的原因(3)欲制备并收集一定量的
 ,上图中装置的连接顺序为a→
,上图中装置的连接顺序为a→Ⅱ.探究
 与
与 的反应:
的反应:将上述收集到的
 用
用 稀释以增强其稳定性,并将适量的稀释后的
稀释以增强其稳定性,并将适量的稀释后的 通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。
通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。(4)请补全表格中的空白。

| 操作步骤 | 实验现象 | 结论 |
| 取少量Ⅰ中溶液放入试管甲中,滴加品红溶液和盐酸。 | 品红溶液始终不褪色 | ①无 |
另取少量Ⅰ中溶液放入试管乙中,加入 溶液振荡。 溶液振荡。 | ② | 有 生成 生成 |
③继续在试管乙中加入 溶液至过量,静置,取上层清液放入试管丙中, 溶液至过量,静置,取上层清液放入试管丙中, | 有白色沉淀生成 | 有 生成 生成 |
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2022-06-03更新
|
736次组卷
|
2卷引用:辽宁省实验中学2022届高三考前模拟训练化学试题
名校
解题方法
2 . 实验室中利用洁净的铜片和浓硫酸进行如下实验,经检测所得固体中含有Cu2S和白色物质X,下列说法正确的是
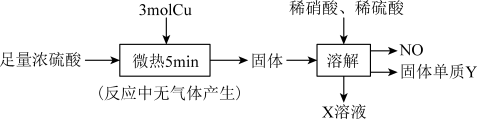

| A.X溶液显无色 |
| B.参加反应的浓硫酸中,体现氧化性的占25% |
| C.NO和Y均为还原产物 |
| D.NO与Y的物质的量之和可能为2mol |
您最近一年使用:0次
2022-06-03更新
|
1784次组卷
|
7卷引用:辽宁省实验中学2024届高三高考适应性测试(二)化学试题
辽宁省实验中学2024届高三高考适应性测试(二)化学试题福建省福州第一中学2022届高三下学期模拟考试化学试题(已下线)第06讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)吉林省长春市第五中学2021-2022学年高二下学期期末考试化学试题江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题福建省厦门市湖滨中学2022-2023学年高三上学期期中考试化学试题
解题方法
3 . 某省锌铜产量居全国之首,从铅锌厂的电尘(主要成分为PbO 、ZnO,还含有少量Fe2O3、Tl2O)中回收Fe2O3、ZnO、铊,铊锡合金可作超导材料。其工艺流程如图。
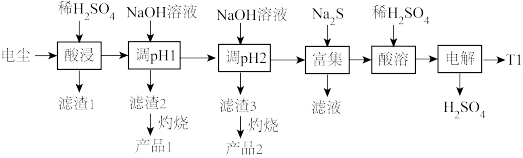
已知:①Zn(OH)2为两性氢氧化物,溶液pH> 10开始溶解。
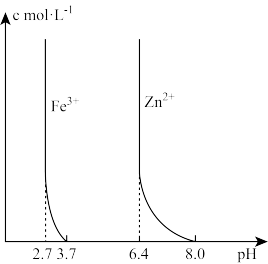
②部分离子浓度与pH的关系如图。
(1)铊在周期表中的位置是_______ 。
(2)“酸浸”过程中为提高铊的浸取速度,可采取的措施有_______ (写出两条)。
(3)“产品1”的主要成分是_______ (填化学式),检验电尘中是否含FeO,取“酸浸”后的少量滤液于试管中,加入黄色试剂,发生反应的化学方程式 _______ 。
(4)“调pH2”过程调pH的范围是_______ 。
(5)“富集”过程发生的离子方程式是_______ 。
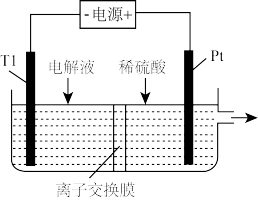
(6)“电解”过程的电解池如图,则应是_______ (填“阳”或“阴")离子交换膜。

已知:①Zn(OH)2为两性氢氧化物,溶液pH> 10开始溶解。
②部分离子浓度与pH的关系如图。

(1)铊在周期表中的位置是
(2)“酸浸”过程中为提高铊的浸取速度,可采取的措施有
(3)“产品1”的主要成分是
(4)“调pH2”过程调pH的范围是
(5)“富集”过程发生的离子方程式是
(6)“电解”过程的电解池如图,则应是

您最近一年使用:0次
4 . 下列离子方程式能正确表示反应的是
A.向 溶液中通入少量 溶液中通入少量 : :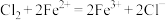 |
B. 溶液与 溶液与 溶液混合: 溶液混合: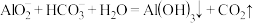 |
C.用高锰酸钾标准溶液滴定草酸: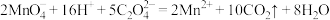 |
D.向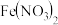 稀溶液中加入盐酸: 稀溶液中加入盐酸: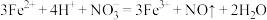 |
您最近一年使用:0次
解题方法
5 . 钴配合物在催化剂领域有广泛用途,三氯化六氨合钴(Ⅲ) 是合成其他含钴配合物的重要原料,其工业制备过程如下:
是合成其他含钴配合物的重要原料,其工业制备过程如下:
步骤Ⅰ:工业利用水钴矿(住要成分为 ,含少量
,含少量 、
、 、
、 、
、 、
、 、
、 等)制取氯化钴晶体:
等)制取氯化钴晶体:
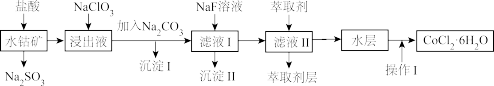
步骤Ⅱ:在活性炭的催化作用下,通过氧化 制得到
制得到 流程如下:
流程如下:

已知:①氧化性: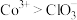
②沉淀Ⅰ、沉淀Ⅱ中都只含有两种沉淀。
③以氢氧化物形式沉淀时溶液的pH见表:
(1) 原子的核外电子排布式为:
原子的核外电子排布式为:_______ 。
(2)加入 的主要作用:
的主要作用:_______ 。
(3)向“浸出液”中加入适量的 ,反应的离子方程式是
,反应的离子方程式是_______ ,加入 调节溶液
调节溶液 范围为:②
范围为:②_______ ;萃取剂层含锰元素,则加入 的作用是:③
的作用是:③_______ 。
(4)步骤Ⅱ中氧化过程,需水浴控温在 ,温度不能过高,原因是:
,温度不能过高,原因是:_______ ;“系列操作”是指在高浓度的盐酸中使 结晶析出,过滤,醇洗,干燥。使用乙醇洗涤产品的具体操作是:
结晶析出,过滤,醇洗,干燥。使用乙醇洗涤产品的具体操作是:_______ 。
(5)结束后废水中的 ,人们常用
,人们常用 沉淀剂来处理,原理是
沉淀剂来处理,原理是_______ (用离子方程式表示)。
 是合成其他含钴配合物的重要原料,其工业制备过程如下:
是合成其他含钴配合物的重要原料,其工业制备过程如下:步骤Ⅰ:工业利用水钴矿(住要成分为
 ,含少量
,含少量 、
、 、
、 、
、 、
、 、
、 等)制取氯化钴晶体:
等)制取氯化钴晶体:
步骤Ⅱ:在活性炭的催化作用下,通过氧化
 制得到
制得到 流程如下:
流程如下:
已知:①氧化性:
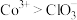
②沉淀Ⅰ、沉淀Ⅱ中都只含有两种沉淀。
③以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 |  |  |  |  |  |  |
| 开始沉淀 | 2.7 | 4.0 | 7.6 | 7.7 | 9.6 | 7.5 |
| 完全沉淀 | 3.7 | 5.2 | 9.6 | 9.8 | 11.1 | 9.2 |
 原子的核外电子排布式为:
原子的核外电子排布式为:(2)加入
 的主要作用:
的主要作用:(3)向“浸出液”中加入适量的
 ,反应的离子方程式是
,反应的离子方程式是 调节溶液
调节溶液 范围为:②
范围为:② 的作用是:③
的作用是:③(4)步骤Ⅱ中氧化过程,需水浴控温在
 ,温度不能过高,原因是:
,温度不能过高,原因是: 结晶析出,过滤,醇洗,干燥。使用乙醇洗涤产品的具体操作是:
结晶析出,过滤,醇洗,干燥。使用乙醇洗涤产品的具体操作是:(5)结束后废水中的
 ,人们常用
,人们常用 沉淀剂来处理,原理是
沉淀剂来处理,原理是
您最近一年使用:0次
名校
解题方法
6 . 过碳酸钠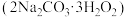 俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在贮运过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。
俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在贮运过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。

(1)装置中仪器A的名称为_______ 。
(2)按图连接好装置后,先将饱和 溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入
溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入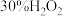 溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
(3)反应过程中要控制温度不能太高,原因是________
(4)反应后向混合物中加入 固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入
固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入 固体的作用是
固体的作用是________
(5)过碳酸钠样品纯度的测定。
取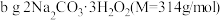 配成
配成 溶液,取
溶液,取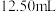 溶液于锥形瓶,加入足量稀硫酸,用
溶液于锥形瓶,加入足量稀硫酸,用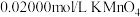 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 (已知:
(已知: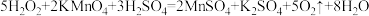 )
)
①实验达到滴定终点的现象是_______ ;
②该过氧碳酸钠的产品纯度为_______ (用字母表示);
③滴定时间过长,测得过碳酸钠产品纯度将_______ (填“偏高”、“偏低”或“无影响”)。
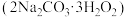 俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在贮运过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。
俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在贮运过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。
(1)装置中仪器A的名称为
(2)按图连接好装置后,先将饱和
 溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入
溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入 溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。A. | B. | C. | D. |
(4)反应后向混合物中加入
 固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入
固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入 固体的作用是
固体的作用是(5)过碳酸钠样品纯度的测定。
取
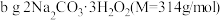 配成
配成 溶液,取
溶液,取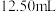 溶液于锥形瓶,加入足量稀硫酸,用
溶液于锥形瓶,加入足量稀硫酸,用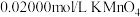 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 (已知:
(已知: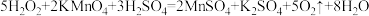 )
)①实验达到滴定终点的现象是
②该过氧碳酸钠的产品纯度为
③滴定时间过长,测得过碳酸钠产品纯度将
您最近一年使用:0次
2022-05-20更新
|
335次组卷
|
3卷引用:辽宁省大连市2021-2022学年高三第二次模拟考试化学试题
2022·辽宁·模拟预测
解题方法
7 . Ni2O3,又称为氧化高镍,可用于电子元件和高能量电池的制造。工业上用含Ni的废料(杂质含少量Fe)制备Ni2O3的工艺流程如下:

请回答下列问题:
(1)酸浸时需将含镍废料粉碎,目的是_______ 。
(2)某实验小组用0.1 mol· L-1的盐酸浸出镍。绘制了如下两图:


①由图一可知,固液比与镍浸出率的关系是_______ 。
②由图二可知,酸浸时合适的浸出温度是_______ ℃;温度过高,镍的浸出率下降,其原因:_______ 。
(3)加入适量H2O2溶液发生的离子反应为_______ ,滤渣的主要成分是_______ 。
(4)写出流程中第2个氧化过程中反应的离子方程式_______ 。
(5)上述反应制出的Ni2O3,可用于镍氢电池的原料,在碱性条件下,镍氢电池的反应为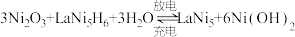 。该电池放电时,负极附近pH
。该电池放电时,负极附近pH_______ (填“增大”、“减小”、“不变”);该电池充电时,阳极的电极反应式为_______ 。

请回答下列问题:
(1)酸浸时需将含镍废料粉碎,目的是
(2)某实验小组用0.1 mol· L-1的盐酸浸出镍。绘制了如下两图:


①由图一可知,固液比与镍浸出率的关系是
②由图二可知,酸浸时合适的浸出温度是
(3)加入适量H2O2溶液发生的离子反应为
(4)写出流程中第2个氧化过程中反应的离子方程式
(5)上述反应制出的Ni2O3,可用于镍氢电池的原料,在碱性条件下,镍氢电池的反应为
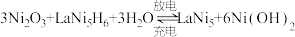 。该电池放电时,负极附近pH
。该电池放电时,负极附近pH
您最近一年使用:0次
8 . 次磷酸钠(NaH2PO2) 在食品工业中用作防腐剂、抗氧化剂,也是一 种很好的化学镀剂。
I.将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍的目的,该过程中 被氧化为二元弱酸H3PO3 (
被氧化为二元弱酸H3PO3 (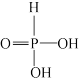 )
)
(1)写出该反应的离子方程式:_______ 。
II.实验室制取次磷酸钠。将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3.,PH3与NaClO溶液反应也可生成次磷酸钠。
(2)结合题干信息,写出 的结构式
的结构式_______ 。
(3)利用以下装置制取次磷酸钠,正确的连接顺序是_______ (用小写字母表示)。
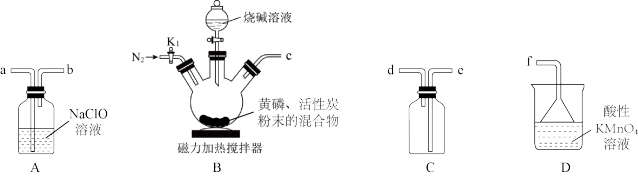
(4)装置C的作用为_______ 。
(5)装置B中发生反应的化学方程式为_______ 。
(6)已知相关物质的溶解度如下:
充分反应后,将A、B中溶液混合,将混合液(含极少量NaOH)蒸发浓缩,有大量晶体析出,然后_______ ,再冷却结晶、过滤、洗涤、干燥,得到含NaH2PO2的粗产品。
(7)取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入30.00mL 0.100mol/L碘水,充分反应,以淀粉溶液作指示剂,用0.100mol/L Na2S2O3溶液滴定至终点,平均消耗24.00mL。相关反应的方程式为: +H2O+I2=
+H2O+I2=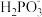 +2H++2I-,2
+2H++2I-,2 +I2=
+I2= +2I-,则产品纯度为
+2I-,则产品纯度为_______ 。(保留小数点后一位) 。
I.将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍的目的,该过程中
 被氧化为二元弱酸H3PO3 (
被氧化为二元弱酸H3PO3 ( )
)(1)写出该反应的离子方程式:
II.实验室制取次磷酸钠。将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3.,PH3与NaClO溶液反应也可生成次磷酸钠。
(2)结合题干信息,写出
 的结构式
的结构式(3)利用以下装置制取次磷酸钠,正确的连接顺序是

(4)装置C的作用为
(5)装置B中发生反应的化学方程式为
(6)已知相关物质的溶解度如下:
溶解度(g) 物质 | 25℃ | 100℃ |
| NaCl | 37 | 39 |
| NaH2PO2 | 100 | 667 |
(7)取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入30.00mL 0.100mol/L碘水,充分反应,以淀粉溶液作指示剂,用0.100mol/L Na2S2O3溶液滴定至终点,平均消耗24.00mL。相关反应的方程式为:
 +H2O+I2=
+H2O+I2=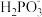 +2H++2I-,2
+2H++2I-,2 +I2=
+I2= +2I-,则产品纯度为
+2I-,则产品纯度为
您最近一年使用:0次
9 . 硫化铋作为一种重要的半导体材料,广泛应用于光电催化等领域。以辉铋矿(主要成分是 ,还含少量
,还含少量 、
、 、
、 等杂质)为原料制备高纯
等杂质)为原料制备高纯 的工艺流程如下:
的工艺流程如下:

已知:①铋位于周期表第六周期ⅤA,单质不如铁活泼且不溶于盐酸,可溶于硝酸。
②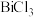 在
在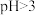 的溶液中极易水解生成不溶性的
的溶液中极易水解生成不溶性的 沉淀。
沉淀。
回答下列问题:
(1)基态铋原子的价电子排布式为___________ 。
(2)为提高加压碱浸的效率,可采取合理的措施为___________ 。
(3)加压碱浸过程中硫元素能被氧化成 ,铜元素转化为
,铜元素转化为 ,请写出
,请写出 发生反应的离子方程式
发生反应的离子方程式___________ 。
(4)酸浸中,若升高温度,铋的浸出率先升高后降低,则浸出率下降的主要因素可能是___________ 、___________ ;“滤渣Ⅰ”的主要成分为___________ 。
(5)还原过程中过量的铁粉可用___________ 除去。如把铋粉空气氧化后“酸溶”改为直接用浓硝酸氧化铋粉,不足之处是___________ 。
(6)已知硫代乙酰胺 在此酸性水溶液中可水解为乙酰胺和硫化氢,写出硫化过程的化学方程式
在此酸性水溶液中可水解为乙酰胺和硫化氢,写出硫化过程的化学方程式___________ 。
 ,还含少量
,还含少量 、
、 、
、 等杂质)为原料制备高纯
等杂质)为原料制备高纯 的工艺流程如下:
的工艺流程如下:
已知:①铋位于周期表第六周期ⅤA,单质不如铁活泼且不溶于盐酸,可溶于硝酸。
②
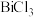 在
在 的溶液中极易水解生成不溶性的
的溶液中极易水解生成不溶性的 沉淀。
沉淀。回答下列问题:
(1)基态铋原子的价电子排布式为
(2)为提高加压碱浸的效率,可采取合理的措施为
(3)加压碱浸过程中硫元素能被氧化成
 ,铜元素转化为
,铜元素转化为 ,请写出
,请写出 发生反应的离子方程式
发生反应的离子方程式(4)酸浸中,若升高温度,铋的浸出率先升高后降低,则浸出率下降的主要因素可能是
(5)还原过程中过量的铁粉可用
(6)已知硫代乙酰胺
 在此酸性水溶液中可水解为乙酰胺和硫化氢,写出硫化过程的化学方程式
在此酸性水溶液中可水解为乙酰胺和硫化氢,写出硫化过程的化学方程式
您最近一年使用:0次
10 . 高锰酸钾是常见的强氧化剂,其制备流程如下:

i.制取锰酸钾(K2MnO4)
碱熔:用托盘天平称取5.0gKOH固体、1.5gKClO3固体于坩埚中,混匀、小心加热,不断搅拌,待混合物完全熔融后,加入MnO2粉末3.5g,加热到颜色变为深绿色,用力搅拌到固体干涸、固化,再加热5min,并用铁棒将其尽量捣碎。
浸取:待物料冷却后,置于200mL烧杯中,用50mL蒸馏水浸取、过滤,得到绿色的溶液。
(1)碱熔过程中发生反应的化学方程式为_______ ;加热中若不小心将液体溅到皮肤上,应_______ 处理;加热时应选择_______ (填字母)。
a.瓷坩埚 b.铁坩埚 c.石英坩埚 d.氧化铝坩埚
ii.制取高锰酸钾(KMnO4)
在浸取液中通入CO2气体,至K2MnO4完全反应,用pH试纸测定溶液pH达到10~11时,停止通入CO2.然后把溶液加热,趁热用铺有尼龙布的布氏漏斗进行减压过滤,除去残渣……
已知:常温常压下,饱和碳酸钾溶液的pH为11.6;碳酸氢钾溶液的pH为8.3。
(2)①通入CO2发生反应的离子方程式为_______ ;判断此反应进行是否完全,也可以用玻璃棒蘸取溶液于滤纸上,若呈现_______ 现象,停止通入CO2;过滤时不用滤纸而用尼龙布的原因:_______ ;_______ (填“能”或“不能”)用加盐酸的方法代替通入CO2,其理由:_______ 。
②已知:几种物质在不同温度下的溶解度
“操作X”为_______ 。
iii.重结晶提纯
(3)利用重结晶的方法对产品提纯,所得产品质量2.8g,则高锰酸钾的产率为_______ (精确到0.1%)。

i.制取锰酸钾(K2MnO4)
碱熔:用托盘天平称取5.0gKOH固体、1.5gKClO3固体于坩埚中,混匀、小心加热,不断搅拌,待混合物完全熔融后,加入MnO2粉末3.5g,加热到颜色变为深绿色,用力搅拌到固体干涸、固化,再加热5min,并用铁棒将其尽量捣碎。
浸取:待物料冷却后,置于200mL烧杯中,用50mL蒸馏水浸取、过滤,得到绿色的溶液。
(1)碱熔过程中发生反应的化学方程式为
a.瓷坩埚 b.铁坩埚 c.石英坩埚 d.氧化铝坩埚
ii.制取高锰酸钾(KMnO4)
在浸取液中通入CO2气体,至K2MnO4完全反应,用pH试纸测定溶液pH达到10~11时,停止通入CO2.然后把溶液加热,趁热用铺有尼龙布的布氏漏斗进行减压过滤,除去残渣……
已知:常温常压下,饱和碳酸钾溶液的pH为11.6;碳酸氢钾溶液的pH为8.3。
(2)①通入CO2发生反应的离子方程式为
②已知:几种物质在不同温度下的溶解度
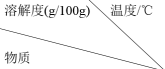 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 |
| K2CO3·2H2O | 51.3 | 52 | 52.5 | 53.2 | 53.9 | 54.8 | 55.9 |
| KMnO4 | 2.83 | 4.4 | 6.4 | 9.0 | 12.7 | 16.9 | 22.2 |
iii.重结晶提纯
(3)利用重结晶的方法对产品提纯,所得产品质量2.8g,则高锰酸钾的产率为
您最近一年使用:0次
2022-05-05更新
|
691次组卷
|
3卷引用:东北育才学校超常教育实验部(少32届)2022届高三第十次模拟考试化学试题
东北育才学校超常教育实验部(少32届)2022届高三第十次模拟考试化学试题河北省衡水市2022届高考二模化学试题(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)



