解题方法
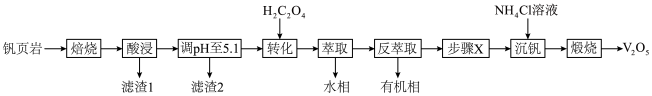
1 . V有“工业味精”之称。工业上提取钒的工艺有多种,一种从钒页岩(一种主要含Si、Fe、Al、V元素的矿石)中提取V的工艺流程如下:
①“酸浸”时有VO 生成;
生成;
② 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为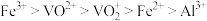 ;
;
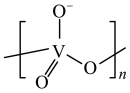
③VO 和
和 可以相互转化。
可以相互转化。
回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl- 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是____________________ 。
(2)“滤渣1”除掉的主要杂质元素是_______ (填元素符号)。
(3) 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是_____________ ,发生的离子反应方程式为_____________________ 。
(4)①“沉钒”时,生成 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入________ (填“氧化剂”或“还原剂”),写出“沉钒”时的离子反应方程式_______________________ 。
②以“沉钒率”( 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是_______________ 。 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为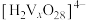 ,其中
,其中
________ 。 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是_____ 原子。
①“酸浸”时有VO
 生成;
生成;②
 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为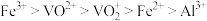 ;
;③VO
 和
和 可以相互转化。
可以相互转化。回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl-
 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是(2)“滤渣1”除掉的主要杂质元素是
(3)
 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是(4)①“沉钒”时,生成
 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入②以“沉钒率”(
 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是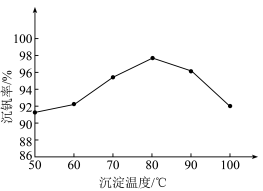
 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为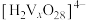 ,其中
,其中
 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是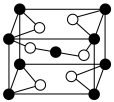
您最近半年使用:0次
2 . 实验室模拟某含有机酸 工业废水的处理过程。
工业废水的处理过程。
 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:
(1) 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:


①基态 的价电子排布式为
的价电子排布式为___________ 。
②下列有关上述络合反应的说法中,正确的有___________ (填标号)。
A.反应达平衡时,溶液的颜色不再变化
B.增大 浓度,逆反应速率减小
浓度,逆反应速率减小
C. 过低不利于
过低不利于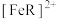 的生成
的生成
D.升高温度,该平衡正向移动
(2)紫外光催化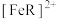 降解:
降解:
若有机酸为 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为:___________ 。
 ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:
(i)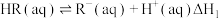
(ii)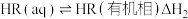
(iii)
(3)根据盖斯定律,反应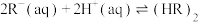 (有机相)的
(有机相)的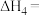
___________ 。
(4)水相的 以及体系温度
以及体系温度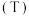 对
对 的平衡分配比
的平衡分配比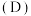 有影响。
有影响。
已知: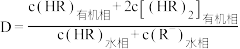 。
。
①常温下,配制体积相同、 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析 随
随 升高而降低的原因
升高而降低的原因___________ 。 溶液
溶液 时,
时,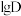 随
随 的变化曲线如图所示。
的变化曲线如图所示。 萃取宜在
萃取宜在___________ 温度下进行(填“较高”或“较低”)。
 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数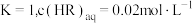 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中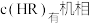
___________ 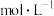 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数
___________ (写出计算过程)。
 工业废水的处理过程。
工业废水的处理过程。 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:(1)
 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:

①基态
 的价电子排布式为
的价电子排布式为②下列有关上述络合反应的说法中,正确的有
A.反应达平衡时,溶液的颜色不再变化
B.增大
 浓度,逆反应速率减小
浓度,逆反应速率减小C.
 过低不利于
过低不利于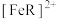 的生成
的生成 D.升高温度,该平衡正向移动
(2)紫外光催化
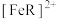 降解:
降解:若有机酸为
 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为: ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:(i)
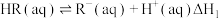
(ii)
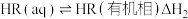
(iii)

(3)根据盖斯定律,反应
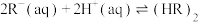 (有机相)的
(有机相)的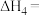
(4)水相的
 以及体系温度
以及体系温度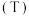 对
对 的平衡分配比
的平衡分配比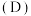 有影响。
有影响。已知:
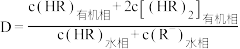 。
。①常温下,配制体积相同、
 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析 随
随 升高而降低的原因
升高而降低的原因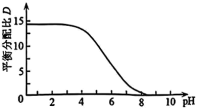
 溶液
溶液 时,
时,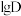 随
随 的变化曲线如图所示。
的变化曲线如图所示。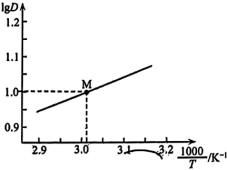
 萃取宜在
萃取宜在 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数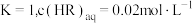 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中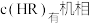
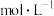 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数
您最近半年使用:0次
3 . 工业上用红土镍矿(主要成分为NiO,含CoO、FeO、 、
、 、MgO、CaO和
、MgO、CaO和 )制备
)制备 。工艺流程如图所示,回答下列问题:
。工艺流程如图所示,回答下列问题: 在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为
在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为______ (填化学式)。
(2)由 溶液获取
溶液获取 的操作是
的操作是______ 、______ 、过滤、洗涤。
(3)沉镁沉钙加入NaF溶液,生成 和
和 若沉淀前溶液中
若沉淀前溶液中 ,当沉淀完全后滤液中
,当沉淀完全后滤液中 时,除钙率为
时,除钙率为______ (忽略沉淀前后溶液体积变化)。(已知: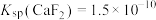 、
、 )
)
(4)“萃取”可将金属离子进行富集与分离,原理如下:
 。工业上用
。工业上用 磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:
磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:______ 左右。
②反萃取的试剂为______ 。
(5)氧化、沉铁沉铝时,需加入NaClO溶液起氧化作用。写出 与NaClO在碱性条件下发生反应的离子方程式:
与NaClO在碱性条件下发生反应的离子方程式:______ 。
(6) 中阴离子的空间构型为
中阴离子的空间构型为______ 。
 、
、 、MgO、CaO和
、MgO、CaO和 )制备
)制备 。工艺流程如图所示,回答下列问题:
。工艺流程如图所示,回答下列问题:
 在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为
在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为(2)由
 溶液获取
溶液获取 的操作是
的操作是(3)沉镁沉钙加入NaF溶液,生成
 和
和 若沉淀前溶液中
若沉淀前溶液中 ,当沉淀完全后滤液中
,当沉淀完全后滤液中 时,除钙率为
时,除钙率为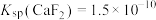 、
、 )
)(4)“萃取”可将金属离子进行富集与分离,原理如下:

 。工业上用
。工业上用 磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:
磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示: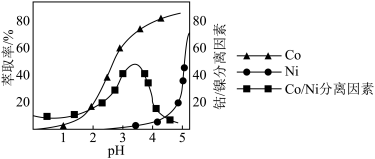
②反萃取的试剂为
(5)氧化、沉铁沉铝时,需加入NaClO溶液起氧化作用。写出
 与NaClO在碱性条件下发生反应的离子方程式:
与NaClO在碱性条件下发生反应的离子方程式:(6)
 中阴离子的空间构型为
中阴离子的空间构型为
您最近半年使用:0次
解题方法
4 . 为回收利用废钒催化剂(含有V2O5、VOSO4、SiO2、Fe3O4以及钾和铝的硅酸盐),科研人员研制了一种回收V2O5的新工艺,主要流程如下图。
ii.VOSO4可溶、(VO2)2SO4易溶、V2O5和NH4VO3难溶; +2OH-=
+2OH-= +H2O
+H2O
(1)“酸浸氧化”时,VO2+转化成 反应的离子方程式为
反应的离子方程式为______ ,同时V2O5转化为 。滤渣①主要成分是
。滤渣①主要成分是______ 。
(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子有______ 。
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3溶解,写出V2O5·2H2O与KOH反应的化学方程式______ 。
(4)“调pH”中滤渣④的主要成分是______ 。
(5)全钒液流储能电池可实现化学能和电能的相互转化,其原理如图所示。______ 。
②放电过程中,右槽溶液颜色变化的情况是______ 。
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为______ 。若该晶胞的密度为ρg/cm3,且用NA表示阿伏加德罗常数,则该晶胞的边长为______ nm。
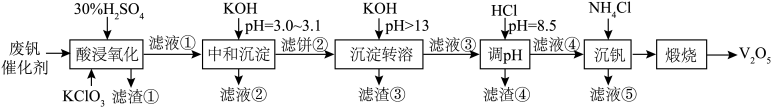
| 金属离子 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
 +2OH-=
+2OH-= +H2O
+H2O(1)“酸浸氧化”时,VO2+转化成
 反应的离子方程式为
反应的离子方程式为 。滤渣①主要成分是
。滤渣①主要成分是(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子有
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3溶解,写出V2O5·2H2O与KOH反应的化学方程式
(4)“调pH”中滤渣④的主要成分是
(5)全钒液流储能电池可实现化学能和电能的相互转化,其原理如图所示。
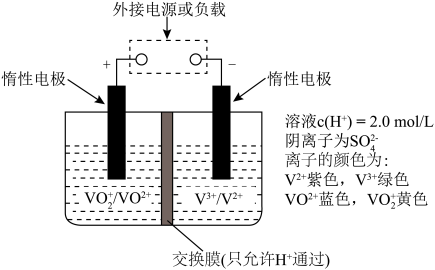
②放电过程中,右槽溶液颜色变化的情况是
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为
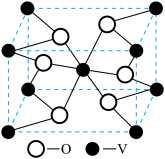
您最近半年使用:0次
5 . Fe@Fe2O3纳米线是一种新型铁基材料,在催化、生物医药、环境科学等领域具有广阔应用前景。某研究小组以赤泥(铝土矿提取氧化铝过程中产生的固体废弃物,含SiO2、Fe2O3、Al2O3)为原料,设计下列流程制备Fe@Fe2O3纳米线并探究其在水处理中的应用。
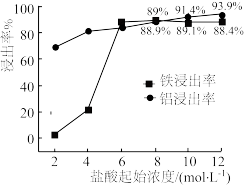
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:___________ 。
②盐酸起始浓度为2 mol·L-1时,铁的浸出率很低,原因是___________ 。
(2)铁的晶胞如图所示,若该晶体的密度是a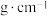 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为___________ cm(设NA为阿伏加德罗常数的值)。 AlO
AlO + H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为
+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为___________ (设调节pH过程中溶液体积不变)。
(4)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液II中含B(OH)3,合成铁核的离子方程式为___________ 。
②“合成”后,经过滤、___________ 、___________ 获得Fe@Fe2O3纳米线。
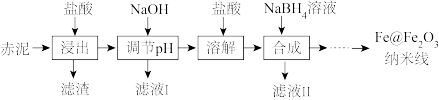
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:
②盐酸起始浓度为2 mol·L-1时,铁的浸出率很低,原因是
(2)铁的晶胞如图所示,若该晶体的密度是a
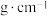 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为
 AlO
AlO + H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为
+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为(4)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液II中含B(OH)3,合成铁核的离子方程式为
②“合成”后,经过滤、
您最近半年使用:0次
解题方法
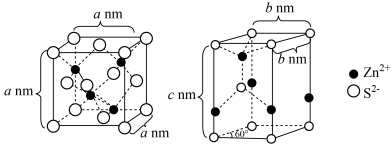
6 .  是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为
是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为 ,还含有少量:
,还含有少量: 、
、 、
、 、
、 、
、 、PbO,
、PbO, 、CdO和
、CdO和 )制备
)制备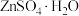 流程如下:
流程如下:
回答下列问题:
(1)加硫酸浸取后再调节pH=5,过滤获得的滤渣①的主要成分为 、
、 、
、 、
、___________ 和___________ 。
(2)加入 溶液后过滤可以得到
溶液后过滤可以得到 和
和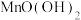 两种沉淀,
两种沉淀, 发生反应的离子方程式为
发生反应的离子方程式为___________ ,常温下,此时溶液pH仍为5,则溶液残留的微量 的浓度约为
的浓度约为___________ mol/L⋅,根据“转化过滤”过程,推测若Zn、稀硫酸、Cd形成原电池,则电势较高的一极为___________ 。
(3)“脱钙镁”后“过滤”所得的滤渣还可以和浓硫酸反应制备HF以循环使用,则该反应可以发生的原因是___________ 。
(4)脱完钙和镁之后的 滤液中含有少量的
滤液中含有少量的 ,
, 的溶解度曲线如图。由滤液④获得
的溶解度曲线如图。由滤液④获得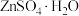 的具体操作为
的具体操作为___________ 。___________ (用含a、b、c的代数式表示)。
 是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为
是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为 ,还含有少量:
,还含有少量: 、
、 、
、 、
、 、
、 、PbO,
、PbO, 、CdO和
、CdO和 )制备
)制备 流程如下:
流程如下: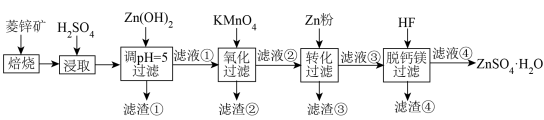
| 金属阳离子 |  |  |  | 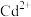 |  |  |  |
| 开始沉淀pH | 6.2 | 7.4 | 2.2 | 7.7 | 9.1 | 8.1 | 3.4 |
| 沉淀完全pH | 8.2 | 8.9 | 3.2 | 9.7 | 11.1 | 10.1 | 4.7 |
(1)加硫酸浸取后再调节pH=5,过滤获得的滤渣①的主要成分为
 、
、 、
、 、
、(2)加入
 溶液后过滤可以得到
溶液后过滤可以得到 和
和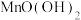 两种沉淀,
两种沉淀, 发生反应的离子方程式为
发生反应的离子方程式为 的浓度约为
的浓度约为(3)“脱钙镁”后“过滤”所得的滤渣还可以和浓硫酸反应制备HF以循环使用,则该反应可以发生的原因是
(4)脱完钙和镁之后的
 滤液中含有少量的
滤液中含有少量的 ,
, 的溶解度曲线如图。由滤液④获得
的溶解度曲线如图。由滤液④获得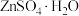 的具体操作为
的具体操作为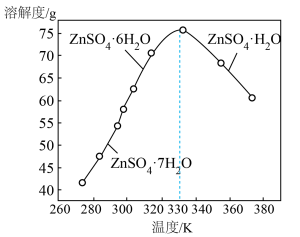
您最近半年使用:0次
解题方法
7 . 某制酸工厂产生的废酸液主要成分为HF、 、
、 、
、 、
、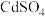 ,一种处理工艺如下:
,一种处理工艺如下:
回答下列问题:
(1)基态As原子的价层电子排布图为__________________ , 中As的化合价为
中As的化合价为_________ 。
(2)原废水中含有的 浓度为52.0
浓度为52.0 ,则
,则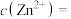
_____  ,常温下,有B离子的去除量、“调pH”为6.0后,
,常温下,有B离子的去除量、“调pH”为6.0后, 的去除率为
的去除率为_______ 。(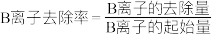 )
)
(3)强碱(AOH)的化学式为_____________ 。
(4)写出“还原”过程中 发生反应的化学方程式
发生反应的化学方程式_______________ 。
(5)产品结构分析。晶体W的晶胞结构如图所示:__________ 。
②W的化学式为_____________ 。
(6)产品纯度分析。称取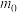 g
g  样品,用碱溶解,加入淀粉作指示剂,用浓度为
样品,用碱溶解,加入淀粉作指示剂,用浓度为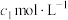 的碘标准溶液滴定As(Ⅲ)至As(Ⅴ),消耗体积为
的碘标准溶液滴定As(Ⅲ)至As(Ⅴ),消耗体积为 mL,则制得的产品纯度为
mL,则制得的产品纯度为___________ 。(用含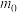 、
、 、
、 的代数式表示)
的代数式表示)
 、
、 、
、 、
、 ,一种处理工艺如下:
,一种处理工艺如下: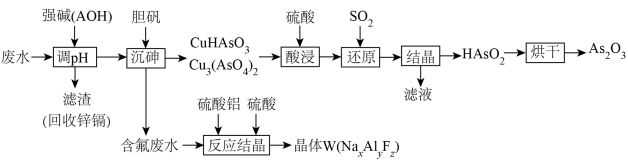
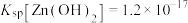
回答下列问题:
(1)基态As原子的价层电子排布图为
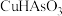 中As的化合价为
中As的化合价为(2)原废水中含有的
 浓度为52.0
浓度为52.0 ,则
,则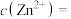
 ,常温下,有B离子的去除量、“调pH”为6.0后,
,常温下,有B离子的去除量、“调pH”为6.0后, 的去除率为
的去除率为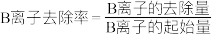 )
)(3)强碱(AOH)的化学式为
(4)写出“还原”过程中
 发生反应的化学方程式
发生反应的化学方程式(5)产品结构分析。晶体W的晶胞结构如图所示:

②W的化学式为
(6)产品纯度分析。称取
 g
g  样品,用碱溶解,加入淀粉作指示剂,用浓度为
样品,用碱溶解,加入淀粉作指示剂,用浓度为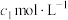 的碘标准溶液滴定As(Ⅲ)至As(Ⅴ),消耗体积为
的碘标准溶液滴定As(Ⅲ)至As(Ⅴ),消耗体积为 mL,则制得的产品纯度为
mL,则制得的产品纯度为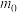 、
、 、
、 的代数式表示)
的代数式表示)
您最近半年使用:0次
8 . 铁的单质及其化合物用途广泛,下列相关的离子方程式书写正确的是
A.用KSCN溶液检验 : : |
B.硫酸亚铁溶液中滴加双氧水: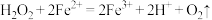 |
C.NaClO碱性条件下制备绿色消毒剂 : : |
D.用 溶液刻蚀Cu电路板: 溶液刻蚀Cu电路板: |
您最近半年使用:0次
解题方法
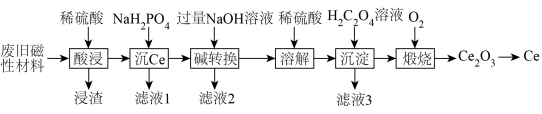
9 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
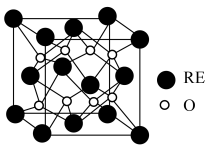
您最近半年使用:0次
10 . 下列离子方程式正确且与所给事实相符的是
A.某电子厂制作印刷电路板: |
B.用 溶液除去锅炉水垢中的 溶液除去锅炉水垢中的 : :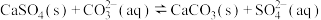 |
C.混用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是NaClO)会发生氯气中毒: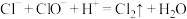 |
D.用 作抗胃酸药: 作抗胃酸药: |
您最近半年使用:0次



