名校
解题方法
1 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。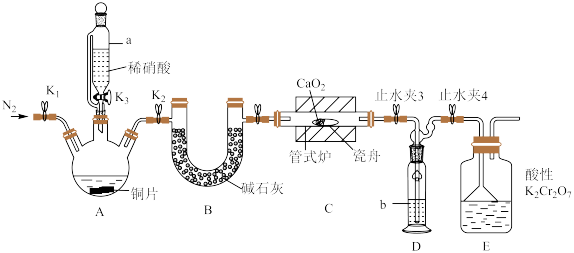
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: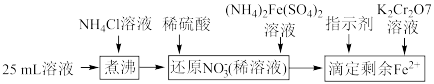
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
7日内更新
|
202次组卷
|
5卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
名校
解题方法
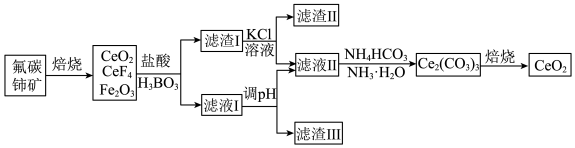
2 . 二氧化饰(CeO2)是一种重要的稀土氧化物,可以用于光催化降解有机污染物,利用氟碳饰矿(主要成分为CeCO3F,含Fe2O3、FeO等杂质)制CeOz的工艺流程如下:
②Ce3+在空气中易被氧化为Ce4+。
回答下列问题:
(1)CeCO3F中Ce元素的化合价为_______ 。
(2)焙烧氟碳铈矿时,提高焙烧效率的措施有_______ (写出两种),实验室进行焙烧操作时一般在_______ 中进行。
(3)CeCO3F在焙烧时发生反应的化学方程式为_______ 。
(4)上述流程中所加的盐酸要适当过量,其目的是_______ ,操作中可用硫酸和H2O2替换盐酸,其优点是_______ 。
(5)写出从滤液Ⅱ中沉淀铈的离子方程式:_______ 。
②Ce3+在空气中易被氧化为Ce4+。
回答下列问题:
(1)CeCO3F中Ce元素的化合价为
(2)焙烧氟碳铈矿时,提高焙烧效率的措施有
(3)CeCO3F在焙烧时发生反应的化学方程式为
(4)上述流程中所加的盐酸要适当过量,其目的是
(5)写出从滤液Ⅱ中沉淀铈的离子方程式:
您最近一年使用:0次
名校
解题方法
3 . 下列过程中的化学反应,相应的离子方程式书写正确的是
A.KClO与Fe(OH)3在碱性条件下反应制备K2FeO4:3ClO-+2Fe(OH)3=2 +3Cl-+4H++H2O +3Cl-+4H++H2O |
| B.向含lmolFeI2溶液中通入lmolCl2:2I-+Cl2=2Cl-+I2 |
C.电解MgCl2水溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑ |
D.NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性: +H++OH-+Ba2+=BaSO4↓+H2O +H++OH-+Ba2+=BaSO4↓+H2O |
您最近一年使用:0次
名校
解题方法
4 . 高砷烟尘(主要成分有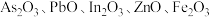 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为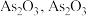 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为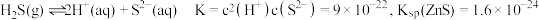 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用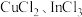 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
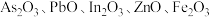 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: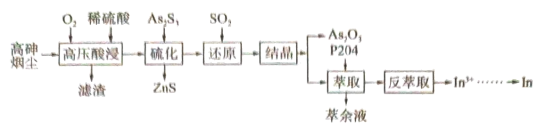
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为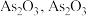 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为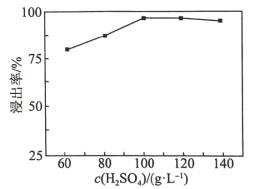
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为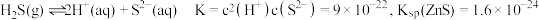 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用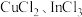 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2024-05-14更新
|
121次组卷
|
3卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
名校
解题方法
5 . 某铜矿石的主要成分为 ,还含有少量
,还含有少量 、
、 、
、 。工业上用该矿石获取铜和胆矾的操作流程如下:
。工业上用该矿石获取铜和胆矾的操作流程如下:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)实际生产中,将矿石粉碎为矿渣的目的是_______ 。
(2)固体混合物A中含有较多的铜,加入某试剂可以提纯铜。该反应的离子方程式为_______ 。
(3)反应I完成后的滤液中铁元素的存在形式为________ (填离子符号),检验该离子常用的试剂为_______ ,生成该离子的离子方程式为________ 。
(4)加入NaClO调节溶液pH可生成沉淀B,利用题中所给信息,沉淀B为_______ ,该反应中氧化剂与还原剂物质的量之比为________ 。
(5)加入NaOH调节pH,得到沉淀C,利用题中所给信息分析y的范围________ 。
(6)操作1主要包括:______ 、过滤、冷水洗涤得到 。
。
 ,还含有少量
,还含有少量 、
、 、
、 。工业上用该矿石获取铜和胆矾的操作流程如下:
。工业上用该矿石获取铜和胆矾的操作流程如下: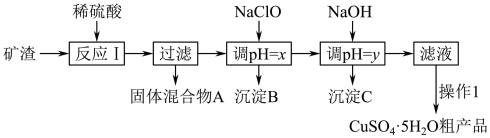

②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |  |  |  |  |
| 开始沉淀的pH | 5.4 | 4.0 | 2.7 | 5.8 |
| 沉淀完全的pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)实际生产中,将矿石粉碎为矿渣的目的是
(2)固体混合物A中含有较多的铜,加入某试剂可以提纯铜。该反应的离子方程式为
(3)反应I完成后的滤液中铁元素的存在形式为
(4)加入NaClO调节溶液pH可生成沉淀B,利用题中所给信息,沉淀B为
(5)加入NaOH调节pH,得到沉淀C,利用题中所给信息分析y的范围
(6)操作1主要包括:
 。
。
您最近一年使用:0次
解题方法
6 . 钉(Ru)为重要的稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为Ru、Pb、 、
、 ,回收钌的工艺流程如图:
,回收钌的工艺流程如图: 、
、 。
。
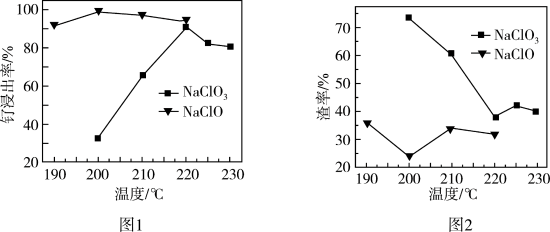
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为________ ;最佳反应温度为________ 。 。则“还原”过程中每生成
。则“还原”过程中每生成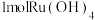 时,氧化剂和还原剂的物质的量之比为
时,氧化剂和还原剂的物质的量之比为________ 。
(3)“蒸馏”过程的化学反应方程式为________ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为________ 、________ 。
(5)可用氢还原重量法测定产品的纯度,其原理为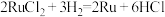 。实验所得数据记录如表,则产品的纯度为
。实验所得数据记录如表,则产品的纯度为________ 。
 、
、 ,回收钌的工艺流程如图:
,回收钌的工艺流程如图: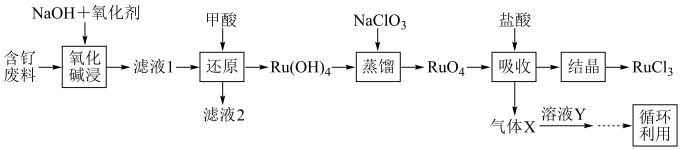
 、
、 。
。(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为
 。则“还原”过程中每生成
。则“还原”过程中每生成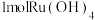 时,氧化剂和还原剂的物质的量之比为
时,氧化剂和还原剂的物质的量之比为(3)“蒸馏”过程的化学反应方程式为
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)可用氢还原重量法测定产品的纯度,其原理为
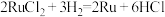 。实验所得数据记录如表,则产品的纯度为
。实验所得数据记录如表,则产品的纯度为实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.000 | 2.0210 |
② | 5.000 | 2.0190 |
③ | 5.000 | 2.0200 |
您最近一年使用:0次
解题方法
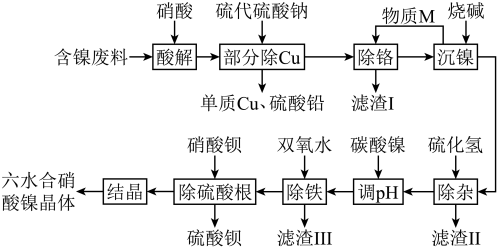
7 . NiCoCr-LDHs是一种新型吸附材料,可用作吸附剂去除水中的有机阴离子污染物,下面是利用含镍工业废料合成其重要原料Ni(NO3)2·6H2O的工艺流程。
a.Ksp[Ni(OH)₂]=2×10-15,Ksp[Cr(OH)₃]=6.3×10-31,镍的+2价较为稳定;
b.含镍废料中含有Ni、Cr、Fe、Cu、Zn、Pb的化合物,其中Cr元素的存在形式为+3价。
请回答下列问题:
(1)基态Ni的价电子排布式为___________ 。
(2)请写出“部分除Cu”工序中除铜的离子方程式:___________ 。
(3)M物质的加入主要是为了调节溶液的pH,则物质M是___________ 。
(4)滤渣Ⅱ的主要成分为ZnS和___________ 。
(5)“除铁”时双氧水的作用是___________ 。
(6)硝酸镍的阴离子的空间构型是___________ 。
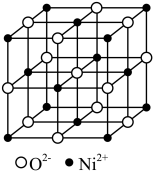
(7)Ni(NO3)2·6H2O经过灼烧可以生成一种Ni的氧化物,其晶胞结构如图。其中Ni的配位数为___________ 。已知该晶胞的晶胞参数均相同,晶胞内两个O原子的最短距离为apm,设NA为阿伏加德罗常数的值,则该晶体的密度为___________ g•cm-3(写出计算式即可)。
a.Ksp[Ni(OH)₂]=2×10-15,Ksp[Cr(OH)₃]=6.3×10-31,镍的+2价较为稳定;
b.含镍废料中含有Ni、Cr、Fe、Cu、Zn、Pb的化合物,其中Cr元素的存在形式为+3价。
请回答下列问题:
(1)基态Ni的价电子排布式为
(2)请写出“部分除Cu”工序中除铜的离子方程式:
(3)M物质的加入主要是为了调节溶液的pH,则物质M是
(4)滤渣Ⅱ的主要成分为ZnS和
(5)“除铁”时双氧水的作用是
(6)硝酸镍的阴离子的空间构型是
(7)Ni(NO3)2·6H2O经过灼烧可以生成一种Ni的氧化物,其晶胞结构如图。其中Ni的配位数为
您最近一年使用:0次
名校
8 . “纳米零价铁-H2O2”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为___________ ,该反应的还原产物是___________ (写化学式)。
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +___________ + Fe = Fe3+ +  + 4H2O
+ 4H2O
①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是___________ 。
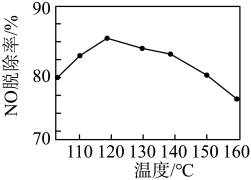
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是___________ 。___________ (填化学式),写出该物质的一种用途___________ 。
 。
。(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +
 + 4H2O
+ 4H2O①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是
您最近一年使用:0次
名校
9 . I.神舟十七号载人航天飞船于2023年10月26日成功发射,飞船搭载的是中国研制的长征二号F遥十七运载火箭,采用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作为推进剂,二者反应生成二氧化碳、水蒸气和氮气。
(1)偏二甲肼的摩尔质量为___________ 。
(2)四氧化二氮能与水反应生成亚硝酸和___________ (写化学式)。
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是___________ 。
(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为___________ 。
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是___________ 。
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为___________ 。
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为___________ 。
(1)偏二甲肼的摩尔质量为
(2)四氧化二氮能与水反应生成亚硝酸和
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2
 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为
您最近一年使用:0次
名校
解题方法
10 . 碱式氧化镍是镍电池的正极活性材料。利用镍渣(主要含NiO,及少量 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下:
(2)浸渣的主要成分是_______ 。
(3)“沉铜”过程中生成单质S的离子方程式为______ 。
(4)“氧化”中的目的是将 氧化为
氧化为 ,试剂R可选用
,试剂R可选用_____ (填标号)。写出“氧化”时反应的离子方程式:_____ 。
A.氯水 B. 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为
 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为_____ %。
 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下: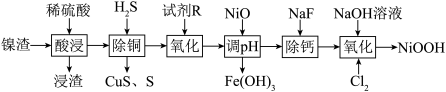
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(2)浸渣的主要成分是
(3)“沉铜”过程中生成单质S的离子方程式为
(4)“氧化”中的目的是将
 氧化为
氧化为 ,试剂R可选用
,试剂R可选用A.氯水 B.
 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为

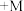 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为
您最近一年使用:0次
2024-05-03更新
|
251次组卷
|
2卷引用:广东省深圳市翠园中学、龙城高级中学2023-2024学年高一下学期第一次月考化学试题



