名校
解题方法
1 . 亚硝酸钙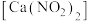 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应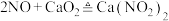 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质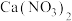 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: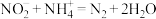 ;“还原
;“还原 ”时加入
”时加入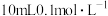 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
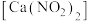 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应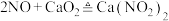 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。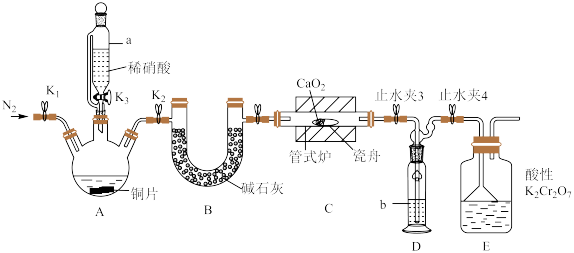
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质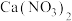 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: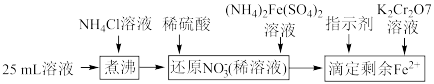
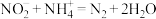 ;“还原
;“还原 ”时加入
”时加入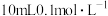 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
2024-05-23更新
|
224次组卷
|
5卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
解题方法
2 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
Ⅰ. 的制备:
的制备:
(1)装置A中的仪器名称分别是______ ,仪器按气流方向连接顺序为b→______ 。
(2)反应开始前打开止水夹a,通入过量氮气的目的是______ ;反应结束后打开止水夹a,再通入过量氮气的目的是______ 。
(3)装置D的作用是______ 。
(4)判断 已被NO反应完全的现象是
已被NO反应完全的现象是______ 。
Ⅱ.
(5)写出实验室制氨气的化学方程式______ 。
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为______ %。
 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。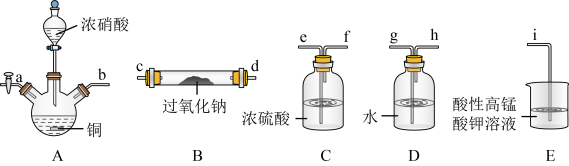
②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
Ⅰ.
 的制备:
的制备:(1)装置A中的仪器名称分别是
(2)反应开始前打开止水夹a,通入过量氮气的目的是
(3)装置D的作用是
(4)判断
 已被NO反应完全的现象是
已被NO反应完全的现象是Ⅱ.
(5)写出实验室制氨气的化学方程式
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入
 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为
您最近一年使用:0次
名校
解题方法
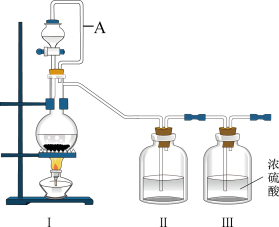
3 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组同学拟用同一装置Ⅰ、Ⅱ、Ⅲ分别制备纯净干燥的NO和
_______ 。写出该装置制备氯气的离子方程式:_______ 。
(2)乙组同学利用甲组制得的NO和 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:________ 。
②装置连接顺序为a→________ (按气流自左向右方向,用小写字母表示)。
③装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为_______ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为______ 。
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00 mL,用c mol/L 溶液反应,消耗
溶液反应,消耗 溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为________ (用代数式表示即可)。
(1)甲组同学拟用同一装置Ⅰ、Ⅱ、Ⅲ分别制备纯净干燥的NO和

(2)乙组同学利用甲组制得的NO和
 制备NOCl,装置如图所示:
制备NOCl,装置如图所示: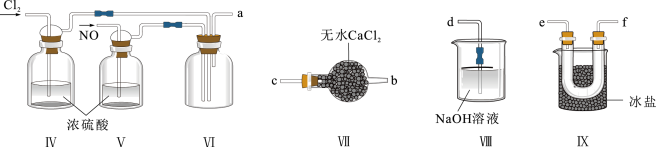
②装置连接顺序为a→
③装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00 mL,用c mol/L
 溶液反应,消耗
溶液反应,消耗 溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次
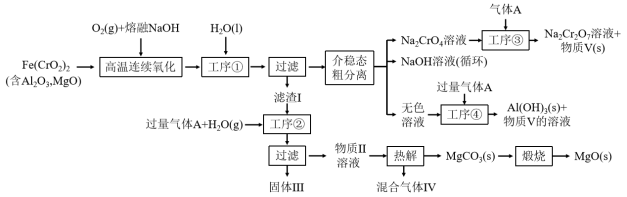
4 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是_______ (填元素符号),Cr元素在元素周期表中的位置_______ ,
(2)滤渣I的主要成分是_______ (填化学式)。
(3)工序③中发生反应的离子方程式为_______ 。
(4)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为_____ 。钠在火焰上灼烧产生的黄光是一种_______ (填“吸收光谱” 或“发射光谱”)。
(5)工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;A1(OH)3+OH-⇌Al(OH) :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
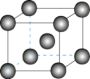
(6)基态Al原子的核外电子排布式为_______ 。Fe的晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,若晶胞参数为a nm,则Fe晶胞的密度为_______ g•cm-3(用含NA和a的代数式表示)。

回答下列问题:
(1)高温连续氧化工序中被氧化的元素是
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为
(5)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)(6)基态Al原子的核外电子排布式为

您最近一年使用:0次
名校
解题方法
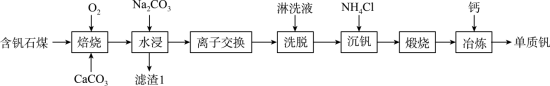
5 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是V2O3、V2O4,含有的杂质有SiO2、FeS2及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
②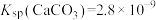 ,
,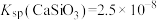 ,
,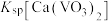 远大于
远大于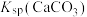 。
。
回答下列问题:
(1)基态Fe3+的价电子排布式为___________ 。
(2)为了提高“焙烧”效率,可采取的措施有___________ 、___________ 。
(3)“焙烧”时,V2O3、V2O4都转化为Ca(VO3)3,写出V2O4转化为Ca(VO3)3的化学方程式:___________ 。
(4)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有___________ ;“水浸”加入过量Na2CO3不能使CaSiO3完全转化为CaCO3,原因是___________ 。(列式计算平衡常数分析该反应进行的趋势,一般认为,K>105时反应进行较完全,K<10-5时反应难以进行)
(5)“离子交换”与“洗脱”可表示为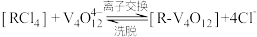 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,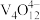 为VO
为VO 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用___________ 。
(6)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是___________ 。
(7)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。

已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
| 金属离子 | Fe3+ | Mg2+ | Al3+ | Mn2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
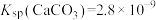 ,
,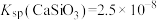 ,
,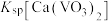 远大于
远大于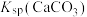 。
。回答下列问题:
(1)基态Fe3+的价电子排布式为
(2)为了提高“焙烧”效率,可采取的措施有
(3)“焙烧”时,V2O3、V2O4都转化为Ca(VO3)3,写出V2O4转化为Ca(VO3)3的化学方程式:
(4)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有
(5)“离子交换”与“洗脱”可表示为
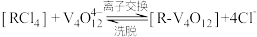 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,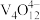 为VO
为VO 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(6)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是
(7)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
名校
解题方法
6 . I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原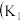 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: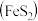 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
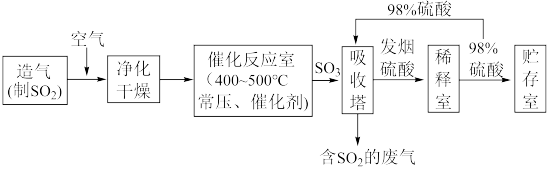
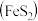 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
2024-02-24更新
|
716次组卷
|
4卷引用:广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
7 . 含铬电镀废水的主要成分如表,常用“Pb2+沉淀法”和“药剂还原沉淀法”进行处理。
I. “Pb2+沉淀法”工艺流程如图。 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。
(1)铬元素的价电子排布式:_______ 。已知金属铬为体心立方晶体,密度为7.2g/cm3,求两个Cr原子的最小核间距_______ nm。(只写表达式,不计算)
(2)“氧化”过程中Cr(OH)3转化为 的离子方程式为
的离子方程式为_______ 。
(3)“沉降”过程中应调节pH范围是_______ ~10.5。
(4)已知25℃是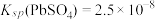 ;
;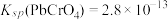 ;
; 。“沉铬”过程中:
。“沉铬”过程中:
①生成铬黄的离子方程式为_______ 。
②从平衡角度分析pH对沉铬率的影响_______ 。
II. “药剂还原沉淀法”工艺流程如图。 被Cr(VI)氧化为
被Cr(VI)氧化为_______ 。
(6)“沉淀”过程中,当溶液pH为8.6时,
_______  。
。
| 离子 | Cr(VI) | Cr3+ | Cu2+ | Fe2+ | Zn2+ |
| 含量mg/L | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |
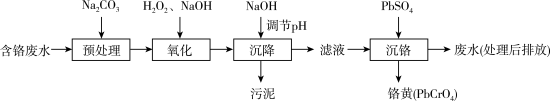
 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Zn2+ | Cr3+ | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | — | 13.5 | 14.0 | 10.5 | 12.0 | |
(2)“氧化”过程中Cr(OH)3转化为
 的离子方程式为
的离子方程式为(3)“沉降”过程中应调节pH范围是
(4)已知25℃是
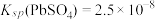 ;
;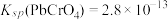 ;
; 。“沉铬”过程中:
。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉铬率的影响
II. “药剂还原沉淀法”工艺流程如图。
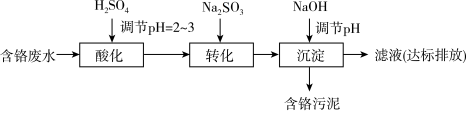
 被Cr(VI)氧化为
被Cr(VI)氧化为(6)“沉淀”过程中,当溶液pH为8.6时,

 。
。
您最近一年使用:0次
名校
解题方法
8 . 某小组利用如图所示装置制备并收集TiCl4(夹持装置略去),并测定由TiCl4制备的纳米xTiO2•yH2O的组成。
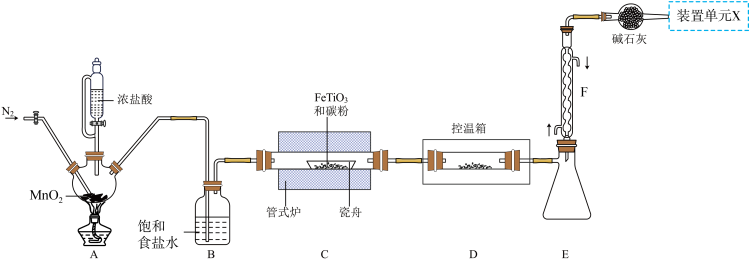
已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是_______ 。
(2)写出A中反应的化学方程式_______ ;上述装置存在一处缺陷,会导致TiCl4产率降低,改进的方法是_______ 。
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为_______ 。
(4)装置E、F的作用为_______ 。
(5)设计实验测定纳米xTiO2•yH2O组成。
已知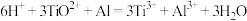 ,
,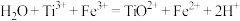
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在_______ 滴定管(填“酸式”、“碱式”),用_______ 做指示剂,平均消耗标准溶液20.00mL,则xTiO2•yH2O的化学式为_______ 。

已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
TiCl4 | FeCl3 | CCl4 | |
熔点/℃ |
| 306 |
|
沸点/℃ | 136.4 | 315 | 76.8 |
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是
(2)写出A中反应的化学方程式
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为
(4)装置E、F的作用为
(5)设计实验测定纳米xTiO2•yH2O组成。
已知
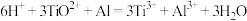 ,
,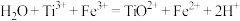
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000
 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000
 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
您最近一年使用:0次
2024-02-19更新
|
909次组卷
|
3卷引用:广东省云浮市云安区云安中学2023-2024学年高三下学期3月考试化学试题
广东省云浮市云安区云安中学2023-2024学年高三下学期3月考试化学试题(已下线)2024届广东省华南师范大学附属中学 广雅中学 深圳中学 广东实验中学高三上学期四校联考化学试题湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
名校
解题方法
9 . 过氧化氢是重要的化工产品,广泛应用于绿色化学合成,医疗消毒等领域。
(1) 的
的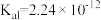 ,
, 的酸性
的酸性___________  (填“>”、“<”或“=”;研究表明,过氧化氢溶液中
(填“>”、“<”或“=”;研究表明,过氧化氢溶液中 的浓度越大,
的浓度越大, 的分解速率越快。常温下,一定浓度的
的分解速率越快。常温下,一定浓度的 ,若
,若 增大,则
增大,则 分解速率增大,原因是
分解速率增大,原因是___________ 。
(2)早期制备方法:
①II为可逆反应,促进该反应正向进行的措施是___________ 。(写一条)
②Ⅲ中生成 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(3) 可对烟气中
可对烟气中 、
、 进行协同脱除。
进行协同脱除。
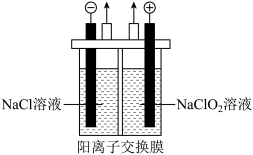
①电解 溶液制备
溶液制备 气体的装置如图所示。
气体的装置如图所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为___________ 。
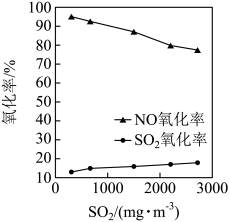
②保持其他条件不变,调节烟气中 初始浓度,将烟气按一定流速通入反应器与
初始浓度,将烟气按一定流速通入反应器与 反应,测得
反应,测得 、
、 氧化率随
氧化率随 初始浓度的变化如图所示。
初始浓度的变化如图所示。 氧化率始终低于NO氧化率的原因可能是
氧化率始终低于NO氧化率的原因可能是________ 。
(4)甲醇( )是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
)是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
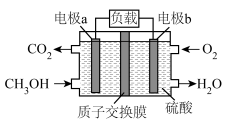
①a电极是电池的___________ (填“正”或“负”)极。
②b电极的电极反应式为___________ 。
(5)现有25℃时等浓度的5种溶液:A. ;B.
;B.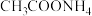 ;C.
;C.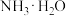 ;D.
;D.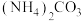 ;E.
;E.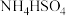 ,这5种溶液中
,这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:___________ (填字母)。
(1)
 的
的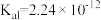 ,
, 的酸性
的酸性 (填“>”、“<”或“=”;研究表明,过氧化氢溶液中
(填“>”、“<”或“=”;研究表明,过氧化氢溶液中 的浓度越大,
的浓度越大, 的分解速率越快。常温下,一定浓度的
的分解速率越快。常温下,一定浓度的 ,若
,若 增大,则
增大,则 分解速率增大,原因是
分解速率增大,原因是(2)早期制备方法:

①II为可逆反应,促进该反应正向进行的措施是
②Ⅲ中生成
 ,反应的化学方程式是
,反应的化学方程式是(3)
 可对烟气中
可对烟气中 、
、 进行协同脱除。
进行协同脱除。①电解
 溶液制备
溶液制备 气体的装置如图所示。
气体的装置如图所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
②保持其他条件不变,调节烟气中
 初始浓度,将烟气按一定流速通入反应器与
初始浓度,将烟气按一定流速通入反应器与 反应,测得
反应,测得 、
、 氧化率随
氧化率随 初始浓度的变化如图所示。
初始浓度的变化如图所示。 氧化率始终低于NO氧化率的原因可能是
氧化率始终低于NO氧化率的原因可能是
(4)甲醇(
 )是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
)是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
①a电极是电池的
②b电极的电极反应式为
(5)现有25℃时等浓度的5种溶液:A.
 ;B.
;B.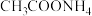 ;C.
;C.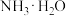 ;D.
;D.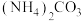 ;E.
;E.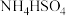 ,这5种溶液中
,这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:
您最近一年使用:0次
名校
解题方法
10 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
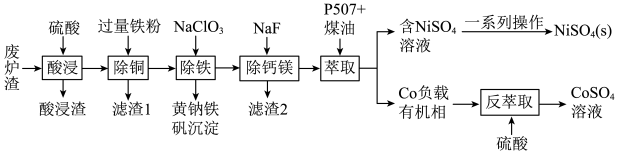
已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是___________ 。(写化学式)
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F-)最小为___________ mol·L-1。[已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,Ksp(CaF2)=1.0×10-10(mol/L)3,Ksp(MgF2)=7.5×10-11(mol/L)3]
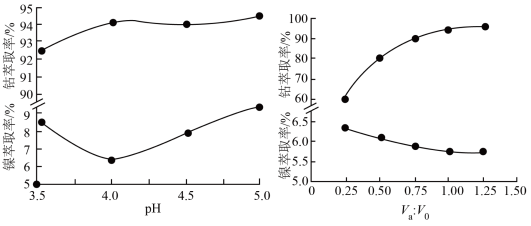
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为___________ 、___________ 。
(5)获得NiSO4(s)的“一系列操作”是___________ 。
(6)该工艺流程中,可循环利用的物质是___________ 。

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为

(5)获得NiSO4(s)的“一系列操作”是
(6)该工艺流程中,可循环利用的物质是
您最近一年使用:0次
2023-12-27更新
|
596次组卷
|
4卷引用:广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题
广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题山东省实验中学2023-2024学年高三上学期11月二诊化学试题山东省淄博市部分学校2023-2024学年高三上学期联考化学试卷(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)

 23.2
23.2

