名校
解题方法
1 . 如图为元素周期表的一部分,请参照a~h在表中的位置,回答下列问题:
(1)g在周期表中的位置是___________ 。
(2)元素d、g、h形成的简单离子中,离子半径最大的是___________ 。(填离子符号)
(3)元素c和元素f形成的化合物的化学式为___________ ,化学键为___________ 。
(4)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号。已知Te与S元素同主族。
①碲及其化合物可能具有的性质为___________ (填标号)。
A.单质Te在常温下是固体
B.H2Te比H2O稳定
C.H2TeO4的酸性比H2SO4的弱
D.Cl2通入H2Te溶液中不发生反应
E.Te元素位于周期表中第六周期
②TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。写出TeO2与过量NaOH溶液反应的离子方程式___________ 。
③工业上,把SO2通入TeCl4溶液中,可得到Te,该反应的化学方程式是___________ 。
| a | |||||||||
| b | c | d | |||||||
| e | f | g | h |
(2)元素d、g、h形成的简单离子中,离子半径最大的是
(3)元素c和元素f形成的化合物的化学式为
(4)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号。已知Te与S元素同主族。
①碲及其化合物可能具有的性质为
A.单质Te在常温下是固体
B.H2Te比H2O稳定
C.H2TeO4的酸性比H2SO4的弱
D.Cl2通入H2Te溶液中不发生反应
E.Te元素位于周期表中第六周期
②TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。写出TeO2与过量NaOH溶液反应的离子方程式
③工业上,把SO2通入TeCl4溶液中,可得到Te,该反应的化学方程式是
您最近一年使用:0次
名校
2 . Ⅰ.用如图所示的装置测定中和反应的反应热。____ ,其能否用铜质材料替代?____ (填“能”或“不能”)。
(2)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:
 的
的
_______ (保留一位小数)。
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为_______ mL。
根据表中数据计算可得该NaOH溶液的物质的量浓度为_______ (保留四位有效数字) 。
。
(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。
(6)写出滴定的离子方程式:_______ 。
(7)用酸性 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在_______ (填“酸式”或“碱式”)滴定管中,滴定终点的现象是_______ 。

(2)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:| 反应物 | 起始温度 /℃ /℃ | 最高温度 /℃ /℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
 的
的
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 硫酸的体积/mL 硫酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 。
。(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始时仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的
 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。(6)写出滴定的离子方程式:
(7)用酸性
 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在
您最近一年使用:0次
3 . Mo和Ni为重要战略性金属,从废钼催化剂(主要成分为 、
、 少量NiS、NiO、
少量NiS、NiO、 等)中回收有价金属的工艺流程如图所示:
等)中回收有价金属的工艺流程如图所示:
①“沉钼”前钼元素主要以 形式存在。
形式存在。
②常温下,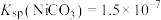 ,
,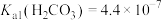 ,
,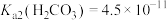 ,
,
③
④金属离子开始沉淀和完全沉淀时pH范围:
请回答
(1)“焙烧”过程中采用多层逆流(空气从炉底进入,固体粉末从炉顶投入),该操作的优点为___________ 。写出在“焙烧”过程中 被氧化的化学方程式:
被氧化的化学方程式:___________ 。
(2)“除铁”时调节溶液pH范围是___________ ;已知“沉镍”所得滤液的 ,则滤液中
,则滤液中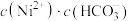 约为
约为___________ 
(3)写出“沉钼”时的离子方程式:___________ 。
(4) 与丁二酮(
与丁二酮( )反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验
)反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验 ,丁二酮肟中的碳氮双键是由
,丁二酮肟中的碳氮双键是由___________ 轨道重叠而成的(填字母)。
A. 和
和 B.sp和
B.sp和 C.sp和2p D.2p和2p E.
C.sp和2p D.2p和2p E. 和2p
和2p
(5)氮化钼量子点可应用于电池及催化领域,其晶胞结构如图所示,氮化钼的化学式为___________ 。若晶胞密度为 ,则晶胞参数a=
,则晶胞参数a=___________ nm。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 、
、 少量NiS、NiO、
少量NiS、NiO、 等)中回收有价金属的工艺流程如图所示:
等)中回收有价金属的工艺流程如图所示: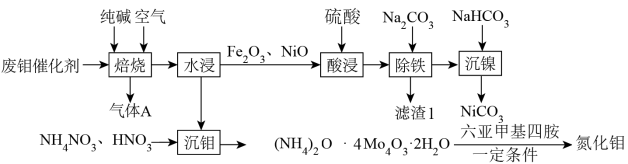
①“沉钼”前钼元素主要以
 形式存在。
形式存在。②常温下,
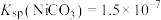 ,
,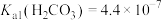 ,
,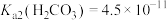 ,
,③

④金属离子开始沉淀和完全沉淀时pH范围:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 2.7 | 3.7 |
 | 7.1 | 9.2 |
(1)“焙烧”过程中采用多层逆流(空气从炉底进入,固体粉末从炉顶投入),该操作的优点为
 被氧化的化学方程式:
被氧化的化学方程式:(2)“除铁”时调节溶液pH范围是
 ,则滤液中
,则滤液中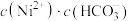 约为
约为
(3)写出“沉钼”时的离子方程式:
(4)
 与丁二酮(
与丁二酮( )反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验
)反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验 ,丁二酮肟中的碳氮双键是由
,丁二酮肟中的碳氮双键是由A.
 和
和 B.sp和
B.sp和 C.sp和2p D.2p和2p E.
C.sp和2p D.2p和2p E. 和2p
和2p(5)氮化钼量子点可应用于电池及催化领域,其晶胞结构如图所示,氮化钼的化学式为
 ,则晶胞参数a=
,则晶胞参数a= 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
名校
解题方法
4 . 有机物G是合成中草药活性成分Psoralidin的中间体,其合成路线如下: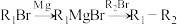

(1)化合物A的名称为___________ ;C中官能团的名称为___________ 。
(2)D的结构简式为___________ 。
(3)根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
(4)下列关于反应F→G的说法中,正确的有___________
(5)写出一个满足下列条件的C的同分异构体___________ 。
①与 溶液反应显紫色
溶液反应显紫色
②核磁共振氢谱显示5组峰,且峰面积之比为2:2:2:1:1
(6)K的结构简式为___________ 。
②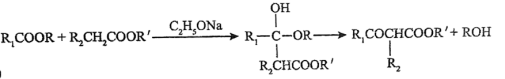

(1)化合物A的名称为
(2)D的结构简式为
(3)根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
| A |  ,催化剂 ,催化剂 | ||
| B | 氧化反应(生成有机产物) |
| A.反应过程中有极性键、非极性键的断裂和形成 |
| B.化合物F存在顺反异构体 |
| C.该反应有乙醇生成 |
| D.化合物G中碳原子的杂化方式有两种 |
①与
 溶液反应显紫色
溶液反应显紫色②核磁共振氢谱显示5组峰,且峰面积之比为2:2:2:1:1
(6)K的结构简式为
您最近一年使用:0次
名校
解题方法
5 . 为实现“碳中和”“碳达峰”,碳的循环利用是重要措施。利用氢气和CO反应生成甲烷,涉及的反应如下:
i.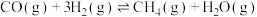

ii.

iii.

回答下列问题:
(1)在25℃和101kPa下, 转变为
转变为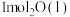 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
________  。
。
(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。 选择性变化的曲线是
选择性变化的曲线是________ (填“甲”或“乙”),保持 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为________ 。
②相同温度下,向恒容容器内加入 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为________ mol,反应ii的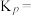
________ (保留小数点后一位)。
(3) 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共________ 种, 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为________ 。
i.
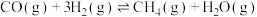

ii.


iii.


回答下列问题:
(1)在25℃和101kPa下,
 转变为
转变为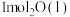 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
 。
。(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及
 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。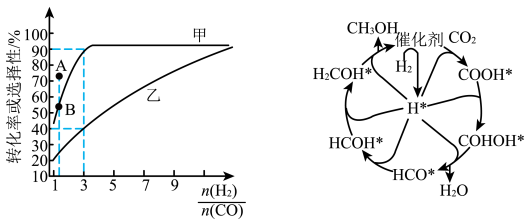
 选择性变化的曲线是
选择性变化的曲线是 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为②相同温度下,向恒容容器内加入
 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为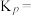
(3)
 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为
您最近一年使用:0次
2024-06-08更新
|
225次组卷
|
7卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
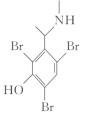
6 . 卡巴拉汀(化合物x)可用于轻、中度老年痴呆症的治疗,其一种合成路线如图所示(加料顺序、反应条件略):
(1)化合物i的分子式为________________ ,所含官能团的名称为_________________ ;芳香化合物a为i的同分异构体,含有一个手性碳且能与银氨溶液发生银镜反应,a的结构简式为________________ 。
(2)根据化合物ii的结构特征,分析预测其可能的化学性质,完成下表。
(3)反应③中仅生成两种化合物,除化合物vii外另一种化合物为________________ (填结构简式)。
(4)下列关于反应⑥的说法正确的是________________(填选项字母)。
(5)以甲酸甲酯、苯酚、碳酰氯(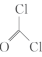 )和甲胺(
)和甲胺( )为原料,利用上述有机合成路线
)为原料,利用上述有机合成路线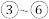 的原理,合成化合物
的原理,合成化合物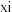 (
(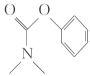 )。
)。
①第一步涉及甲酸甲酯与甲胺的反应,其化学方程式为____________________ (反应条件省略不写).
②若最后一步有苯酚参与反应,则另一有机反应物为________________ (填结构简式),另一种产物为________________ (填化学式)。
(1)化合物i的分子式为
(2)根据化合物ii的结构特征,分析预测其可能的化学性质,完成下表。
序号 | 反应试剂、条件 | 生成有机物的结构简式 | 反应类型 |
a |
| ||
b | 加成反应 |
(4)下列关于反应⑥的说法正确的是________________(填选项字母)。
A.反应过程中,有 键和 键和 键断裂 键断裂 | B.反应物iv中,O和N原子均有孤对电子 |
C.电离出 的能力: 的能力: | D.化合物X能与水形成氢键,易溶于水 |
 )和甲胺(
)和甲胺(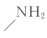 )为原料,利用上述有机合成路线
)为原料,利用上述有机合成路线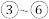 的原理,合成化合物
的原理,合成化合物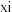 (
( )。
)。①第一步涉及甲酸甲酯与甲胺的反应,其化学方程式为
②若最后一步有苯酚参与反应,则另一有机反应物为
您最近一年使用:0次
2024-06-05更新
|
229次组卷
|
4卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
名校
7 . 水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:
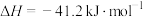
该反应分两步完成:
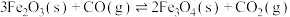
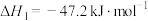
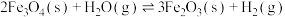

请回答:
(1)
_____________  。
。
(2)恒定总压1.70MPa和水碳比[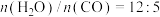 ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
①在条件1下,水煤气变换反应的平衡常数K=___________ 。
②对比条件1,条件2中 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式___________ 。
(3)下列说法正确的是 。
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。_____________ 。
C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线_____________ 。________________ 。
水煤气变换反应:

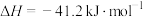
该反应分两步完成:
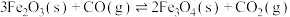
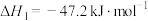
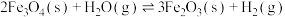

请回答:
(1)

 。
。(2)恒定总压1.70MPa和水碳比[
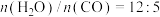 ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
|
|
| |
条件1 | 0.40 | 0.40 | 0 |
条件2 | 0.42 | 0.36 | 0.02 |
②对比条件1,条件2中
 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式(3)下列说法正确的是 。
A.通入反应器的原料气中应避免混入 |
B.恒定水碳比[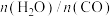 ],增加体系总压可提高 ],增加体系总压可提高 的平衡产率 的平衡产率 |
C.通入过量的水蒸气可防止 被进一步还原为Fe 被进一步还原为Fe |
| D.通过充入惰性气体增加体系总压,可提高反应速率 |
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。

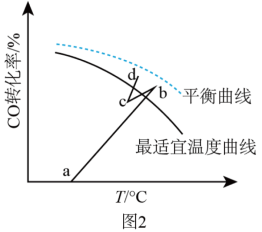
C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线

您最近一年使用:0次
8 .  均是重要的战略性金属。从处理后的矿石硝酸浸取液(含
均是重要的战略性金属。从处理后的矿石硝酸浸取液(含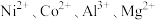 )中,利用氨浸工艺可提取
)中,利用氨浸工艺可提取 ,并获得高附加值化工产品。工艺流程如下:
,并获得高附加值化工产品。工艺流程如下: 、
、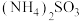 和
和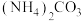 配制。常温下,
配制。常温下,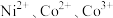 与
与 形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7;
形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。回答下列问题:
如下表。回答下列问题:
(1)活性 可与水反应,化学方程式为
可与水反应,化学方程式为_______ 。
(2)常温下, 的氨性溶液中,
的氨性溶液中,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)“氨浸”时,由 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
(4)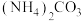 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了
会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了 的明锐衍射峰。
的明锐衍射峰。
① 属于
属于_______ (填“晶体”或“非晶体”)。
②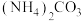 提高了
提高了 的浸取速率,其原因是
的浸取速率,其原因是_______ 。
(5)①“析晶”过程中通入的酸性气体A为_______ 。 溶液中
溶液中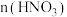 与
与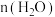 的比值,理论上最高为
的比值,理论上最高为_______ 。
②“热解”对于从矿石提取 工艺的意义,上面工艺中可重复利用的物质
工艺的意义,上面工艺中可重复利用的物质_______ 和_______ (填化学式)。
 均是重要的战略性金属。从处理后的矿石硝酸浸取液(含
均是重要的战略性金属。从处理后的矿石硝酸浸取液(含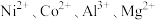 )中,利用氨浸工艺可提取
)中,利用氨浸工艺可提取 ,并获得高附加值化工产品。工艺流程如下:
,并获得高附加值化工产品。工艺流程如下:
 、
、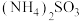 和
和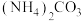 配制。常温下,
配制。常温下,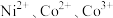 与
与 形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7;
形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。回答下列问题:
如下表。回答下列问题:| 氢氧化物 |  |  |  |  |  |
 | 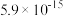 |  |  | 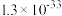 | 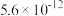 |
(1)活性
 可与水反应,化学方程式为
可与水反应,化学方程式为(2)常温下,
 的氨性溶液中,
的氨性溶液中,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)“氨浸”时,由
 转化为
转化为 的离子方程式为
的离子方程式为(4)
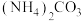 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了
会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了 的明锐衍射峰。
的明锐衍射峰。①
 属于
属于②
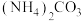 提高了
提高了 的浸取速率,其原因是
的浸取速率,其原因是(5)①“析晶”过程中通入的酸性气体A为
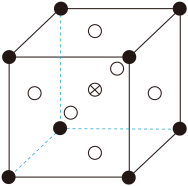
②由 可制备
可制备 晶体,其立方晶胞如图。
晶体,其立方晶胞如图。 与
与 最小间距小于
最小间距小于 与
与 最小间距,x、y为整数,则
最小间距,x、y为整数,则 在晶胞中的位置为
在晶胞中的位置为 周围与其最近的
周围与其最近的 的个数为
的个数为
 溶液中
溶液中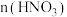 与
与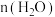 的比值,理论上最高为
的比值,理论上最高为②“热解”对于从矿石提取
 工艺的意义,上面工艺中可重复利用的物质
工艺的意义,上面工艺中可重复利用的物质
您最近一年使用:0次
9 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a) CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ∆H1
b) CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ∆H2
c) CH4(g) ⇌ C(s)+2H2(g) ∆H3
d) 2CO(g) ⇌ CO2(g)+C(s) ∆H4
e) CO(g)+H2(g) ⇌ H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=___________ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。
①反应a、c、e中,属于吸热反应的有___________ (填字母)。
②反应c的相对压力平衡常数表达式为K =
=___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a) CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ∆H1
b) CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ∆H2
c) CH4(g) ⇌ C(s)+2H2(g) ∆H3
d) 2CO(g) ⇌ CO2(g)+C(s) ∆H4
e) CO(g)+H2(g) ⇌ H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| B.移去部分C(s),反应c、d、e的平衡均向右移动 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分
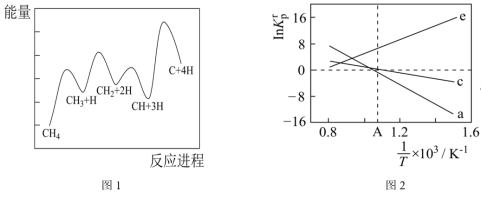
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为K
 =
=(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
名校
解题方法
10 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。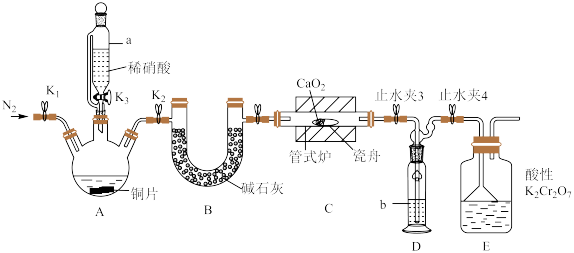
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: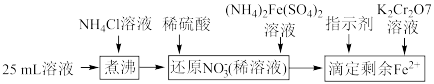
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
2024-06-01更新
|
297次组卷
|
7卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷

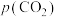 /MPa
/MPa /MPa
/MPa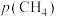 /MPa
/MPa

