1 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和 内循环。工艺流程如下:
内循环。工艺流程如下:
(1)Al在元素周期表中的位置为___________ ;“高温连续氧化”过程中发生的氧化还原反应的化学方程式是___________ 。
(2)“固体III”的主要成分是___________ (填化学式)。
(3)已知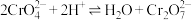 ,则“工序③”中通入
,则“工序③”中通入___________ (填“足量”或“少量”)的气体A更有利于得到重铬酸盐;流程中可以循环使用的物质除气体A外还有___________ (填化学式)。
(4)“工序④”中发生反应的离子方程式为___________ ;常温常压下,“工序④”的溶液中铝元素恰好完全转化为沉淀的pH为8.37,则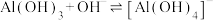

___________ 。(通常认为溶液中离子浓度小于 时沉淀完全)
时沉淀完全)
 内循环。工艺流程如下:
内循环。工艺流程如下: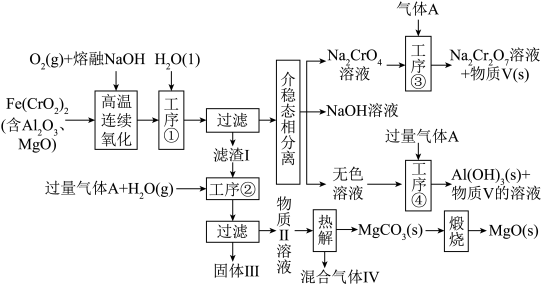
(1)Al在元素周期表中的位置为
(2)“固体III”的主要成分是
(3)已知
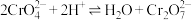 ,则“工序③”中通入
,则“工序③”中通入(4)“工序④”中发生反应的离子方程式为
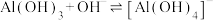

 时沉淀完全)
时沉淀完全)
您最近一年使用:0次
解题方法
2 . 研究CO2资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。
(1)已知:
Ⅰ.
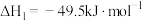
Ⅱ.
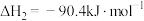
Ⅲ.

①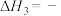
_______ 
②一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2,发生上述反应,达到平衡时,容器中CH3OH(g)的物质的量为0.5mol;CO的物质的量为0.3mol;此时H2O(g)的浓度为_______ mol·L-1。
(2)CO2在Cu—ZnO催化下,同时发生反应Ⅰ、Ⅲ;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2;起始及达到平衡时(t min时恰好达到平衡);容器内各气体物质的量及总压强如下表:
若反应Ⅰ、Ⅲ均达到平衡时,p0=1.4p;则表中n=_______ ;0~t min内,CO2的分压变化率为_______ kPa·min⁻¹;反应Ⅰ的平衡常数Kp=_______ (kPa)-2(用含p的式子表示)。
(3)CO2催化加氢制甲烷涉及的反应主要有:
主反应:
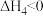
副反应:

若将CO2和H2按体积比为1∶4混合(n总=5mol);匀速通入装有催化剂的反应容器中,发生反应(包括主反应和副反应)。反应相同时间,CO2转化率、CH4和CO选择性随温度变化的曲线分别如图所示。
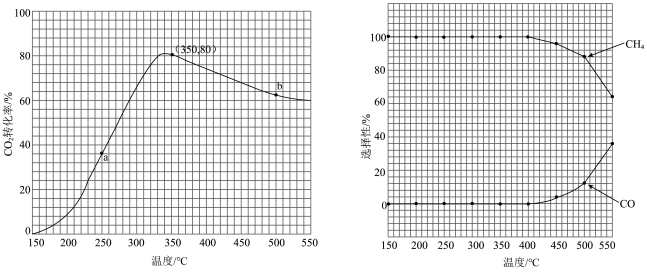
①a点的正反应速率和逆反应速率的大小关系为v正(a)_______ (填“>”、“=”或“<”)v逆(a)。
②催化剂在较低温度时主要选择_______ (填“主反应”或“副反应”)。
③350~400℃;CO2转化率呈现减小的变化趋势,其原因是_______ 。
(1)已知:
Ⅰ.

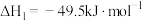
Ⅱ.

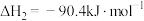
Ⅲ.


①
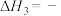

②一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2,发生上述反应,达到平衡时,容器中CH3OH(g)的物质的量为0.5mol;CO的物质的量为0.3mol;此时H2O(g)的浓度为
(2)CO2在Cu—ZnO催化下,同时发生反应Ⅰ、Ⅲ;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2;起始及达到平衡时(t min时恰好达到平衡);容器内各气体物质的量及总压强如下表:
| 物质的量/mol | 总压强/kPa | |||||
| CO2 | H2 | CH3OH(g) | CO | H2O(g) | ||
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 | p0 |
| 平衡 | n | 0.3 | p | |||
(3)CO2催化加氢制甲烷涉及的反应主要有:
主反应:

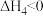
副反应:


若将CO2和H2按体积比为1∶4混合(n总=5mol);匀速通入装有催化剂的反应容器中,发生反应(包括主反应和副反应)。反应相同时间,CO2转化率、CH4和CO选择性随温度变化的曲线分别如图所示。

①a点的正反应速率和逆反应速率的大小关系为v正(a)
②催化剂在较低温度时主要选择
③350~400℃;CO2转化率呈现减小的变化趋势,其原因是
您最近一年使用:0次
2023-09-09更新
|
266次组卷
|
4卷引用:青海省海东市名校2023-2024学年高三上学期9月联考化学试题
3 . 常温下,向20mL0.1mol·L-1CH3COONa溶液中滴入等浓度的HCOOH溶液,所得溶液中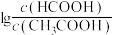 与
与 的关系如图所示。已知
的关系如图所示。已知 ,下列说法错误的是
,下列说法错误的是

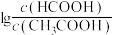 与
与 的关系如图所示。已知
的关系如图所示。已知 ,下列说法错误的是
,下列说法错误的是
A.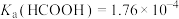 |
B.滴入20mLHCOOH溶液后,溶液中存在: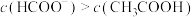 |
C.随着HCOOH溶液的加入, 逐渐增大 逐渐增大 |
D.滴入20mLHCOOH溶液后,溶液中存在: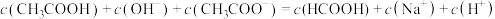 |
您最近一年使用:0次
2023-09-09更新
|
375次组卷
|
6卷引用:青海省海东市名校2023-2024学年高三上学期9月联考化学试题
解题方法
4 . 有机合成帮助人们发现和制备一系列药物、香料、染料、催化剂等,有力地推动了生命科学和材料科学的发展。有机化合物是合成药品的重要中间体,其合成路线如图所示:

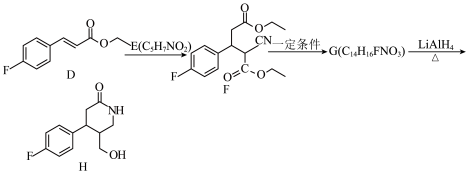
已知: 。
。
(1)A的名称为___________ ,D中的含氧官能团的名称是___________ 。
(2)E的结构简式为___________ ;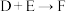 的反应类型为
的反应类型为___________ 。
(3)A→B反应的化学方程式为___________ ,A→B的反应实质是两步反应,第一步反应为加成反应,则第一步反应的产物结构简式为___________ 。
(4)C的同分异构体中仅含有 、
、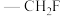 和苯环结构(不含其他环状结构)的有
和苯环结构(不含其他环状结构)的有___________ 种;其中核磁共振氢谱有四组峰,且峰面积比为1∶2∶2∶2的结构简式为___________ (写出一种即可)。


已知:
 。
。(1)A的名称为
(2)E的结构简式为
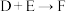 的反应类型为
的反应类型为(3)A→B反应的化学方程式为
(4)C的同分异构体中仅含有
 、
、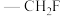 和苯环结构(不含其他环状结构)的有
和苯环结构(不含其他环状结构)的有
您最近一年使用:0次
2023-08-27更新
|
41次组卷
|
2卷引用:青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷
解题方法
5 . 新型高温铁基超导材料主要由 、P、
、P、 、
、 等元素组成。回答下列问题:
等元素组成。回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ ,基态 与基态
与基态 中的未成对电子数之比为
中的未成对电子数之比为___________ 。
(2)向 中嵌入吡啶(
中嵌入吡啶(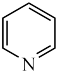 )能得到具有优异性能的超导材料,吡啶能与水以任意比例互溶,是因为吡啶是极性分子且
)能得到具有优异性能的超导材料,吡啶能与水以任意比例互溶,是因为吡啶是极性分子且___________ 。
(3)氧、硫、硒为同主族元素, 、
、 和
和 的沸点由高到低的顺序为
的沸点由高到低的顺序为___________ (填化学式,下同),键角由大到小的顺序为___________ 。
(4) 晶体的配离子结构如图1所示,其配体
晶体的配离子结构如图1所示,其配体 中的C的杂化方式为
中的C的杂化方式为___________ 杂化,中心离子的配位数为___________ 。

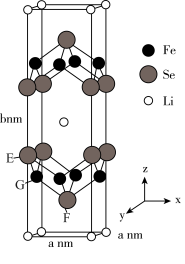
图1 图2
(5) 、
、 、
、 可形成新型超导材料,晶胞棱边夹角均为90°,晶胞结构及晶胞参数如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,E原子的坐标为
可形成新型超导材料,晶胞棱边夹角均为90°,晶胞结构及晶胞参数如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,E原子的坐标为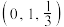 ,F原子的坐标为
,F原子的坐标为 ,G原子的坐标为
,G原子的坐标为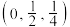 。
。
则距离 原子最近的
原子最近的 原子的个数为
原子的个数为___________ , 原子和
原子和 原子间的最短距离为
原子间的最短距离为___________ (填含a、b的代数式) 。
。
 、P、
、P、 、
、 等元素组成。回答下列问题:
等元素组成。回答下列问题:(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 与基态
与基态 中的未成对电子数之比为
中的未成对电子数之比为(2)向
 中嵌入吡啶(
中嵌入吡啶( )能得到具有优异性能的超导材料,吡啶能与水以任意比例互溶,是因为吡啶是极性分子且
)能得到具有优异性能的超导材料,吡啶能与水以任意比例互溶,是因为吡啶是极性分子且(3)氧、硫、硒为同主族元素,
 、
、 和
和 的沸点由高到低的顺序为
的沸点由高到低的顺序为(4)
 晶体的配离子结构如图1所示,其配体
晶体的配离子结构如图1所示,其配体 中的C的杂化方式为
中的C的杂化方式为

图1 图2
(5)
 、
、 、
、 可形成新型超导材料,晶胞棱边夹角均为90°,晶胞结构及晶胞参数如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,E原子的坐标为
可形成新型超导材料,晶胞棱边夹角均为90°,晶胞结构及晶胞参数如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,E原子的坐标为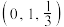 ,F原子的坐标为
,F原子的坐标为 ,G原子的坐标为
,G原子的坐标为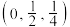 。
。则距离
 原子最近的
原子最近的 原子的个数为
原子的个数为 原子和
原子和 原子间的最短距离为
原子间的最短距离为 。
。
您最近一年使用:0次
2023-08-27更新
|
152次组卷
|
2卷引用:青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷
名校
6 . 氨既是重要的化工产品,也是重要的化工原料。合成氨及氨氧化制硝酸的流程如图所示,下列说法错误的是
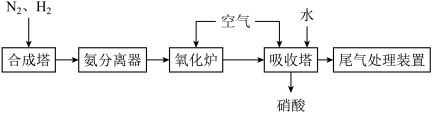
| A.酸 雨和光化学烟雾的形成均与氮氧化物有关 |
B.吸收塔中若转移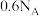 个电子,则反应的NO物质的量为0.1mol 个电子,则反应的NO物质的量为0.1mol |
C.氧化炉中发生反应的化学方程式为 |
| D.从氨分离器中分离出氨,主要利用了其易液化的性质 |
您最近一年使用:0次
2023-05-31更新
|
510次组卷
|
3卷引用:青海省西宁市第十四中学2023-2024学年高一下学期4月月考化学试卷
7 . 硫酸的消费量常用来衡量一个国家工业发展水平,其中 的催化氧化是重要的一步。
的催化氧化是重要的一步。
I.科研人员使用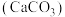 为基础固硫材料,复合不同的催化剂(
为基础固硫材料,复合不同的催化剂(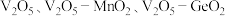 )催化
)催化 向
向 的转化,同时研究了不同温度下使用三种催化剂对
的转化,同时研究了不同温度下使用三种催化剂对 固硫效率(用单位时间
固硫效率(用单位时间 转化率表示)的影响如下图:
转化率表示)的影响如下图:
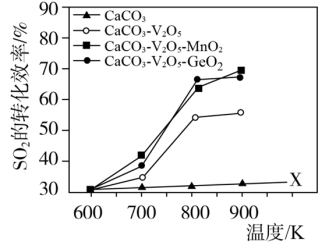
(1)仅使用 而不使用催化剂获得X线的实验目的是
而不使用催化剂获得X线的实验目的是_______ ﹔
(2)下列有关说法正确的是_______
a.三种催化剂中 催化剂效率最低
催化剂效率最低
b.同温同压下,使用复合催化剂有利于提高 的平衡产率
的平衡产率
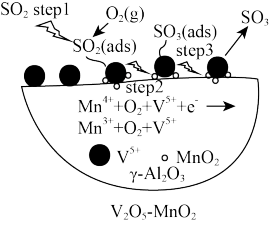
c.如上图为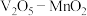 为催化剂时的反应机理,由图可知
为催化剂时的反应机理,由图可知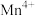 比
比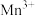 更易获得电子
更易获得电子
d.温度越高一定越有利于催化剂催化效率的提升
(3)某 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: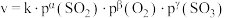 ,根据表中数据可得:
,根据表中数据可得:
_______ 、
_______ 、
_______ 。
Ⅱ.在恒温恒压下,向密闭容器中充入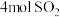 和
和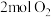 混合气体,
混合气体, 后,反应达到平衡,生成
后,反应达到平衡,生成 气体
气体 ,同时放出热量
,同时放出热量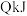 。请回答下列问题:
。请回答下列问题:
(4)该反应的热化学方程式为_______ 。
(5)在该条件下,反应前后容器的体积之比为_______ 。
(6)若把“恒温恒压”改为“恒压绝热条件”反应,平衡后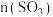
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 的催化氧化是重要的一步。
的催化氧化是重要的一步。I.科研人员使用
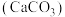 为基础固硫材料,复合不同的催化剂(
为基础固硫材料,复合不同的催化剂(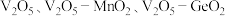 )催化
)催化 向
向 的转化,同时研究了不同温度下使用三种催化剂对
的转化,同时研究了不同温度下使用三种催化剂对 固硫效率(用单位时间
固硫效率(用单位时间 转化率表示)的影响如下图:
转化率表示)的影响如下图:
(1)仅使用
 而不使用催化剂获得X线的实验目的是
而不使用催化剂获得X线的实验目的是(2)下列有关说法正确的是

a.三种催化剂中
 催化剂效率最低
催化剂效率最低b.同温同压下,使用复合催化剂有利于提高
 的平衡产率
的平衡产率c.如上图为
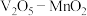 为催化剂时的反应机理,由图可知
为催化剂时的反应机理,由图可知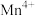 比
比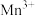 更易获得电子
更易获得电子d.温度越高一定越有利于催化剂催化效率的提升
(3)某
 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: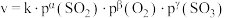 ,根据表中数据可得:
,根据表中数据可得:


| 实验 | 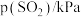 | 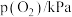 | 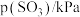 | 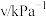 |
| 1 | m | n | p | q |
| 2 | 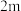 | n | p |  |
| 3 | m | n |  | 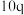 |
| 4 | m |  | p | 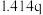 |
Ⅱ.在恒温恒压下,向密闭容器中充入
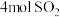 和
和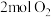 混合气体,
混合气体, 后,反应达到平衡,生成
后,反应达到平衡,生成 气体
气体 ,同时放出热量
,同时放出热量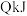 。请回答下列问题:
。请回答下列问题:(4)该反应的热化学方程式为
(5)在该条件下,反应前后容器的体积之比为
(6)若把“恒温恒压”改为“恒压绝热条件”反应,平衡后
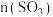
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2022-11-14更新
|
235次组卷
|
4卷引用:青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
8 . 已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示
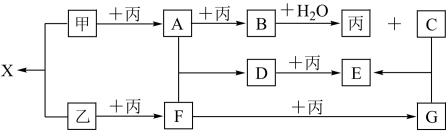
(1)写出X的化学式___________ 。
(2)写出有关变化的化学方程式:
①B+H2O:___________ ;若消耗0.5mol的B则转移电子___________ mol。
②F+丙:___________ 。
(3)写出X+D+H2SO4反应的离子方程式___________ 。

(1)写出X的化学式
(2)写出有关变化的化学方程式:
①B+H2O:
②F+丙:
(3)写出X+D+H2SO4反应的离子方程式
您最近一年使用:0次
名校
9 . 短周期元素 a、b、c、d 的原子序数依次增大,c、a、b 最外层电子数为等差数列,公差为 2,a、c 的价电子数之和为 6,d 的核外电子数等于 b 的核外电子数加 8。下列叙述错误的是
| A.a 和 b 可形成气态化合物 |
| B.工业上常用电解 c 的熔融氧化物的方法获得 c 的单质 |
| C.a 和 d 最高价氧化物的水化物均呈酸性 |
| D.c 的原子半径大于 d 的原子半径 |
您最近一年使用:0次
2021-04-06更新
|
506次组卷
|
2卷引用:青海湟川中学2020-2021学年高一下学期3月考化学试题
名校
10 . A气体(Cl2和 NO2混合)和B气体(SO2和O2混合)的平均相对分子质量分别为51和48。将A、B混合后通入盛满水的倒立在水槽的试管中,反应后试管中无气体存在,则 A、B 两气体的体积比是
| A.5:2 | B.1:2 |
| C.1:1 | D.4:1 |
您最近一年使用:0次



