解题方法
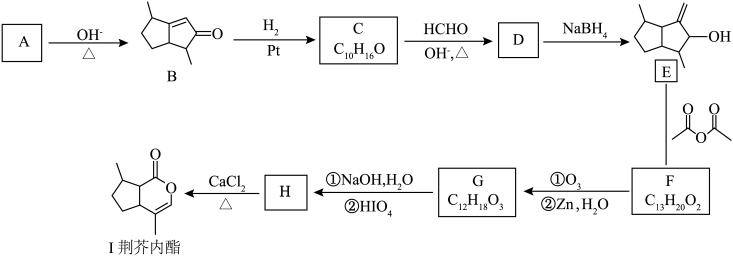
1 . 荆芥内酯为中药荆芥的活性成分,它可用作镇静剂、抗炎药与驱虫剂,其部分合成路径如下: 为烃基或氢。
为烃基或氢。
请回答:
(1)化合物B的官能团的名称是______ 。
(2)化合物A的结构简式是______ 。
(3)下列说法正确的是______。
(4)写出 的化学方程式
的化学方程式______ 。
(5)设计以乙醛为原料合成 的路线
的路线______ 。(用流程图表示,无机试剂任选)。
(6)写出同时符合下列条件的化合物 的同分异构体的结构简式
的同分异构体的结构简式______ 。
①分子中含有两个独立的环(无共用原子),其中至少有一个六元环
② 谱检测表明:分子中共有4种不同化学环境的氢原子。
谱检测表明:分子中共有4种不同化学环境的氢原子。
已知:i.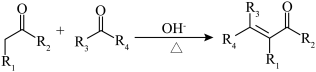
ⅱ.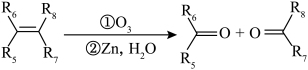
ⅲ.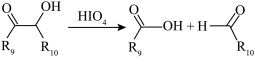
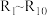 为烃基或氢。
为烃基或氢。请回答:
(1)化合物B的官能团的名称是
(2)化合物A的结构简式是
(3)下列说法正确的是______。
A.化合物 存在遇 存在遇 溶液显紫色的同分异构体 溶液显紫色的同分异构体 |
B.化合物 在氢氧化钠溶液加热的条件下可转化为化合物 在氢氧化钠溶液加热的条件下可转化为化合物 |
C.化合物 的过程中,采用了保护羟基的方法 的过程中,采用了保护羟基的方法 |
D.化合物 的过程中, 的过程中, 起到吸水作用,促进反应进行 起到吸水作用,促进反应进行 |
(4)写出
 的化学方程式
的化学方程式(5)设计以乙醛为原料合成
 的路线
的路线(6)写出同时符合下列条件的化合物
 的同分异构体的结构简式
的同分异构体的结构简式①分子中含有两个独立的环(无共用原子),其中至少有一个六元环
②
 谱检测表明:分子中共有4种不同化学环境的氢原子。
谱检测表明:分子中共有4种不同化学环境的氢原子。
您最近一年使用:0次
2 . 碘酸钙[ ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:
Ⅰ.将一定质量的 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用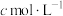 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为___________ ,b中应盛放的最佳传热介质是___________ 。
(2)步骤Ⅰ中反应生成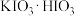 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:___________ 。反应过程中,在烧瓶瓶颈或仪器a下口处可能会看到___________ (填物质名称)析出,其原因是___________ 。
(3)步骤Ⅱ“一系列操作”包括静置、___________ 、洗涤、干燥,其中洗涤所用较佳试剂为___________ (填“水”或“乙醇”)。
(4)碘酸钙粗晶纯度为___________ %(用含a、c、V的代数式表示),下列情况导致产品纯度测定结果偏低的是___________ (填字母)。
A.所配待测溶液中含有 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数
C.盛放 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
 ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:Ⅰ.将一定质量的
 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1
 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL
 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用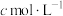 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)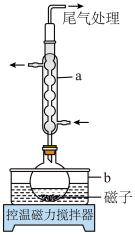
(1)仪器a的名称为
(2)步骤Ⅰ中反应生成
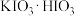 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:(3)步骤Ⅱ“一系列操作”包括静置、
(4)碘酸钙粗晶纯度为
A.所配待测溶液中含有
 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数C.盛放
 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
您最近一年使用:0次
2024-05-27更新
|
183次组卷
|
3卷引用:2024届九师联盟高三下学期四月月考化学试卷
解题方法
3 . 有机物 是治疗良性前列腺增生的药物,其一种合成路线如下:
是治疗良性前列腺增生的药物,其一种合成路线如下:
(1)已知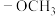 为取代基团(甲氧基),
为取代基团(甲氧基), 的化学名称为
的化学名称为___________ 。
(2) 过程中,先生成中间体
过程中,先生成中间体 (分子式为
(分子式为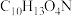 ),然后发生消去反应生成
),然后发生消去反应生成 。写出
。写出 的结构简式:
的结构简式:___________ 。
(3)写出 的化学方程式:
的化学方程式:___________ ,该反应类型为___________ 。
(4)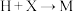 的另一产物为
的另一产物为 ,
, 的结构简式为
的结构简式为___________ 。
(5)满足下列条件的 的二取代芳香族同分异构体的结构简式为
的二取代芳香族同分异构体的结构简式为___________ 。
①与 溶液发生显色反应;
溶液发生显色反应;
②能发生银镜反应;
③核磁共振氢谱有5组峰,且峰面积之比为6:2:2:1:1
(6)参照C→D→E官能团转化信息,设计以苯甲醇为原料,制备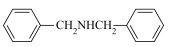 的合成路线:
的合成路线:___________ 。(其他无机试剂任选)。
 是治疗良性前列腺增生的药物,其一种合成路线如下:
是治疗良性前列腺增生的药物,其一种合成路线如下: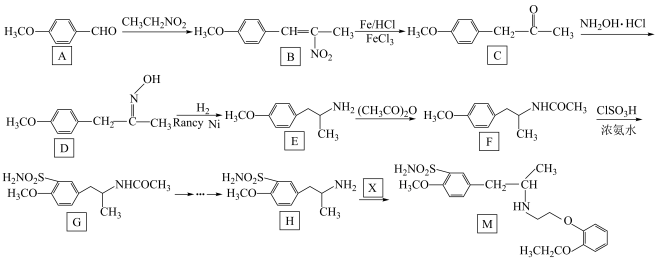
(1)已知
 为取代基团(甲氧基),
为取代基团(甲氧基), 的化学名称为
的化学名称为(2)
 过程中,先生成中间体
过程中,先生成中间体 (分子式为
(分子式为 ),然后发生消去反应生成
),然后发生消去反应生成 。写出
。写出 的结构简式:
的结构简式:(3)写出
 的化学方程式:
的化学方程式:(4)
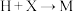 的另一产物为
的另一产物为 ,
, 的结构简式为
的结构简式为(5)满足下列条件的
 的二取代芳香族同分异构体的结构简式为
的二取代芳香族同分异构体的结构简式为①与
 溶液发生显色反应;
溶液发生显色反应;②能发生银镜反应;
③核磁共振氢谱有5组峰,且峰面积之比为6:2:2:1:1
(6)参照C→D→E官能团转化信息,设计以苯甲醇为原料,制备
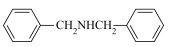 的合成路线:
的合成路线:
您最近一年使用:0次
4 .  (丙烯)是重要基本有机原料。
(丙烯)是重要基本有机原料。 (丙烷)催化脱氢制
(丙烷)催化脱氢制 过程如下:
过程如下:
Ⅰ.主反应: ;
;
Ⅱ.副反应: 。
。
回答下列问题:
(1)已知断裂 下列化学键所需能量如下表:
下列化学键所需能量如下表:
上述主反应的
___________  。
。
(2)一定条件下, 催化脱氢制
催化脱氢制 发生上述Ⅰ、Ⅱ反应,
发生上述Ⅰ、Ⅱ反应, 和
和 的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为
的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为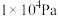 和
和 )。
)。 时,图中表示
时,图中表示 和
和 积分数变化的曲线分别为
积分数变化的曲线分别为___________ 、___________ 。
②提高 催化脱氢制
催化脱氢制 的反应平衡转化率的方法是
的反应平衡转化率的方法是___________ (任写一种)。
(3)在压力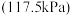 恒定,以
恒定,以 作为稀释气,不同水烃比
作为稀释气,不同水烃比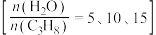 时,
时, 催化脱氢制备
催化脱氢制备 反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。
反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。 平衡转化率相同时,水烃比越高,对应的反应温度越
平衡转化率相同时,水烃比越高,对应的反应温度越___________ (填“高”或“低”)。
②相同温度下,水烃比远大于15:1时,丙烷的消耗速率明显下降,可能的原因是:
ⅰ.丙烷的浓度过低;
ⅱ.___________ 。
③M点对应条件下,若 的选择性为
的选择性为 ,则反应Ⅰ的分压平衡常数
,则反应Ⅰ的分压平衡常数 为
为___________ kPa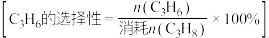 。
。
(4)利用 的弱氧化性,科研人员开发了
的弱氧化性,科研人员开发了 氧化脱氢制
氧化脱氢制 的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。___________ 。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___________ 。
(5)研究表明, 氧化脱氢制
氧化脱氢制 的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的
的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的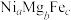 的立方晶胞结构如图4所示。已知晶胞的边长为
的立方晶胞结构如图4所示。已知晶胞的边长为 ,设
,设 为阿伏加德罗常数的值。该晶体密度是
为阿伏加德罗常数的值。该晶体密度是___________  (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
 (丙烯)是重要基本有机原料。
(丙烯)是重要基本有机原料。 (丙烷)催化脱氢制
(丙烷)催化脱氢制 过程如下:
过程如下:Ⅰ.主反应:
 ;
;Ⅱ.副反应:
 。
。回答下列问题:
(1)已知断裂
 下列化学键所需能量如下表:
下列化学键所需能量如下表:| 化学键 |  |  |  |
能量 | 436.0 | 413.4 | 344.7 |

 。
。(2)一定条件下,
 催化脱氢制
催化脱氢制 发生上述Ⅰ、Ⅱ反应,
发生上述Ⅰ、Ⅱ反应, 和
和 的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为
的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为 和
和 )。
)。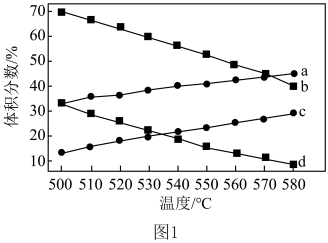
 时,图中表示
时,图中表示 和
和 积分数变化的曲线分别为
积分数变化的曲线分别为②提高
 催化脱氢制
催化脱氢制 的反应平衡转化率的方法是
的反应平衡转化率的方法是(3)在压力
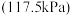 恒定,以
恒定,以 作为稀释气,不同水烃比
作为稀释气,不同水烃比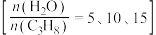 时,
时, 催化脱氢制备
催化脱氢制备 反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。
反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。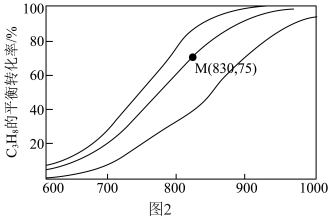
 平衡转化率相同时,水烃比越高,对应的反应温度越
平衡转化率相同时,水烃比越高,对应的反应温度越②相同温度下,水烃比远大于15:1时,丙烷的消耗速率明显下降,可能的原因是:
ⅰ.丙烷的浓度过低;
ⅱ.
③M点对应条件下,若
 的选择性为
的选择性为 ,则反应Ⅰ的分压平衡常数
,则反应Ⅰ的分压平衡常数 为
为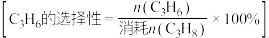 。
。(4)利用
 的弱氧化性,科研人员开发了
的弱氧化性,科研人员开发了 氧化脱氢制
氧化脱氢制 的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
(5)研究表明,
 氧化脱氢制
氧化脱氢制 的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的
的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的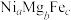 的立方晶胞结构如图4所示。已知晶胞的边长为
的立方晶胞结构如图4所示。已知晶胞的边长为 ,设
,设 为阿伏加德罗常数的值。该晶体密度是
为阿伏加德罗常数的值。该晶体密度是 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
5 . 已知AG的定义为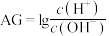 ,室温下用0.1
,室温下用0.1 的HCl溶液滴定10.00mL 0.1
的HCl溶液滴定10.00mL 0.1 某一元碱MOH溶液,滴定过程中AG与HCl溶液体积变化关系如图所示。下列说法正确的是
某一元碱MOH溶液,滴定过程中AG与HCl溶液体积变化关系如图所示。下列说法正确的是
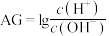 ,室温下用0.1
,室温下用0.1 的HCl溶液滴定10.00mL 0.1
的HCl溶液滴定10.00mL 0.1 某一元碱MOH溶液,滴定过程中AG与HCl溶液体积变化关系如图所示。下列说法正确的是
某一元碱MOH溶液,滴定过程中AG与HCl溶液体积变化关系如图所示。下列说法正确的是 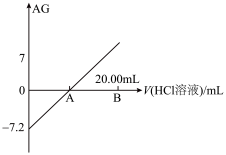
A.MOH的电离常数的数量级为 |
| B.A点时水的电离程度最大 |
| C.A点时加入HCl溶液的体积等于10.00mL |
D.B点时溶液中存在: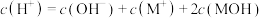 |
您最近一年使用:0次
2024-05-12更新
|
162次组卷
|
2卷引用:2024届九师联盟高三下学期四月月考化学试卷
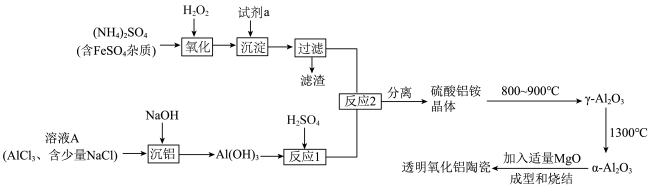
6 . 透明氧化铝陶瓷被认为是最具潜力的材料之一,制备透明氧化铝陶瓷的一种方法的流程如图所示:
(1)试剂a应选用___________ (填名称), 的电子式为
的电子式为___________ 。
(2)“反应1”的离子方程式为___________ 。
(3)检验上述流程中“过滤”后杂质已除尽的方法是___________ 。
(4)“沉铝”时,欲使 恰好完全转化为
恰好完全转化为 沉淀,应控制pH的范围是
沉淀,应控制pH的范围是___________ {已知:溶液中 、
、 浓度小于
浓度小于 认为
认为 沉淀完全,
沉淀完全,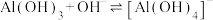 ,
,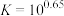 ,
,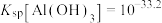 }。
}。
(5)硫酸铝铵晶体[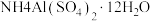 ]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的
]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的 溶液,沉淀质量最大时,反应的总离子方程式为
溶液,沉淀质量最大时,反应的总离子方程式为___________ 。
(6)硫酸铝铵晶体加热到800~900℃得到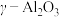 ,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为
,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为___________ 。___________ 特性;用它制造刚玉球磨机,是利用它的___________ 特性。
(1)试剂a应选用
 的电子式为
的电子式为(2)“反应1”的离子方程式为
(3)检验上述流程中“过滤”后杂质已除尽的方法是
(4)“沉铝”时,欲使
 恰好完全转化为
恰好完全转化为 沉淀,应控制pH的范围是
沉淀,应控制pH的范围是 、
、 浓度小于
浓度小于 认为
认为 沉淀完全,
沉淀完全,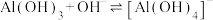 ,
,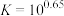 ,
,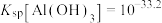 }。
}。(5)硫酸铝铵晶体[
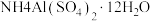 ]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的
]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的 溶液,沉淀质量最大时,反应的总离子方程式为
溶液,沉淀质量最大时,反应的总离子方程式为(6)硫酸铝铵晶体加热到800~900℃得到
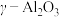 ,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为
,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为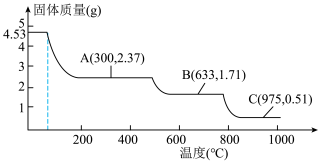
您最近一年使用:0次
2024-05-12更新
|
159次组卷
|
2卷引用:2024届九师联盟高三下学期四月月考化学试卷
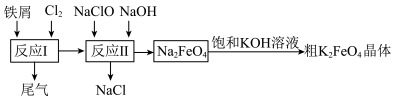
7 . 高铁酸钾(K2FeO4)有强氧化性,是一种环保、高效、多功能饮用水处理剂,受热易分解,酸性环境中易变质。制备流程如图所示:
(1)K2FeO4中铁的化合价为______ ,提纯K2FeO4的实验方法是______ 。
(2)铁屑需事先用Na2CO3溶液洗涤,目的是______ 。
(3)反应II的离子方程式为______ 。
(4)K2FeO4处理饮用水的原理是______ 。
(5)反应II中过量NaOH除了作为反应物外还有什么作用______ 。
(6)已知K2FeO4难溶于乙醇,可溶于水,故洗涤K2FeO4晶体时,先使用冷水洗涤,再使用乙醇洗涤,简述用乙醇洗涤K2FeO4晶体的操作______ 。
(7)检测产品纯度的原理如图所示:______ 。(保留4位有效数字)
(1)K2FeO4中铁的化合价为
(2)铁屑需事先用Na2CO3溶液洗涤,目的是
(3)反应II的离子方程式为
(4)K2FeO4处理饮用水的原理是
(5)反应II中过量NaOH除了作为反应物外还有什么作用
(6)已知K2FeO4难溶于乙醇,可溶于水,故洗涤K2FeO4晶体时,先使用冷水洗涤,再使用乙醇洗涤,简述用乙醇洗涤K2FeO4晶体的操作
(7)检测产品纯度的原理如图所示:
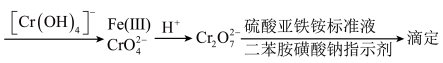
您最近一年使用:0次
8 . 常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是
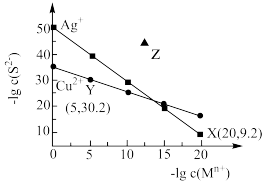
| A.Ksp(Ag2S)=10-29.2 |
| B.向含CuS沉淀的悬浊液中加入Na2S固体,CuS的溶解度和Ksp均不变 |
| C.Z点条件下能生成Ag2S沉淀,也能生成CuS沉淀 |
D.CuS(s)+2Ag+(aq) Ag2S(s)+Cu2+(aq)平衡常数K=1014 Ag2S(s)+Cu2+(aq)平衡常数K=1014 |
您最近一年使用:0次
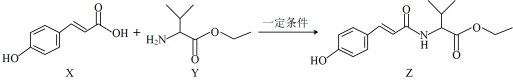
9 . 某抗氧化剂Z可由如图反应制得。下列关于X、Y、Z的说法正确的是
 +H2O
+H2O
| A.Z在碱性环境下水解可得到X和Y |
| B.X分子中有三种官能团 |
| C.Z能发生氧化反应、取代反应、加成反应和消去反应 |
| D.一定条件下,1molX分别与Br2、H2发生加成反应,最多消耗3molBr2、5molH2 |
您最近一年使用:0次
名校
10 . 某温度下,向 和
和 的混合溶液中逐滴加入某浓度的
的混合溶液中逐滴加入某浓度的 溶液,测得溶液中的离子浓度的关系如图所示,已知该温度下
溶液,测得溶液中的离子浓度的关系如图所示,已知该温度下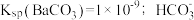 的电离平衡常数为
的电离平衡常数为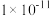 ,下列说法错误的是
,下列说法错误的是
 和
和 的混合溶液中逐滴加入某浓度的
的混合溶液中逐滴加入某浓度的 溶液,测得溶液中的离子浓度的关系如图所示,已知该温度下
溶液,测得溶液中的离子浓度的关系如图所示,已知该温度下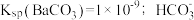 的电离平衡常数为
的电离平衡常数为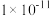 ,下列说法错误的是
,下列说法错误的是
A.该温度下a点溶液的 为7 为7 |
B.b点溶液中存在 |
C.b点溶液中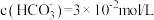 |
D.a、b、c三点溶液中 最大的是c点 最大的是c点 |
您最近一年使用:0次
2024-03-17更新
|
156次组卷
|
2卷引用:2024届天域全国名校协作体学年高三下学期联考化学学科试题



