名校
1 . 已知A、B、C、D都是短周期元素,它们的原子半径大小顺序为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在___________ 个未成对电子,最高能级符号是___________ 。
(2)基态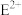 的核外电子排布式为
的核外电子排布式为___________ 。
(3)基态D原子的最高能层的电子排布图为___________ 。
(4)M分子中B原子轨道的杂化类型为___________ 。
(5)B、C、D三种元素的第一电离能由小到大的顺序为___________ 。
(6)硫元素能形成多种微粒如 、
、 、
、 、
、 、
、 等,杂化类型为
等,杂化类型为 的是
的是___________ (填写微粒符号,下同);杂化类型为 的是
的是___________ ;VSEPR模型为四面体(包括正四面体)的是___________ ;分子空间结构为V形的是___________ ;分子空间结构为三角锥型的是___________ 。
(7)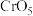 中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为
中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为___________ (填标号)。___________ 。
(1)基态B原子中,核外存在
(2)基态
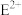 的核外电子排布式为
的核外电子排布式为(3)基态D原子的最高能层的电子排布图为
(4)M分子中B原子轨道的杂化类型为
(5)B、C、D三种元素的第一电离能由小到大的顺序为
(6)硫元素能形成多种微粒如
 、
、 、
、 、
、 、
、 等,杂化类型为
等,杂化类型为 的是
的是 的是
的是(7)
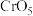 中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为
中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为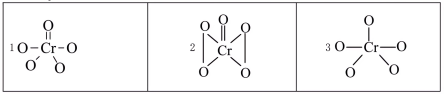
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2);2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是___________ 形。
(2)某有机物的结构简式为 该有机物分子是
该有机物分子是___________ (填“极性”或“非极性”)分子
(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因___________ ;
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3;HN3的酸性和醋酸相近,可微弱电离出H+和N 。下列有关说法正确的是___________(填序号)。
。下列有关说法正确的是___________(填序号)。
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2);2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是
(2)某有机物的结构简式为
 该有机物分子是
该有机物分子是(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3;HN3的酸性和醋酸相近,可微弱电离出H+和N
 。下列有关说法正确的是___________(填序号)。
。下列有关说法正确的是___________(填序号)。| A.HN3中含有5个σ键 |
| B.HN3中的三个氮原子均采用sp2杂化 |
| C.HN3、HNO2、H2O、N2H4都是极性分子 |
| D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键 |
您最近一年使用:0次
名校
3 . 气相离子催化剂(Fe+、Co+、Mn+等)具有优良的催化效果。其中在Fe+催化下乙烷氧化反应的机理如图所示(图中…为副反应),下列说法不正确的是

A.主反应的总反应方程式为:C2H6+2N2O CH3CHO+H2O+2N2 CH3CHO+H2O+2N2 |
| B.每生成1mol CH3CHO消耗N2O的物质的量等于2mol |
| C.CH3CHO中碳原子的杂化方式有sp3和sp2两种 |
| D.X与Y能互溶因为它们的分子结构具有相似性且X与Y能形成分子间氢键 |
您最近一年使用:0次
4 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)以生物材质(以 计)与水蒸气反应制取
计)与水蒸气反应制取 是一种低耗能,高效率的制
是一种低耗能,高效率的制 方法。该方法由气化炉制造
方法。该方法由气化炉制造 和燃烧炉再生
和燃烧炉再生 两步构成,气化炉中涉及到的反应如下:
两步构成,气化炉中涉及到的反应如下:
I.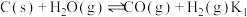
Ⅱ.
Ⅲ.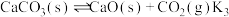
Ⅳ.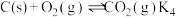
①该工艺制 总反应可表示为
总反应可表示为 ,该反应的平衡常数
,该反应的平衡常数
___________ (用 等的代数式表示)。
等的代数式表示)。
②绝热条件下,将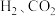 以体积比
以体积比 充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是
充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是___________ 。
A. 与
与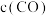 比值不变 B.容器内气体密度不变
比值不变 B.容器内气体密度不变
C.容器内气体压强不变 D.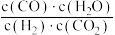 不变
不变
(2) 的速率方程为
的速率方程为 ,
,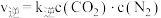 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
净反应速率 等于正、逆反应速率之差,平衡时,
等于正、逆反应速率之差,平衡时,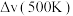
___________ (填“>”、“<”或“=”) 。
。
(3)一定条件下, 与
与 反应可合成
反应可合成 ,
, ,该反应分两步进行:
,该反应分两步进行:
ⅰ.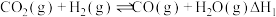
ⅱ.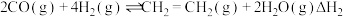
 ,压强恒定为
,压强恒定为 时,将
时,将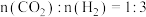 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
 的平衡转化率为
的平衡转化率为___________ ,反应ⅰ的平衡常数
___________ ( 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)利用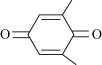 (Q)与
(Q)与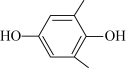 (QH2)电解转化法从烟气中分离
(QH2)电解转化法从烟气中分离 的原理如图,已知气体可选择性通过膜电极,溶液不能通过
的原理如图,已知气体可选择性通过膜电极,溶液不能通过
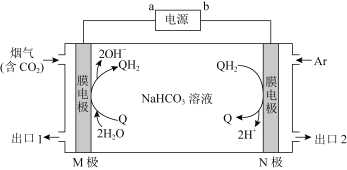
①(填“a”或“b”)___________ 为电源负极。
② 从出口
从出口___________ (填“1”或“2”)排出, 在
在 极上发生的反应为
极上发生的反应为___________ 。
(1)以生物材质(以
 计)与水蒸气反应制取
计)与水蒸气反应制取 是一种低耗能,高效率的制
是一种低耗能,高效率的制 方法。该方法由气化炉制造
方法。该方法由气化炉制造 和燃烧炉再生
和燃烧炉再生 两步构成,气化炉中涉及到的反应如下:
两步构成,气化炉中涉及到的反应如下:I.
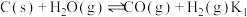
Ⅱ.

Ⅲ.
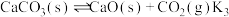
Ⅳ.
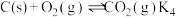
①该工艺制
 总反应可表示为
总反应可表示为 ,该反应的平衡常数
,该反应的平衡常数
 等的代数式表示)。
等的代数式表示)。②绝热条件下,将
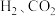 以体积比
以体积比 充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是
充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是A.
 与
与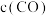 比值不变 B.容器内气体密度不变
比值不变 B.容器内气体密度不变C.容器内气体压强不变 D.
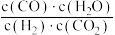 不变
不变(2)
 的速率方程为
的速率方程为 ,
,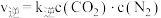 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。净反应速率
 等于正、逆反应速率之差,平衡时,
等于正、逆反应速率之差,平衡时,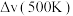
 。
。(3)一定条件下,
 与
与 反应可合成
反应可合成 ,
, ,该反应分两步进行:
,该反应分两步进行:ⅰ.
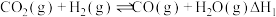
ⅱ.
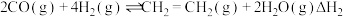
 ,压强恒定为
,压强恒定为 时,将
时,将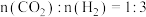 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:| 组分 |  |  |  |
| 物质的量分数(%) | 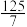 | 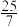 | 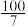 |
 的平衡转化率为
的平衡转化率为
 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。(4)利用
 (Q)与
(Q)与 (QH2)电解转化法从烟气中分离
(QH2)电解转化法从烟气中分离 的原理如图,已知气体可选择性通过膜电极,溶液不能通过
的原理如图,已知气体可选择性通过膜电极,溶液不能通过
①(填“a”或“b”)
②
 从出口
从出口 在
在 极上发生的反应为
极上发生的反应为
您最近一年使用:0次
名校
解题方法
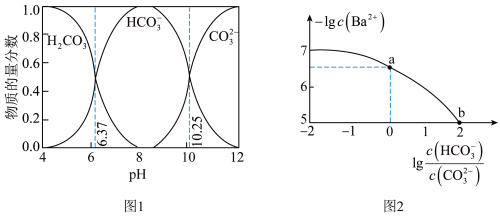
5 . 标况下, 的溶解度约为
的溶解度约为 ,
, ;室温下
;室温下 溶液中各含碳粒子的物质的量分数与
溶液中各含碳粒子的物质的量分数与 的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中
的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中 与
与 的关系如图2所示,下列说法正确的是
的关系如图2所示,下列说法正确的是
 的溶解度约为
的溶解度约为 ,
, ;室温下
;室温下 溶液中各含碳粒子的物质的量分数与
溶液中各含碳粒子的物质的量分数与 的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中
的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中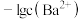 与
与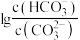 的关系如图2所示,下列说法正确的是
的关系如图2所示,下列说法正确的是
A.饱和碳酸的浓度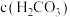 约为 约为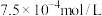 |
B. 对应的溶液中存在: 对应的溶液中存在: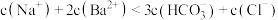 |
C.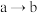 的过程中,溶液中 的过程中,溶液中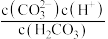 逐渐减小 逐渐减小 |
D. 点对应溶液的 点对应溶液的 为9.25 为9.25 |
您最近一年使用:0次
名校
解题方法
6 . 中医药作为中国优秀传统文化的典范,凝聚着祖先的智慧和经验的结晶。矿物药的成分主要为金属﹑金属氧化物﹑盐等。
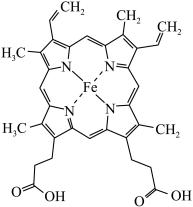
(1)铁华粉常用来治疗血虚萎黄,其成分为醋酸亚铁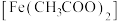 ,其形成的血红素分子结构如图所示。铁位于周期表的
,其形成的血红素分子结构如图所示。铁位于周期表的___________ 区,铁华粉中基态亚铁离子的未成对电子数与其电子总数之比为___________ ,铁华粉中组成元素的电负性由大到小的顺序为___________ (填元素符号),血红素分子中铁(Ⅱ)的配位数为___________ 。
(2)生石灰可用于止血,轻质氧化镁可用于治疗便秘。请比较CaO、MgO的熔点大小,并请解释原因:___________ 。
(3)多原子分子中各原子若在同一平面,且有相互平行的 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成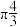 ,则
,则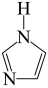 (咪唑)中的“离域
(咪唑)中的“离域 键”可表示为
键”可表示为___________ 。
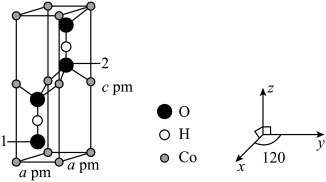
(4)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号 原子的坐标为
原子的坐标为 ,则2号
,则2号 原子的坐标为
原子的坐标为___________ 。设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  (用代数式表示)。
(用代数式表示)。
(1)铁华粉常用来治疗血虚萎黄,其成分为醋酸亚铁
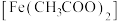 ,其形成的血红素分子结构如图所示。铁位于周期表的
,其形成的血红素分子结构如图所示。铁位于周期表的
(2)生石灰可用于止血,轻质氧化镁可用于治疗便秘。请比较CaO、MgO的熔点大小,并请解释原因:
(3)多原子分子中各原子若在同一平面,且有相互平行的
 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成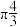 ,则
,则 (咪唑)中的“离域
(咪唑)中的“离域 键”可表示为
键”可表示为(4)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号
 原子的坐标为
原子的坐标为 ,则2号
,则2号 原子的坐标为
原子的坐标为 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
7 . I.金属镁性质活泼,能与许多物质反应,某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2中燃烧,可能产物为MgO、N2和Mg3N2.通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。已知:NO2气体能被NaOH溶液吸收,Mg3N2极易与水反应。___________ (填字母);装置B的作用是___________ 。
(2)用来检验N2的实验装置为___________ (填字母)。
(3)设计实验证明产物中存在Mg3N2:___________ 。
Ⅱ.二氧化氯(ClO2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。ClO2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照如图实验装置制备ClO2并验证其某些性质。回答下列问题:___________ 。
(5)通入氮气的主要作用有两个,一是可以起到搅拌作用,二是___________ 。
(6)B装置的作用是________ 。C装置用来吸收ClO2,则C中液体宜选用_________ (填序号)。
①热水②冰水③饱和食盐水
(7)D装置中ClO2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,D装置中生成这两种钠盐的化学方程式为___________ ;饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2·3H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___________ ;b.___________ ;c.洗涤;d.干燥。
(8)设计一个简易实验证明二氧化氯具有永久的漂白性:___________ 。
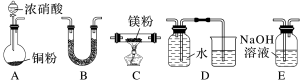
(2)用来检验N2的实验装置为
(3)设计实验证明产物中存在Mg3N2:
Ⅱ.二氧化氯(ClO2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。ClO2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照如图实验装置制备ClO2并验证其某些性质。回答下列问题:
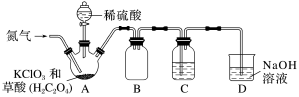
(5)通入氮气的主要作用有两个,一是可以起到搅拌作用,二是
(6)B装置的作用是
①热水②冰水③饱和食盐水
(7)D装置中ClO2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,D装置中生成这两种钠盐的化学方程式为
(8)设计一个简易实验证明二氧化氯具有永久的漂白性:
您最近一年使用:0次
2024-02-14更新
|
91次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题
8 . 甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知: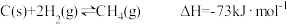
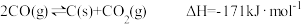
CO(g)+3H2(g) CH4(g)+H2O(g)ΔH=-203kJ·mol-1
CH4(g)+H2O(g)ΔH=-203kJ·mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式___________ 。
(2)工业上常用 与水蒸气在一定条件下来制取H2,其原理为:
与水蒸气在一定条件下来制取H2,其原理为: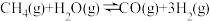 。
。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为___________ ,此反应的平衡常数为___________  (结果保留到小数点后三位)。
(结果保留到小数点后三位)。
②下列说法中能说明此反应达到平衡状态的是___________ 。
A.体系的压强不再发生变化
B.生成1molCH4的同时消耗3molH2
C.体系的平均相对分子质量不再发生变化
D.体系的密度不再发生变化
E.反应速率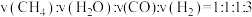
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),发生反应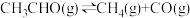 ,经过相同时间测得CH3CHO的转化率与压强的关系如图所示:
,经过相同时间测得CH3CHO的转化率与压强的关系如图所示:
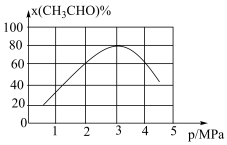
①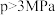 时,增大压强,CH3CHO的转化率降低,其原因是
时,增大压强,CH3CHO的转化率降低,其原因是___________ 。
②当压强为4MPa时,该反应的平衡常数Kp=___________ MPa(用各物质分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
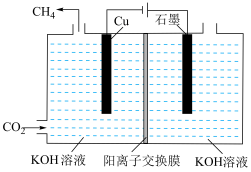
(4) 电化学制
电化学制 。下图表示以KOH溶液作电解质溶液进行电解的示意图,
。下图表示以KOH溶液作电解质溶液进行电解的示意图, 在Cu电极上可以转化为
在Cu电极上可以转化为 ,该电极反应的方程式为
,该电极反应的方程式为___________ 。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:
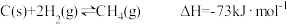
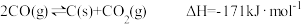
CO(g)+3H2(g)
 CH4(g)+H2O(g)ΔH=-203kJ·mol-1
CH4(g)+H2O(g)ΔH=-203kJ·mol-1写出CO与H2O(g)反应生成H2和CO2的热化学方程式
(2)工业上常用
 与水蒸气在一定条件下来制取H2,其原理为:
与水蒸气在一定条件下来制取H2,其原理为: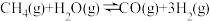 。
。①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为
 (结果保留到小数点后三位)。
(结果保留到小数点后三位)。②下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化
B.生成1molCH4的同时消耗3molH2
C.体系的平均相对分子质量不再发生变化
D.体系的密度不再发生变化
E.反应速率
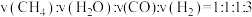
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),发生反应
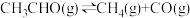 ,经过相同时间测得CH3CHO的转化率与压强的关系如图所示:
,经过相同时间测得CH3CHO的转化率与压强的关系如图所示:
①
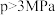 时,增大压强,CH3CHO的转化率降低,其原因是
时,增大压强,CH3CHO的转化率降低,其原因是②当压强为4MPa时,该反应的平衡常数Kp=
(4)
 电化学制
电化学制 。下图表示以KOH溶液作电解质溶液进行电解的示意图,
。下图表示以KOH溶液作电解质溶液进行电解的示意图, 在Cu电极上可以转化为
在Cu电极上可以转化为 ,该电极反应的方程式为
,该电极反应的方程式为
您最近一年使用:0次
名校
解题方法
9 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。75号元素铼Re,熔点仅次于钨,是稀有金属之一、回答:
(1)镍基态原子有___________ 种不同空间运动状态的电子,第四周期与基态镍原子单电子数相同的元素有___________ 种(不含镍元素)。
(2)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。0.2mol二丁二酮肟合镍分子内含有σ键___________ mol,碳碳键是由___________ 轨道重叠形成的。

a.sp3和sp2 b.sp2和 sp2 c.sp2和p d.sp3和p
(3) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键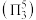 。
。 键角
键角___________ 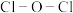 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中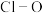 键的键长并说明原因
键的键长并说明原因___________ 。
(4)人类合成的第一个稀有气体化合物是XeF+PtF ,PtF
,PtF 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
(5)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子填在氧原子围成的___________ (填“四面体”“立方体"或“八面体”)空隙中,该晶胞的空间利用率为___________ (铼的原子半径为rRepm,氧原子半径为rOpm,列出计算式)。
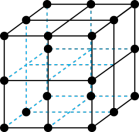
(6)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
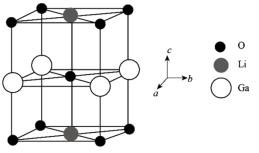
①上述晶胞沿着a轴的投影图为___________ (填字母)。
A. B.
B.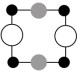 C.
C.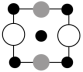
②用 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为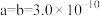 m,
m,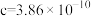 m,则其密度为
m,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
(1)镍基态原子有
(2)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。0.2mol二丁二酮肟合镍分子内含有σ键

a.sp3和sp2 b.sp2和 sp2 c.sp2和p d.sp3和p
(3)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键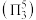 。
。 键角
键角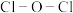 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(4)人类合成的第一个稀有气体化合物是XeF+PtF
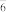 ,PtF
,PtF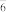 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。| A.熔化状态下不能导电 |
| B.XeF+中所有原子都满足8电子稳定结构 |
| C.用两个Cl替换F后,所得PtF4Cl2有两种结构 |
| D.含有离子键、极性键、非极性键和配位键 |
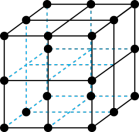
(6)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B. C.
C.
②用
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为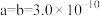 m,
m,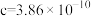 m,则其密度为
m,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
10 . 钯(Pd)是一种贵金属,性质类似铂(Pt)。活性炭载钯催化剂广泛应用于石油化工、制药等工业,但使用过程中因生成难溶于酸的PdO而失活。一种从废钯催化剂(杂质主要含有机物、活性炭、及少量Fe、Cu、Al等元素)中回收海绵钯的工艺流程如图:

已知:
Ⅰ.阴、阳离子交换树脂的基本工作原理分别为 、
、 (
( 表示树脂的有机成分)。
表示树脂的有机成分)。
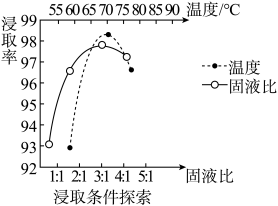
Ⅱ.“沉钯”时得到氯钯酸铵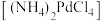 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。
(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为___________ 。
(2)“浸取”时,加入试剂A的目的为___________ 。
(3)“浸取”时,加入 有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(
有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(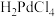 )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:___________ 。
(4)“离子交换除杂”应使用___________ (填“阳离子”或“阴离子”)树脂,“洗脱”时应使用的洗脱液为___________ (填标号)。
A.硫酸 B.盐酸 C.无水乙醇
(5)“还原”过程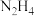 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为___________ ,且该产物可循环利用至___________ 环节(填环节名称)。

已知:
Ⅰ.阴、阳离子交换树脂的基本工作原理分别为
 、
、 (
( 表示树脂的有机成分)。
表示树脂的有机成分)。Ⅱ.“沉钯”时得到氯钯酸铵
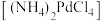 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为

(2)“浸取”时,加入试剂A的目的为
(3)“浸取”时,加入
 有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(
有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(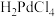 )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:(4)“离子交换除杂”应使用
A.硫酸 B.盐酸 C.无水乙醇
(5)“还原”过程
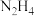 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
您最近一年使用:0次



