名校
解题方法
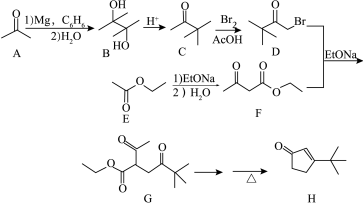
1 . 某药物中间体H的一种合成路线如下:
回答下列问题:
(1)A分子中最多有_______ 个原子共平面。B的化学名称为_______ 。
(2)G中的官能团名称为_______ 。
(3)D+F→G的反应类型是_______ 。
(4)由E生成F的化学方程式为_______ 。
(5)下列有关叙述正确的是_______ (填标号)。
a.1mol G最多能与2mol 发生加成反应
发生加成反应
b.常温下,B在水中的溶解度大于F
c.C的同分异构体中,能发生银镜反应的有8种(不考虑立体异构)
d.H有芳香族同分异构体
(6)M是D的同分异构体,符合下列条件的M的结构简式为_______ 。
ⅰ.能与新制的 反应,产生砖红色沉淀
反应,产生砖红色沉淀
ⅱ.两种官能团连在同一个碳原子上
ⅲ.核磁共振氢谱显示为三组峰,且峰面积比为9∶1∶1
(7)根据以上流程信息,结合所学知识,设计以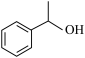 为原料合成
为原料合成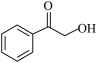 的路线:
的路线:_______ (有机溶剂和无机试剂任选)。
回答下列问题:
(1)A分子中最多有
(2)G中的官能团名称为
(3)D+F→G的反应类型是
(4)由E生成F的化学方程式为
(5)下列有关叙述正确的是
a.1mol G最多能与2mol
 发生加成反应
发生加成反应b.常温下,B在水中的溶解度大于F
c.C的同分异构体中,能发生银镜反应的有8种(不考虑立体异构)
d.H有芳香族同分异构体
(6)M是D的同分异构体,符合下列条件的M的结构简式为
ⅰ.能与新制的
 反应,产生砖红色沉淀
反应,产生砖红色沉淀ⅱ.两种官能团连在同一个碳原子上
ⅲ.核磁共振氢谱显示为三组峰,且峰面积比为9∶1∶1
(7)根据以上流程信息,结合所学知识,设计以
 为原料合成
为原料合成 的路线:
的路线:
您最近一年使用:0次
2024-09-16更新
|
87次组卷
|
3卷引用:河南省八市重点高中2025届高三上学期第一次调研考试 化学试题
名校
解题方法
2 .  、
、 常用于制造农药等,磷在氯气中燃烧生成这两种卤化磷。回答下列问题:
常用于制造农药等,磷在氯气中燃烧生成这两种卤化磷。回答下列问题:
(1)已知:①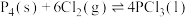

②
 (
(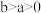 )
)
则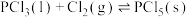

_______  。
。
(2)实验测得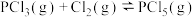 的速率方程为
的速率方程为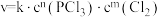 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为 (R、C为常数,
(R、C为常数, 为活化能,T为热力学温度)。
为活化能,T为热力学温度)。
①一定温度下,向密闭容器中充入适量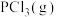 和
和 ,实验测得在催化剂Cat1、Cat2作用下,
,实验测得在催化剂Cat1、Cat2作用下, 与
与 的关系如图所示。催化效能较高的是
的关系如图所示。催化效能较高的是_______ (填“Cat1”或“Cat2”),判断依据是_______ 。
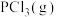 和
和
 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,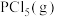 为
为 ,如果此时移走
,如果此时移走
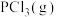 和
和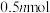
 ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时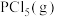 的物质的量为x,则x为
的物质的量为x,则x为_______ (填标号)。
A.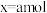 B.
B.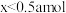 C.
C.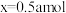 D.
D.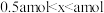
(3)向恒容密闭容器中投入0.2mol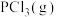 和0.2mol
和0.2mol ,发生反应:
,发生反应: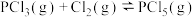 。不同条件下反应体系总压强
。不同条件下反应体系总压强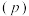 随时间
随时间 的变化如图所示。
的变化如图所示。_______ ;曲线c改变的条件可能是_______
②曲线b条件(恒温恒容)下,该反应的逆反应 的压强平衡常数
的压强平衡常数
_______ kPa。
(4)温度为T时,向2.0L恒容密闭容器中充入1.0mol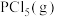 ,反应
,反应 经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
①反应在前150s的平均反应速率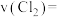
_______  。
。
②相同温度下,起始时向该2.0L恒容密闭容器中充入1.0mol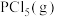 、0.40mol
、0.40mol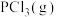 和0.40mol
和0.40mol ,反应达到平衡前
,反应达到平衡前
_______  (填“>”或“<”),判断依据是
(填“>”或“<”),判断依据是_______ 。
 、
、 常用于制造农药等,磷在氯气中燃烧生成这两种卤化磷。回答下列问题:
常用于制造农药等,磷在氯气中燃烧生成这两种卤化磷。回答下列问题:(1)已知:①
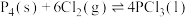

②

 (
(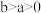 )
)则
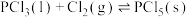

 。
。(2)实验测得
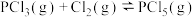 的速率方程为
的速率方程为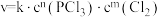 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为 (R、C为常数,
(R、C为常数, 为活化能,T为热力学温度)。
为活化能,T为热力学温度)。①一定温度下,向密闭容器中充入适量
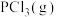 和
和 ,实验测得在催化剂Cat1、Cat2作用下,
,实验测得在催化剂Cat1、Cat2作用下, 与
与 的关系如图所示。催化效能较高的是
的关系如图所示。催化效能较高的是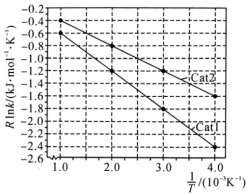

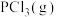 和
和
 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,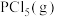 为
为 ,如果此时移走
,如果此时移走
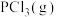 和
和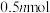
 ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时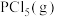 的物质的量为x,则x为
的物质的量为x,则x为A.
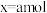 B.
B.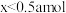 C.
C.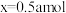 D.
D.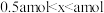
(3)向恒容密闭容器中投入0.2mol
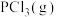 和0.2mol
和0.2mol ,发生反应:
,发生反应: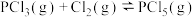 。不同条件下反应体系总压强
。不同条件下反应体系总压强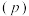 随时间
随时间 的变化如图所示。
的变化如图所示。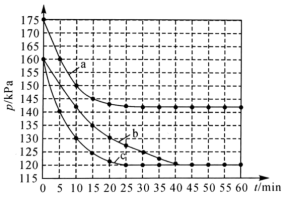
②曲线b条件(恒温恒容)下,该反应的逆反应
 的压强平衡常数
的压强平衡常数
(4)温度为T时,向2.0L恒容密闭容器中充入1.0mol
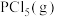 ,反应
,反应 经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
经过一段时间后达到平衡。反应过程中测定的部分数据见下表: | 0 | 50 | 150 | 250 | 350 |
 | 1.0 | 0.84 | 0.82 | 0.80 | 0.80 |
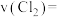
 。
。②相同温度下,起始时向该2.0L恒容密闭容器中充入1.0mol
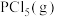 、0.40mol
、0.40mol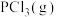 和0.40mol
和0.40mol ,反应达到平衡前
,反应达到平衡前
 (填“>”或“<”),判断依据是
(填“>”或“<”),判断依据是
您最近一年使用:0次
2024-09-16更新
|
163次组卷
|
3卷引用:河南省八市重点高中2025届高三上学期第一次调研考试 化学试题
3 . 二硼化钛(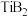 )的熔点是2980℃,有很高的硬度,可用于制备复合陶瓷、熔融金属坩埚、电解池电极。工业上以高钛渣(主要成分为
)的熔点是2980℃,有很高的硬度,可用于制备复合陶瓷、熔融金属坩埚、电解池电极。工业上以高钛渣(主要成分为 、
、 、
、 和CaO,另有少量
和CaO,另有少量 、
、 )为原料制取
)为原料制取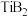 的流程如图所示。
的流程如图所示。
② 高温下蒸气压大、易挥发。
高温下蒸气压大、易挥发。
③“酸解”在加热条件下进行, 可溶于热的浓硫酸形成
可溶于热的浓硫酸形成 。
。
回答下列问题:
(1)基态Ti原子的价层电子的轨道表示式为_______ 。
(2)“酸浸”后的滤液中的阳离子有: 、
、_______ 。“酸解”后的滤渣中主要成分为_______ (填化学式)。
(3)“水解”在沸水中进行,反应的离子方程式为_______ 。
(4)“热还原”中发生反应的化学方程式为_______ 。 的实际用量超过了理论上化学计量所要求的用量,原因是
的实际用量超过了理论上化学计量所要求的用量,原因是_______ 。
(5)原料中的 可由硼酸(
可由硼酸( )脱水制得。以
)脱水制得。以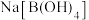 为原料,用电渗析法制备硼酸的装置如图所示。已知装置中阳离子交换膜只允许阳离子通过,关闭NaOH溶液进、出口阀门后电解一段时间,NaOH溶液的质量变化为33g,则产品室中制得
为原料,用电渗析法制备硼酸的装置如图所示。已知装置中阳离子交换膜只允许阳离子通过,关闭NaOH溶液进、出口阀门后电解一段时间,NaOH溶液的质量变化为33g,则产品室中制得 的质量为
的质量为_______ g。 ),Ti原子与As原子构成的八面体如图乙所示。1个晶胞中由Ti原子与As原子构成的八面体的平均数目为
),Ti原子与As原子构成的八面体如图乙所示。1个晶胞中由Ti原子与As原子构成的八面体的平均数目为_______ 。
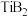 )的熔点是2980℃,有很高的硬度,可用于制备复合陶瓷、熔融金属坩埚、电解池电极。工业上以高钛渣(主要成分为
)的熔点是2980℃,有很高的硬度,可用于制备复合陶瓷、熔融金属坩埚、电解池电极。工业上以高钛渣(主要成分为 、
、 、
、 和CaO,另有少量
和CaO,另有少量 、
、 )为原料制取
)为原料制取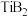 的流程如图所示。
的流程如图所示。
②
 高温下蒸气压大、易挥发。
高温下蒸气压大、易挥发。③“酸解”在加热条件下进行,
 可溶于热的浓硫酸形成
可溶于热的浓硫酸形成 。
。回答下列问题:
(1)基态Ti原子的价层电子的轨道表示式为
(2)“酸浸”后的滤液中的阳离子有:
 、
、(3)“水解”在沸水中进行,反应的离子方程式为
(4)“热还原”中发生反应的化学方程式为
 的实际用量超过了理论上化学计量所要求的用量,原因是
的实际用量超过了理论上化学计量所要求的用量,原因是(5)原料中的
 可由硼酸(
可由硼酸( )脱水制得。以
)脱水制得。以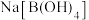 为原料,用电渗析法制备硼酸的装置如图所示。已知装置中阳离子交换膜只允许阳离子通过,关闭NaOH溶液进、出口阀门后电解一段时间,NaOH溶液的质量变化为33g,则产品室中制得
为原料,用电渗析法制备硼酸的装置如图所示。已知装置中阳离子交换膜只允许阳离子通过,关闭NaOH溶液进、出口阀门后电解一段时间,NaOH溶液的质量变化为33g,则产品室中制得 的质量为
的质量为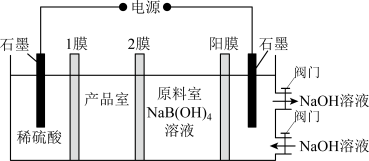
 ),Ti原子与As原子构成的八面体如图乙所示。1个晶胞中由Ti原子与As原子构成的八面体的平均数目为
),Ti原子与As原子构成的八面体如图乙所示。1个晶胞中由Ti原子与As原子构成的八面体的平均数目为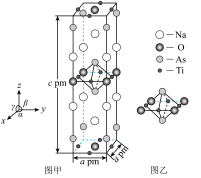
您最近一年使用:0次
2024-09-16更新
|
90次组卷
|
3卷引用:河南省八市重点高中2025届高三上学期第一次调研考试 化学试题
名校
解题方法
4 .  (硫脲)应用广泛,实验室可通过先制备
(硫脲)应用广泛,实验室可通过先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置如图所示(夹持及加热装置略)。
,实验装置如图所示(夹持及加热装置略)。 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。
回答下列问题:
(1)仪器a的名称是_______ 。 中硫元素的化合价为
中硫元素的化合价为_______ 价。
(2)装置B中的溶液是为了除去 气体中混有的杂质HCl气体,则装置B中的溶液是饱和
气体中混有的杂质HCl气体,则装置B中的溶液是饱和_______ 溶液(填化学式)。装置C的作用为_______ 。
(3)检查装置气密性后加入药品,打开 ,通入一段时间
,通入一段时间 ,目的是
,目的是_______ 。然后关闭 ,打开
,打开 ,待A中反应结束后关闭
,待A中反应结束后关闭 。
。
(4)撤走装置D中的搅拌器,水浴加热装置D,打开 ,在80℃条件下合成硫脲,控制温度在80℃的原因是
,在80℃条件下合成硫脲,控制温度在80℃的原因是_______ 。装置D中除生成硫脲外,还生成一种碱,则装置D中生成硫脲的化学方程式为_______ 。
(5)设计实验证明反应过程中硫脲发生异构化生成了 :取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴
:取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴_______ 溶液(填化学式),溶液变为红色,则可证明。
(6)装置E中发生反应的离子方程式为_______ 。
(7)装置D反应后的液体经分离、提纯、干燥可得产品。测定产品的纯度:称取 产品,加水溶解配成100mL溶液,移取25.00mL溶液于锥形瓶中,加入稀硫酸酸化,用
产品,加水溶解配成100mL溶液,移取25.00mL溶液于锥形瓶中,加入稀硫酸酸化,用 酸性
酸性 标准溶液滴定
标准溶液滴定 ,滴定至终点时消耗标准溶液
,滴定至终点时消耗标准溶液 (杂质不参与反应)。产品中硫脲的质量分数为
(杂质不参与反应)。产品中硫脲的质量分数为_______ (用含m、c、V的代数式表示)。
 (硫脲)应用广泛,实验室可通过先制备
(硫脲)应用广泛,实验室可通过先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置如图所示(夹持及加热装置略)。
,实验装置如图所示(夹持及加热装置略)。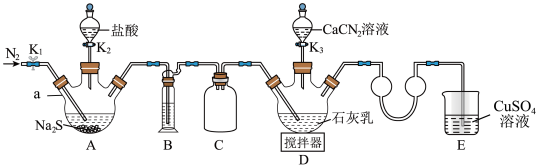
 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。回答下列问题:
(1)仪器a的名称是
 中硫元素的化合价为
中硫元素的化合价为(2)装置B中的溶液是为了除去
 气体中混有的杂质HCl气体,则装置B中的溶液是饱和
气体中混有的杂质HCl气体,则装置B中的溶液是饱和(3)检查装置气密性后加入药品,打开
 ,通入一段时间
,通入一段时间 ,目的是
,目的是 ,打开
,打开 ,待A中反应结束后关闭
,待A中反应结束后关闭 。
。(4)撤走装置D中的搅拌器,水浴加热装置D,打开
 ,在80℃条件下合成硫脲,控制温度在80℃的原因是
,在80℃条件下合成硫脲,控制温度在80℃的原因是(5)设计实验证明反应过程中硫脲发生异构化生成了
 :取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴
:取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴(6)装置E中发生反应的离子方程式为
(7)装置D反应后的液体经分离、提纯、干燥可得产品。测定产品的纯度:称取
 产品,加水溶解配成100mL溶液,移取25.00mL溶液于锥形瓶中,加入稀硫酸酸化,用
产品,加水溶解配成100mL溶液,移取25.00mL溶液于锥形瓶中,加入稀硫酸酸化,用 酸性
酸性 标准溶液滴定
标准溶液滴定 ,滴定至终点时消耗标准溶液
,滴定至终点时消耗标准溶液 (杂质不参与反应)。产品中硫脲的质量分数为
(杂质不参与反应)。产品中硫脲的质量分数为
您最近一年使用:0次
2024-09-16更新
|
124次组卷
|
3卷引用:河南省八市重点高中2025届高三上学期第一次调研考试 化学试题
名校
解题方法
5 . 室温下, 水溶液中各含硫微粒物质的量分数
水溶液中各含硫微粒物质的量分数 随pH的变化关系如图所示[例如
随pH的变化关系如图所示[例如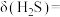
 ]。已知:室温下,
]。已知:室温下,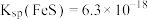 ,
,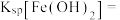
 ,
,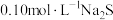 溶液中
溶液中 的水解率为62%。下列说法错误的是
的水解率为62%。下列说法错误的是
 水溶液中各含硫微粒物质的量分数
水溶液中各含硫微粒物质的量分数 随pH的变化关系如图所示[例如
随pH的变化关系如图所示[例如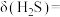
 ]。已知:室温下,
]。已知:室温下,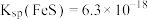 ,
,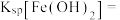
 ,
,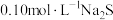 溶液中
溶液中 的水解率为62%。下列说法错误的是
的水解率为62%。下列说法错误的是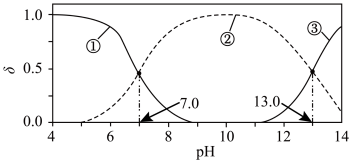
A.室温下, 的 的 和 和 分别为 分别为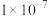 、 、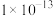 ;溶解度:FeS小于 ;溶解度:FeS小于 |
B.以酚酞为指示剂(变色的pH范围为8.2~10.0),用NaOH标准溶液可准确滴定 水溶液的浓度 水溶液的浓度 |
C.等物质的量浓度的 和NaHS混合溶液中存在关系: 和NaHS混合溶液中存在关系: |
D.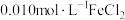 溶液中加入等体积 溶液中加入等体积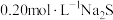 溶液,反应初始生成的沉淀是FeS和 溶液,反应初始生成的沉淀是FeS和 |
您最近一年使用:0次
2024-09-16更新
|
129次组卷
|
3卷引用:河南省八市重点高中2025届高三上学期第一次调研考试 化学试题
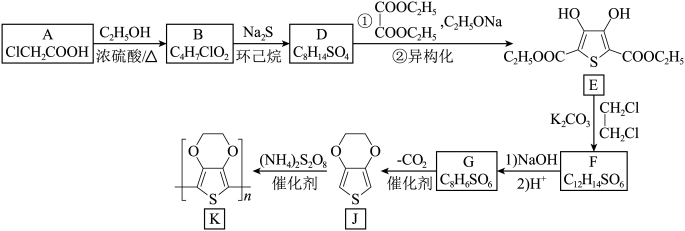
6 . 高分子化合物K具有分子结构简单、能隙小、电导率高等特点,在透明电极材料方面具有应用潜力,一种合成K的路线如图:
(1)A的化学名称为___________ 。
(2)B中所含官能团的名称为___________ 、___________ 。
(3)D的结构简式为___________ 。
(4)写出E→F的化学方程式:___________ 。
(5) 是J的同分异构体,与
是J的同分异构体,与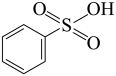 相比,酸性较强的是
相比,酸性较强的是___________ (填“前者”或“后者”),其原因为___________ 。
(6)X是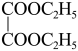 ,的同分异构体,只含有一种官能团且能与
,的同分异构体,只含有一种官能团且能与 发生反应的X的结构有
发生反应的X的结构有___________ 种(不考虑立体异构)。
(7)参照上述合成路线,设计以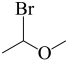 、
、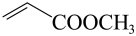 为主要原料合成有机物
为主要原料合成有机物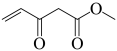 的合成路线:
的合成路线:___________ (其他试剂任选)。
①
②
(1)A的化学名称为
(2)B中所含官能团的名称为
(3)D的结构简式为
(4)写出E→F的化学方程式:
(5)
 是J的同分异构体,与
是J的同分异构体,与 相比,酸性较强的是
相比,酸性较强的是(6)X是
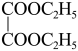 ,的同分异构体,只含有一种官能团且能与
,的同分异构体,只含有一种官能团且能与 发生反应的X的结构有
发生反应的X的结构有(7)参照上述合成路线,设计以
 、
、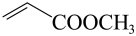 为主要原料合成有机物
为主要原料合成有机物 的合成路线:
的合成路线:
您最近一年使用:0次
2024-09-11更新
|
102次组卷
|
2卷引用:河南省濮阳油田实验学校2024-2025学年高三上学期9月质量检测 化学试卷
7 . 碳酸亚铁( )可用于治疗缺铁性贫血,某实验小组设计如图实验装置制备碳酸亚铁并测定其含量。
)可用于治疗缺铁性贫血,某实验小组设计如图实验装置制备碳酸亚铁并测定其含量。 以下。
以下。
回答下列问题:
(1)仪器B的名称为___________ 。
(2)配制硫酸溶液所用的蒸馏水必须先除去溶解的氧气,操作方法是___________ 。
(3)小组某成员认为,实验装置存在明显缺陷,该缺陷可能导致产品不纯,请补充合理的改进方案___________ 。
(4)实验时,先关闭活塞 ,再打开活塞
,再打开活塞 和
和 ,加入适量稀硫酸后关闭
,加入适量稀硫酸后关闭 ,反应一段时间排出装置内的空气,接下来应进行的操作是
,反应一段时间排出装置内的空气,接下来应进行的操作是___________ 。
(5)若将 溶液换成氨水
溶液换成氨水 混合溶液,也能生成
混合溶液,也能生成 沉淀,则换成氨水—
沉淀,则换成氨水— 混合溶液后,仪器C中发生反应的离子方程式为
混合溶液后,仪器C中发生反应的离子方程式为___________ 。
(6)利用邻二氮菲(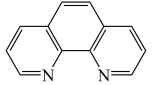 ,平面形分子,简称为phen)与
,平面形分子,简称为phen)与 完全络合生成稳定橙红色配合物
完全络合生成稳定橙红色配合物 时最大吸收波长为
时最大吸收波长为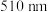 这一特征,可用来检测
这一特征,可用来检测 含量,其反应原理如下:
含量,其反应原理如下:___________ 。
②实验过程:将上述所制 全部溶解于酸中,控制溶液的
全部溶解于酸中,控制溶液的 在5~6之间,添加
在5~6之间,添加 邻二氮菲溶液
邻二氮菲溶液 时,可获得最大吸收波长,则
时,可获得最大吸收波长,则 的质量为
的质量为___________ g。
③若添加邻二氮菲溶液前, 小于3,仍按②进行实验,则所测
小于3,仍按②进行实验,则所测 的质量将
的质量将___________ (填“偏大”“偏小”或“无影响”)。
 )可用于治疗缺铁性贫血,某实验小组设计如图实验装置制备碳酸亚铁并测定其含量。
)可用于治疗缺铁性贫血,某实验小组设计如图实验装置制备碳酸亚铁并测定其含量。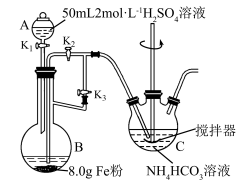
 以下。
以下。回答下列问题:
(1)仪器B的名称为
(2)配制硫酸溶液所用的蒸馏水必须先除去溶解的氧气,操作方法是
(3)小组某成员认为,实验装置存在明显缺陷,该缺陷可能导致产品不纯,请补充合理的改进方案
(4)实验时,先关闭活塞
 ,再打开活塞
,再打开活塞 和
和 ,加入适量稀硫酸后关闭
,加入适量稀硫酸后关闭 ,反应一段时间排出装置内的空气,接下来应进行的操作是
,反应一段时间排出装置内的空气,接下来应进行的操作是(5)若将
 溶液换成氨水
溶液换成氨水 混合溶液,也能生成
混合溶液,也能生成 沉淀,则换成氨水—
沉淀,则换成氨水— 混合溶液后,仪器C中发生反应的离子方程式为
混合溶液后,仪器C中发生反应的离子方程式为(6)利用邻二氮菲(
 ,平面形分子,简称为phen)与
,平面形分子,简称为phen)与 完全络合生成稳定橙红色配合物
完全络合生成稳定橙红色配合物 时最大吸收波长为
时最大吸收波长为 这一特征,可用来检测
这一特征,可用来检测 含量,其反应原理如下:
含量,其反应原理如下: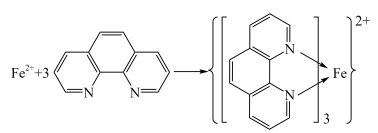
②实验过程:将上述所制
 全部溶解于酸中,控制溶液的
全部溶解于酸中,控制溶液的 在5~6之间,添加
在5~6之间,添加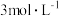 邻二氮菲溶液
邻二氮菲溶液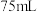 时,可获得最大吸收波长,则
时,可获得最大吸收波长,则 的质量为
的质量为③若添加邻二氮菲溶液前,
 小于3,仍按②进行实验,则所测
小于3,仍按②进行实验,则所测 的质量将
的质量将
您最近一年使用:0次
2024-09-11更新
|
94次组卷
|
2卷引用:河南省濮阳油田实验学校2024-2025学年高三上学期9月质量检测 化学试卷
8 . 氢能是一种理想的清洁能源,制氢、储运和应用是氢能产业中的三大环节。储氢材料中的氨( )、肼(
)、肼( )、氨硼烷(
)、氨硼烷( )、肼硼烷(
)、肼硼烷(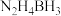 )等具有储氢密度高、热力学动力学性质合理等优点。肼因能接受
)等具有储氢密度高、热力学动力学性质合理等优点。肼因能接受 而表现出弱碱性,氨硼烷分子间存在“双氢键”使氨硼烷的熔,点明显升高。其中直接肼硼烷碱性燃料电池(
而表现出弱碱性,氨硼烷分子间存在“双氢键”使氨硼烷的熔,点明显升高。其中直接肼硼烷碱性燃料电池(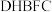 )除具有高能量密度,还具有安全和系统结构简单等优点,已经引起研究者的重视。回答下列问题:
)除具有高能量密度,还具有安全和系统结构简单等优点,已经引起研究者的重视。回答下列问题:
1.下列说法错误的是
2.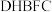 电池的工作原理如图所示(催化剂能减少肼硼烷与水反应产生
电池的工作原理如图所示(催化剂能减少肼硼烷与水反应产生 )。下列叙述错误的是
)。下列叙述错误的是
 )、肼(
)、肼( )、氨硼烷(
)、氨硼烷( )、肼硼烷(
)、肼硼烷(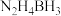 )等具有储氢密度高、热力学动力学性质合理等优点。肼因能接受
)等具有储氢密度高、热力学动力学性质合理等优点。肼因能接受 而表现出弱碱性,氨硼烷分子间存在“双氢键”使氨硼烷的熔,点明显升高。其中直接肼硼烷碱性燃料电池(
而表现出弱碱性,氨硼烷分子间存在“双氢键”使氨硼烷的熔,点明显升高。其中直接肼硼烷碱性燃料电池(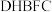 )除具有高能量密度,还具有安全和系统结构简单等优点,已经引起研究者的重视。回答下列问题:
)除具有高能量密度,还具有安全和系统结构简单等优点,已经引起研究者的重视。回答下列问题:1.下列说法错误的是
A. 的沸点高于 的沸点高于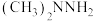 的沸点 的沸点 | B.原子半径: |
| C.肼和氨硼烷的空间结构均属于平面形 | D.向肼溶液中加入少量的硫酸能生成 |
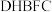 电池的工作原理如图所示(催化剂能减少肼硼烷与水反应产生
电池的工作原理如图所示(催化剂能减少肼硼烷与水反应产生 )。下列叙述错误的是
)。下列叙述错误的是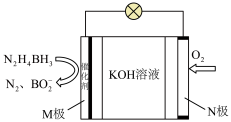
A.催化剂可有效提高 电池的能量转化效率 电池的能量转化效率 |
B.N极的电极反应式: |
C.放电一段时间后,电解液中 的物质的量不变 的物质的量不变 |
D.消耗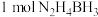 ,N极消耗 ,N极消耗 的物质的量小于 的物质的量小于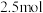 |
您最近一年使用:0次
2024-09-11更新
|
107次组卷
|
3卷引用:河南省濮阳油田实验学校2024-2025学年高三上学期9月质量检测 化学试卷
9 . 已知: 时,
时,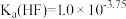 。
。 时,向一定体积的
时,向一定体积的 溶液中逐滴加入
溶液中逐滴加入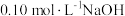 溶液,滴加过程中溶液的
溶液,滴加过程中溶液的 和温度随
和温度随 的变化曲线如图所示(忽略温度变化对水离子积的影响)。下列说法正确的是
的变化曲线如图所示(忽略温度变化对水离子积的影响)。下列说法正确的是
 时,
时,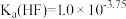 。
。 时,向一定体积的
时,向一定体积的 溶液中逐滴加入
溶液中逐滴加入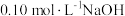 溶液,滴加过程中溶液的
溶液,滴加过程中溶液的 和温度随
和温度随 的变化曲线如图所示(忽略温度变化对水离子积的影响)。下列说法正确的是
的变化曲线如图所示(忽略温度变化对水离子积的影响)。下列说法正确的是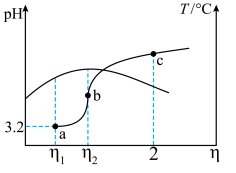
A. 越大,水的电离程度越小 越大,水的电离程度越小 | B.b点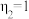 ,溶液中 ,溶液中 |
C.a点时,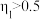 | D.c点溶液中: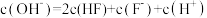 |
您最近一年使用:0次
2024-09-09更新
|
133次组卷
|
3卷引用:河南省濮阳油田实验学校2024-2025学年高三上学期9月质量检测 化学试卷
10 . 下列实验方案中,不能测定出 和
和 混合物中各物质的质量分数的是
混合物中各物质的质量分数的是
 和
和 混合物中各物质的质量分数的是
混合物中各物质的质量分数的是| A.取ag该混合物充分加热,质量减少bg |
| B.取ag该混合物与足量NaOH溶液充分反应,得到bg溶液 |
| C.取ag该混合物与足量稀盐酸反应,加热、蒸干、灼烧,得到bg固体 |
| D.取ag该混合物与足量稀硫酸反应,逸出气体经干燥后并用碱石灰吸收,质量增加bg |
您最近一年使用:0次
2024-09-07更新
|
156次组卷
|
2卷引用:河南省南阳市2023-2024学年高一上学期11月联考化学试题



