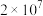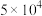名校
解题方法
1 . 铁被誉为“工业之母”,铁也是人体必须的痕量元素之一。
(1)基态Fe原子的核外电子中有_______ 对成对电子。其重要化合物 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为_______ ,其中Fe的配位数为_______ 。
(2)血红素(含 )是吡咯(
)是吡咯(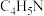 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:_______ ,请描述原因:_______ 。
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为_______ 个(设 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______ 。
③CO中毒是由于CO与血红蛋白(Hb)发生配位反应: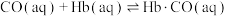 K。
K。
已知CO、 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。
则反应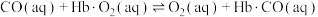 的平衡常数
的平衡常数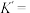
_______ 。
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。 ,B点原子的分数坐标为
,B点原子的分数坐标为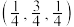 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ 。
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的 ,则该晶体的化学式为
,则该晶体的化学式为_______ ,晶胞密度为_______  (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
(1)基态Fe原子的核外电子中有
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为(2)血红素(含
 )是吡咯(
)是吡咯(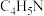 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图: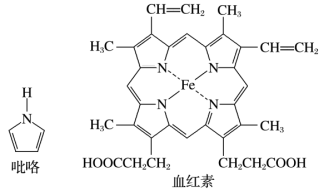
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为
 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为③CO中毒是由于CO与血红蛋白(Hb)发生配位反应:
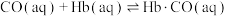 K。
K。已知CO、
 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。CO |
| |
配位常数K |
|
|
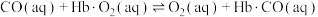 的平衡常数
的平衡常数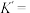
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。
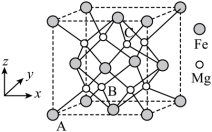
 ,B点原子的分数坐标为
,B点原子的分数坐标为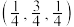 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的
 ,则该晶体的化学式为
,则该晶体的化学式为 (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
2 . X为乙二胺,Y为乙二胺四乙酸(EDTA),均易与金属离子形成配合物。Z为乙二胺与 形成的配离子,W为EDTA阴离子与
形成的配离子,W为EDTA阴离子与 形成的整合物。下列叙述正确的是
形成的整合物。下列叙述正确的是
 形成的配离子,W为EDTA阴离子与
形成的配离子,W为EDTA阴离子与 形成的整合物。下列叙述正确的是
形成的整合物。下列叙述正确的是
| A.X和Y中均含有手性碳原子 | B.Z和W均带两个单位的正电荷 |
| C.Z和W中金属离子的配位数均为4 | D.Z和W中均含普通共价键和配位键 |
您最近一年使用:0次
名校
解题方法
3 . 以软锰矿(主要含有MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备KMnO4的工艺流程如图所示:
①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于_______ 区,核外电子占据最高能层的符号是_______ ,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用_______ “理论”解释。
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为_______ 。
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为_______ 。
(4)“除Ca、Mg”时,所得滤液中 =
=_______ 。
(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为_______ 。
②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为_______ 。
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为_______ (填“阴极”或“阳极”)。
②阳极的电极反应式为_______ 。

①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为
(4)“除Ca、Mg”时,所得滤液中
 =
=(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO
 )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为
②阳极的电极反应式为
您最近一年使用:0次
名校
解题方法
4 . 一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是
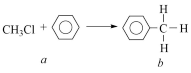
| A.该反应属于化合反应 | B.b的二氯代物有6种结构 |
| C.b分子中共平面的原子最多有8个 | D.C5H11Cl的结构有8种 |
您最近一年使用:0次
名校
5 . 二氯化二硫( )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)有关 的下列说法正确的是 。
的下列说法正确的是 。
(2)选用以下装置制取少量 (加热及夹持装置略):
(加热及夹持装置略):_____________________ 。
②装置连接顺序:A→__________ →D。
③B中玻璃纤维的作用是______________________ 。
④D中的最佳试剂是__________ (选填序号)。
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。_________ (填标号);
a. 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
 )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)有关
 的下列说法正确的是 。
的下列说法正确的是 。A. 中S-Cl键的键能大于S-S键的键能 中S-Cl键的键能大于S-S键的键能 | B.固态时 属于原子晶体 属于原子晶体 |
| C.第一电离能、电负性均为:Cl>S | D. 中既有极性键又有非极性键 中既有极性键又有非极性键 |
(2)选用以下装置制取少量
 (加热及夹持装置略):
(加热及夹持装置略):
②装置连接顺序:A→
③B中玻璃纤维的作用是
④D中的最佳试剂是
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
a.
 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
您最近一年使用:0次
名校
解题方法
6 . 硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下, 回答下列问题:_______ 。
(2)Na2B4O7易溶于水,也易发生水解: (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_______ 。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式_______ 。加入MgO的目的是_______ 。
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
“操作A”是除去MgSO4和CaSO4混合溶液中的CaSO4,根据上表数据,简要说明“操作A”步骤为_______ 。
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:_______ 。
②若选定A为坐标原点,则B的分数坐标为_______ 。
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为_______ g•cm-3(用含a、NA的式子表示)。

(2)Na2B4O7易溶于水,也易发生水解:
 (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:

②若选定A为坐标原点,则B的分数坐标为
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为
您最近一年使用:0次
名校
解题方法
7 . I.汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物。为了测定其中一种有毒有机物A的结构,做如下实验:
①将9.2g该有机物完全燃烧,生成标准状况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得到如下图所示的质谱图。
(1)由上图可知该分子的相对分子质量是___________ ,结合实验数据确定有机物A的分子式为___________ 。
(2)用核磁共振仪处理该化合物,得到的核磁共振氢谱图中有四个峰,且峰的面积之比是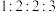 ,则有机物A的结构简式为
,则有机物A的结构简式为___________ ,其苯环上的一氯代物有___________ 种。
Ⅱ.按要求完成下列问题。
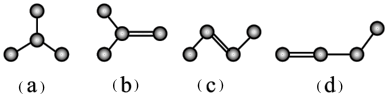
(3)如下图是由4个碳原子结合成的4种有机物(氢原子没有画出)a、b、c、d四种物质中,4个碳原子一定处于同一平面的有___________ (填代号)。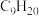 的烃有一种同分异构体D,不能由任何烯烃加氢得到,则D的结构简式为
的烃有一种同分异构体D,不能由任何烯烃加氢得到,则D的结构简式为___________ 。
(5)某有机物的分子式为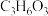 ,其分子结构中含有羧基和羟基,但没有甲基,则该有机物的结构简式为
,其分子结构中含有羧基和羟基,但没有甲基,则该有机物的结构简式为___________ 。
①将9.2g该有机物完全燃烧,生成标准状况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得到如下图所示的质谱图。
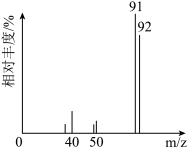
(1)由上图可知该分子的相对分子质量是
(2)用核磁共振仪处理该化合物,得到的核磁共振氢谱图中有四个峰,且峰的面积之比是
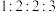 ,则有机物A的结构简式为
,则有机物A的结构简式为Ⅱ.按要求完成下列问题。
(3)如下图是由4个碳原子结合成的4种有机物(氢原子没有画出)a、b、c、d四种物质中,4个碳原子一定处于同一平面的有
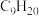 的烃有一种同分异构体D,不能由任何烯烃加氢得到,则D的结构简式为
的烃有一种同分异构体D,不能由任何烯烃加氢得到,则D的结构简式为(5)某有机物的分子式为
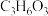 ,其分子结构中含有羧基和羟基,但没有甲基,则该有机物的结构简式为
,其分子结构中含有羧基和羟基,但没有甲基,则该有机物的结构简式为
您最近一年使用:0次
名校
解题方法
8 . 下列化学用语表述正确的是
A. 结构式为 结构式为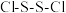 | B. 结构示意图为 结构示意图为 |
C. 价层电子对互斥模型: 价层电子对互斥模型: | D.丙烷的空间填充模型为 |
您最近一年使用:0次
9 . 中国青蒿素专家屠呦呦获得2016年度国家科学技术奖最高奖。青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为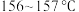 ,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为
,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为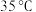 。从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。
。从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。
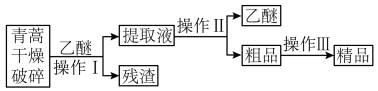
乙醚浸取法的主要工艺为:
(1)下列仪器在操作中不需要用到的有___________ (填字母)。
A.分液漏斗 B.玻璃棒 C.蒸发皿 D.烧杯
操作II的名称是___________ 。
(2)操作III的主要过程可能是___________ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加 的乙醇,浓缩、结晶、过滤
的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。________ ,装置E中吸收的物质是________ ,装置F中盛放的物质是________ 。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是___________ 。
③用合理改进后的装置进行实验,称得:
则测得青蒿素的实验式是___________ 。
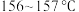 ,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为
,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为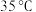 。从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。
。从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
(1)下列仪器在操作中不需要用到的有
A.分液漏斗 B.玻璃棒 C.蒸发皿 D.烧杯
操作II的名称是
(2)操作III的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结晶
B.加
 的乙醇,浓缩、结晶、过滤
的乙醇,浓缩、结晶、过滤C.加入乙醚进行萃取分液
(3)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
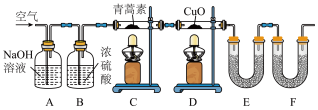
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是
③用合理改进后的装置进行实验,称得:
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
您最近一年使用:0次
10 . 赤泥含有Sc2O3 (氧化钪)、Al2O3、Fe2O3、SiO2等,以赤泥为原料提取钪(Sc)的流程如下:
请回答下列问题:
(1)滤渣主要成分是___________ (填化学式)。
(2)“酸浸”时温度过高,酸浸速率反而减慢,其原因是___________ 。
(3)“回流过滤”中稍过量SOCl2作用有将Sc(OH)3转化为ScCl3,作溶剂和___________ 。
(4)“热还原”的化学方程式为___________ 。
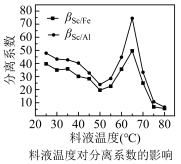
(5)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时最佳浓度
及料液温度分别为___________ 、___________ 。流程中“洗涤”的目的是___________ 。
[A的分离系数指分离后混合体系中A的物质的量分数,如βSc/Fe= ×100%]
×100%]___________ 。
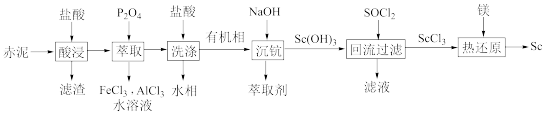
请回答下列问题:
(1)滤渣主要成分是
(2)“酸浸”时温度过高,酸浸速率反而减慢,其原因是
(3)“回流过滤”中稍过量SOCl2作用有将Sc(OH)3转化为ScCl3,作溶剂和
(4)“热还原”的化学方程式为
(5)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时最佳浓度
及料液温度分别为
[A的分离系数指分离后混合体系中A的物质的量分数,如βSc/Fe=
 ×100%]
×100%]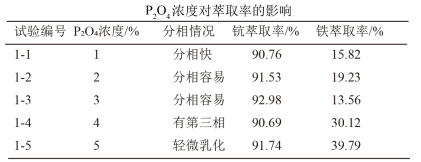
您最近一年使用:0次