名校
1 . 金银花中抗菌杀毒的有效成分为绿原酸,绿原酸的一种合成路线如图所示。
(1)A中含有的官能团名称为_______ ;B的化学名称为_______ 。
(2)D→E的化学方程式为_______ ,E→F的反应类型为_______ 。
(3) J与足量Na反应,生成
J与足量Na反应,生成 的体积(标准状况下)为
的体积(标准状况下)为_______ L。
(4)设计K→L的目的是_______ 。
(5)绿原酸在碱性条件下完全水解后,再酸化得到芳香族化合物M,N是M的同分异构体,写出其中一种符合下列条件的N的结构简式:_______ 。
A.能与 溶液发生显色反应
溶液发生显色反应
B.分子中只含有两种官能团
C.该分子的核磁共振氢谱图中有4组峰,且峰面积之比为3:2:2:1
(6)参考上述合成路线及所学知识,请设计一条以 和
和 为原料合成
为原料合成 的路线
的路线_______ (无机试剂任选)。

已知: 。
。
(1)A中含有的官能团名称为
(2)D→E的化学方程式为
(3)
 J与足量Na反应,生成
J与足量Na反应,生成 的体积(标准状况下)为
的体积(标准状况下)为(4)设计K→L的目的是
(5)绿原酸在碱性条件下完全水解后,再酸化得到芳香族化合物M,N是M的同分异构体,写出其中一种符合下列条件的N的结构简式:
A.能与
 溶液发生显色反应
溶液发生显色反应B.分子中只含有两种官能团
C.该分子的核磁共振氢谱图中有4组峰,且峰面积之比为3:2:2:1
(6)参考上述合成路线及所学知识,请设计一条以
 和
和 为原料合成
为原料合成 的路线
的路线
您最近一年使用:0次
7日内更新
|
56次组卷
|
2卷引用:河北省邢台市邢襄联盟2023-2024学年高二下学期5月第三次月考化学试题
名校
解题方法
2 . 乙酸苯酯是重要的药物中间体,它可以转化得到邻羟基苯乙酮和对羟基苯乙酮的混合物。一种制备乙酸苯酯的原理为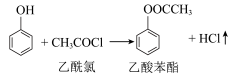 ,利用如图装置制备并提纯乙酸苯酯。
,利用如图装置制备并提纯乙酸苯酯。

已知所用试剂的部分物理性质如表所示:
| 物质 | 相对分子质量 | 部分物理性质 |
| 苯酚 | 94 | 常温下,纯净的苯酚是无色晶体,沸点为181.7℃,溶于水、乙醇,易溶于乙醚等有机溶剂 |
| 乙酰氯 | 78.5 | 常温下为无色发烟液体,沸点为52℃,溶于丙酮、乙醚等有机溶剂 |
| 乙酸苯酯 | 136 | 常温下为无色液体,沸点为195.5℃,微溶于水,可混溶于醇、氯仿、醚等有机溶剂 |
| 环己烷 | 84 | 常温下为无色有刺激性气味的液体,沸点为80.7℃,不溶于水,溶于乙醚、乙醇等有机溶剂 |
(1)仪器甲的名称为
(2)该原理制备乙酸苯酯的反应类型为
(3)其他条件相同,控制反应温度,不同温度下得到的乙酸苯酯的产率如表所示,选择表中
温度/℃ | 10 | 15 | 20 | 25 | 30 |
产率/% | 68.51 | 83.34 | 95.55 | 92.68 | 91.82 |
(4)实验结束后,进一步提纯乙酸苯酯的方法为
(5)在最佳温度下反应,最终得到乙酸苯酯的质量为
您最近一年使用:0次
7日内更新
|
30次组卷
|
2卷引用:河北省邢台市邢襄联盟2023-2024学年高二下学期5月第三次月考化学试题
名校
3 . 朱砂(硫化汞)能降低大脑中枢神经的兴奋性,有镇静安眠作用。其立方晶系β型晶胞如图所示,晶胞参数为a nm,A原子的分数坐标为(0,0,0),阿伏加德罗常数的值为NA,下列说法正确的是
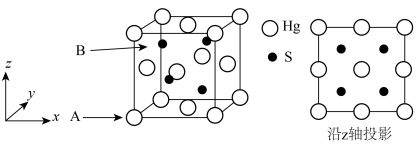
| A.S的配位数是8 |
B.晶胞中B原子分数坐标为( , ,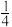 , , ) ) |
C.该晶体的密度ρ=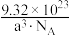 g/cm3 g/cm3 |
D.距离最近的两个Hg之间的距离为 a nm a nm |
您最近一年使用:0次
2024-06-06更新
|
130次组卷
|
2卷引用:河北省强基名校联盟2023-2024学年高二下学期高考一轮复习模底考试化学试题
解题方法
4 . 某溶液X中只可能含有 、Fe2+、Al3+、
、Fe2+、Al3+、 、
、 、Cl-、
、Cl-、 中的若干种。某研究性小组为探究该溶液的组成,进行了如下实验:
中的若干种。某研究性小组为探究该溶液的组成,进行了如下实验:
实验Ⅰ.取2000mL溶液X,加入足量的浓NaOH溶液并加热,共收集到5.6L(已换算成标准状况)气体A,反应过程中有沉淀产生,最终无沉淀产生;往反应后的溶液中通入足量CO2,充分反应后生成19.5g沉淀B。
实验Ⅱ.另取200mL溶液X,加入足量2mol·L-1BaCl2溶液,充分反应后生成58.25g白色沉淀C;将沉淀C加入盐酸中,无明显现象。
实验Ⅲ.另取200mL溶液X,加入盐酸酸化的FeCl2溶液,无明显现象。
请回答下列问题:
(1)实验过程中需要用BaCl2固体配制250mL2mol·L-1BaCl2溶液,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、___________ 、250mL容量瓶,容量瓶使用前需要___________ 。
(2)写出生成沉淀B的离子方程式___________ ,实验Ⅰ说明溶液中一定含有的离子有___________ 。
(3)实验Ⅱ中生成白色沉淀C后进行的操作为___________ 、___________ 、干燥、称量;由实验Ⅱ可知溶液X中含有___________ (填离子符号)。
(4)通过三组实验检验,溶液X中一定不含有的离子为___________ 。
 、Fe2+、Al3+、
、Fe2+、Al3+、 、
、 、Cl-、
、Cl-、 中的若干种。某研究性小组为探究该溶液的组成,进行了如下实验:
中的若干种。某研究性小组为探究该溶液的组成,进行了如下实验:实验Ⅰ.取2000mL溶液X,加入足量的浓NaOH溶液并加热,共收集到5.6L(已换算成标准状况)气体A,反应过程中有沉淀产生,最终无沉淀产生;往反应后的溶液中通入足量CO2,充分反应后生成19.5g沉淀B。
实验Ⅱ.另取200mL溶液X,加入足量2mol·L-1BaCl2溶液,充分反应后生成58.25g白色沉淀C;将沉淀C加入盐酸中,无明显现象。
实验Ⅲ.另取200mL溶液X,加入盐酸酸化的FeCl2溶液,无明显现象。
请回答下列问题:
(1)实验过程中需要用BaCl2固体配制250mL2mol·L-1BaCl2溶液,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、
(2)写出生成沉淀B的离子方程式
(3)实验Ⅱ中生成白色沉淀C后进行的操作为
(4)通过三组实验检验,溶液X中一定不含有的离子为
您最近一年使用:0次
名校
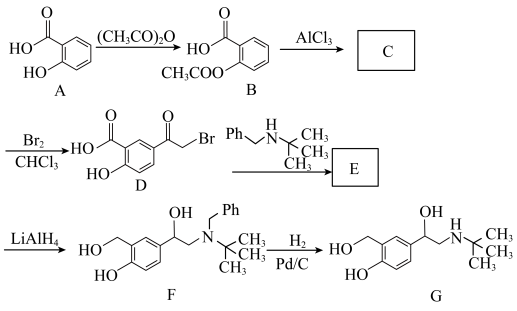
5 . 沙丁胺醇(G)是预防和治疗支气管哮喘的药物,其一种合成路线如下图所示:
回答下列问题:
(1)有机物A的化学名称为___________ ,B→C的过程为异构化反应,则有机物C的结构简式为___________ 。
(2)有机物D中含氧官能团的名称为___________ 。
(3)A→B的化学方程式为___________ 。
(4)E→F的化学反应类型为___________ 。
(5)芳香族化合物M为B的同分异构体,且1molM最多可与2molNaHCO3反应的结构有___________ 种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构为___________ (任写一种)。
(6)写出以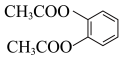 为原料制备
为原料制备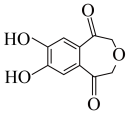 的合成路线(无机试剂及两个碳以下的有机试剂任选):
的合成路线(无机试剂及两个碳以下的有机试剂任选):___________ 。
回答下列问题:
(1)有机物A的化学名称为
(2)有机物D中含氧官能团的名称为
(3)A→B的化学方程式为
(4)E→F的化学反应类型为
(5)芳香族化合物M为B的同分异构体,且1molM最多可与2molNaHCO3反应的结构有
(6)写出以
 为原料制备
为原料制备 的合成路线(无机试剂及两个碳以下的有机试剂任选):
的合成路线(无机试剂及两个碳以下的有机试剂任选):
您最近一年使用:0次
6 . 乙烯和丙烯都是重要的化工原料,甲醇和丙烷共反应制备乙烯和丙烯可大幅度降低能耗,该反应体系中存在如下反应:
I.C3H8(g) C3H6(g)+H2(g) ΔH1=+124.20kJ/mol
C3H6(g)+H2(g) ΔH1=+124.20kJ/mol
Ⅱ.C3H8(g) CH4(g)+C2H4(g) ΔH2=+81.25 kJ/mol
CH4(g)+C2H4(g) ΔH2=+81.25 kJ/mol
Ⅲ.CH4(g)+C2H4(g) C3H6(g)+H2(g) ΔH3
C3H6(g)+H2(g) ΔH3
Ⅳ.CH3OH(g)+H2(g) CH4(g)+H2O(g) ΔH4=-115.93 kJ/mol
CH4(g)+H2O(g) ΔH4=-115.93 kJ/mol
(1)ΔH3=___________ 。
(2)630℃时,向盛有催化剂的真空容器中充入1molC3H8(g),保持容器压强为0.1MPa,进行反应,当反应达到平衡时,C3H8(g)的转化率为60%,C2H4(g)的平衡分压为0.0125MPa。
①此时p(C3H6)=___________ ,反应Ⅱ的分压平衡常数为Kp=___________ MPa。
②若向上述平衡体系中充入N2(g),再次达到平衡时C3H8(g)的转化率___________ (填“>”“<”或“=”)60%,其原因为___________ 。此时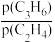 将会
将会___________ (填“变大”“变小”或“不变”)。
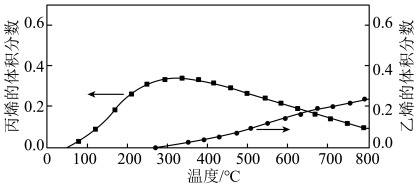
(3)若向盛有催化剂的真空容器中按物质的量之比4:1:1充入C3H8(g)、CH3OH(g)和H2O(g),仍在容器压强为0.1MPa下进行反应,平衡体系中C2H4(g)和C3H6(g)的体积分数随温度(T)的变化如图所示。解释300℃后,C3H6(g)的体积分数随温度(T)的变化的原因为___________ ;甲醇的作用为___________ 。
I.C3H8(g)
 C3H6(g)+H2(g) ΔH1=+124.20kJ/mol
C3H6(g)+H2(g) ΔH1=+124.20kJ/molⅡ.C3H8(g)
 CH4(g)+C2H4(g) ΔH2=+81.25 kJ/mol
CH4(g)+C2H4(g) ΔH2=+81.25 kJ/molⅢ.CH4(g)+C2H4(g)
 C3H6(g)+H2(g) ΔH3
C3H6(g)+H2(g) ΔH3Ⅳ.CH3OH(g)+H2(g)
 CH4(g)+H2O(g) ΔH4=-115.93 kJ/mol
CH4(g)+H2O(g) ΔH4=-115.93 kJ/mol(1)ΔH3=
(2)630℃时,向盛有催化剂的真空容器中充入1molC3H8(g),保持容器压强为0.1MPa,进行反应,当反应达到平衡时,C3H8(g)的转化率为60%,C2H4(g)的平衡分压为0.0125MPa。
①此时p(C3H6)=
②若向上述平衡体系中充入N2(g),再次达到平衡时C3H8(g)的转化率
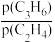 将会
将会(3)若向盛有催化剂的真空容器中按物质的量之比4:1:1充入C3H8(g)、CH3OH(g)和H2O(g),仍在容器压强为0.1MPa下进行反应,平衡体系中C2H4(g)和C3H6(g)的体积分数随温度(T)的变化如图所示。解释300℃后,C3H6(g)的体积分数随温度(T)的变化的原因为
您最近一年使用:0次
解题方法
7 . 钴配合物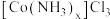 溶于热水,在冷水中微溶.某学习小组在实验室中制备
溶于热水,在冷水中微溶.某学习小组在实验室中制备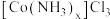 并测定其组成.
并测定其组成.
I.制备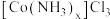 晶体
晶体
实验步骤:将 分批加入
分批加入 溶液中;控温至
溶液中;控温至 以下,加入活性炭、浓氨水后,再逐滴加入
以下,加入活性炭、浓氨水后,再逐滴加入 的双氧水;加热至
的双氧水;加热至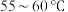 充分反应,然后进行操作①;将所得固体转入盛有少量盐酸的沸水中,再进行操作②;向所得混合液中,加入浓盐酸,冷却,过滤、用乙醇洗涤、干燥,得到
充分反应,然后进行操作①;将所得固体转入盛有少量盐酸的沸水中,再进行操作②;向所得混合液中,加入浓盐酸,冷却,过滤、用乙醇洗涤、干燥,得到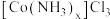 晶体.
晶体.
(1)温度保持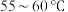 采用的合适加热方式为
采用的合适加热方式为________ .
(2)活性炭是反应的催化剂,写出制备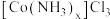 的化学方程式
的化学方程式________ .
(3)操作①和操作②分别为________ 、________ (填选项字母).
A.冷却、过滤 B.趁热过滤 C.蒸馏
(4)与水洗相比,用乙醇洗涤可减少晶体的溶解损耗,分析其原因为________ .
II.测定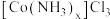 中
中 的值
的值
该小组同学采用如下图所示装置进行测定(夹持装置省略).
步骤ⅰ.向a中加入过量的 的
的 溶液;
溶液;
步骤ⅱ.打开 ,关闭
,关闭 ,将含
,将含 晶体的溶液和足量
晶体的溶液和足量 溶液分别由
溶液分别由 加入
加入 中,并用蒸馏水冲洗
中,并用蒸馏水冲洗 ;
;
步骤ⅲ.打开________,关闭________,并在 中保留少髷水;
中保留少髷水;
步骤ⅳ.加热 ,使水蒸气进入
,使水蒸气进入 ,充分反应;
,充分反应;
步骤ⅴ.对a中溶液进行滴定.
(5)f的作用为________ .
(6)步骤ⅱ中如果未用蒸馏水冲洗 ,会导致所测
,会导致所测 的值
的值________ (填“偏大”、“偏小”或“无影响”).
(7)将步骤ⅲ补充完整:打开________ ,关闭________ ,并在 中保留少量水.
中保留少量水.
(8)步骤ⅴ中,用 标准溶液滴定
标准溶液滴定 中的溶液,消耗
中的溶液,消耗 标准溶液.滴定时选用的指示剂为
标准溶液.滴定时选用的指示剂为________ ;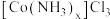 中
中
________ (用代数式表示).
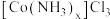 溶于热水,在冷水中微溶.某学习小组在实验室中制备
溶于热水,在冷水中微溶.某学习小组在实验室中制备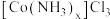 并测定其组成.
并测定其组成.I.制备
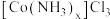 晶体
晶体实验步骤:将
 分批加入
分批加入 溶液中;控温至
溶液中;控温至 以下,加入活性炭、浓氨水后,再逐滴加入
以下,加入活性炭、浓氨水后,再逐滴加入 的双氧水;加热至
的双氧水;加热至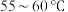 充分反应,然后进行操作①;将所得固体转入盛有少量盐酸的沸水中,再进行操作②;向所得混合液中,加入浓盐酸,冷却,过滤、用乙醇洗涤、干燥,得到
充分反应,然后进行操作①;将所得固体转入盛有少量盐酸的沸水中,再进行操作②;向所得混合液中,加入浓盐酸,冷却,过滤、用乙醇洗涤、干燥,得到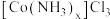 晶体.
晶体.(1)温度保持
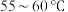 采用的合适加热方式为
采用的合适加热方式为(2)活性炭是反应的催化剂,写出制备
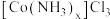 的化学方程式
的化学方程式(3)操作①和操作②分别为
A.冷却、过滤 B.趁热过滤 C.蒸馏
(4)与水洗相比,用乙醇洗涤可减少晶体的溶解损耗,分析其原因为
II.测定
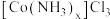 中
中 的值
的值该小组同学采用如下图所示装置进行测定(夹持装置省略).
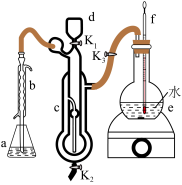
步骤ⅰ.向a中加入过量的
 的
的 溶液;
溶液;步骤ⅱ.打开
 ,关闭
,关闭 ,将含
,将含 晶体的溶液和足量
晶体的溶液和足量 溶液分别由
溶液分别由 加入
加入 中,并用蒸馏水冲洗
中,并用蒸馏水冲洗 ;
;步骤ⅲ.打开________,关闭________,并在
 中保留少髷水;
中保留少髷水;步骤ⅳ.加热
 ,使水蒸气进入
,使水蒸气进入 ,充分反应;
,充分反应;步骤ⅴ.对a中溶液进行滴定.
(5)f的作用为
(6)步骤ⅱ中如果未用蒸馏水冲洗
 ,会导致所测
,会导致所测 的值
的值(7)将步骤ⅲ补充完整:打开
 中保留少量水.
中保留少量水.(8)步骤ⅴ中,用
 标准溶液滴定
标准溶液滴定 中的溶液,消耗
中的溶液,消耗 标准溶液.滴定时选用的指示剂为
标准溶液.滴定时选用的指示剂为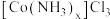 中
中
您最近一年使用:0次
解题方法
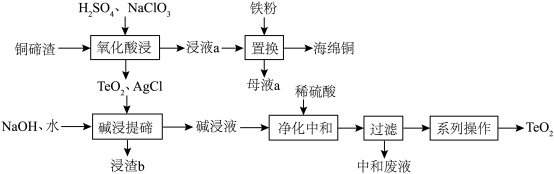
8 . 二氧化碲(TeO2)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为Cu2Te,还含有少量Cu,Ag)为原料制备TeO2并获得海绵铜的工艺流程如图所示。
(1)Te位于元素周期表的___________ 族。
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为___________ ,为了加快反应速率,不可以采取的措施为___________ (写字母)
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:______ 。
□Ag+□H++□ =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。
③若使用稀硝酸代替NaClO3,不足之处可能是___________ 。
(3)“碱浸提碲”时,TeO2反应的化学方程式为___________ ,浸渣b的主要成分为___________ 。
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为___________ 。
(1)Te位于元素周期表的
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:
□Ag+□H++□
 =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。③若使用稀硝酸代替NaClO3,不足之处可能是
(3)“碱浸提碲”时,TeO2反应的化学方程式为
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为
您最近一年使用:0次
名校
解题方法
9 . 某化学兴趣小组在研究“铁及其化合物性质”时,发现向 溶液中滴加2滴
溶液中滴加2滴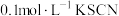 溶液;无明显现象,再滴加
溶液;无明显现象,再滴加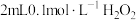 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
(1)溶液先变红的原因是____________ 、____________ (用两个离子方程式表示)。
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是 被
被 还原。取褪色后溶液,滴加
还原。取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。
Ⅱ.乙同学认为是 被氧化。取褪色后溶液,滴加
被氧化。取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。
根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为 被
被 氧化。
氧化。
丙同学认为____________ 。
为了探究溶液褪色的原因究竟是上述的哪一种,该兴趣小组进行了如下实验。向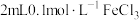 溶液中滴加2滴
溶液中滴加2滴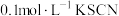 溶液,后通入
溶液,后通入 ,发现溶液
,发现溶液___________ ,证明溶液褪色的原因不是乙同学认为的原因,而是丙同学认为的原因。
(3)该兴趣小组通过查阅资料,发现 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体,写出上述实验中
和两种可直接排放到空气中的气体,写出上述实验中 被氧化的离子方程式:
被氧化的离子方程式:_________ 。
(4)根据题目所给信息及实验现象推断物质还原性强弱:
____________  (填“>”或“<”)
(填“>”或“<”)
 溶液中滴加2滴
溶液中滴加2滴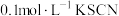 溶液;无明显现象,再滴加
溶液;无明显现象,再滴加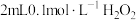 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:(1)溶液先变红的原因是
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是
 被
被 还原。取褪色后溶液,滴加
还原。取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。Ⅱ.乙同学认为是
 被氧化。取褪色后溶液,滴加
被氧化。取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为
 被
被 氧化。
氧化。丙同学认为
为了探究溶液褪色的原因究竟是上述的哪一种,该兴趣小组进行了如下实验。向
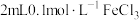 溶液中滴加2滴
溶液中滴加2滴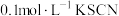 溶液,后通入
溶液,后通入 ,发现溶液
,发现溶液(3)该兴趣小组通过查阅资料,发现
 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体,写出上述实验中
和两种可直接排放到空气中的气体,写出上述实验中 被氧化的离子方程式:
被氧化的离子方程式:(4)根据题目所给信息及实验现象推断物质还原性强弱:

 (填“>”或“<”)
(填“>”或“<”)
您最近一年使用:0次
名校
解题方法
10 . 某工厂的工业废水中含有大量在 和较多的
和较多的 、
、 ,为减少污染并促进废物利用,工厂计划从该废液中回收
,为减少污染并促进废物利用,工厂计划从该废液中回收 和金属铜并制得明矾,请根据以下流程图,回答下列问题:
和金属铜并制得明矾,请根据以下流程图,回答下列问题: ____________ 。
(2)生成沉淀B的离子方程式为______________ ;一系列操作a包含_____________ 、过滤、洗涤、干燥。
(3)溶液B中加入过量试剂Y发生化合反应的离子方程式为____________ 。
(4)鉴别滤液D中金属阳离子的方法是____________ (任写一种)。
(5)绿矾在空气中容易被部分氧化,现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的 溶液,过滤得沉淀4.66g,再通入56mL(标准状况)氯气恰好将其中的
溶液,过滤得沉淀4.66g,再通入56mL(标准状况)氯气恰好将其中的 完全氧化。
完全氧化。
①为确定绿矾未被全部氧化,可选择的最佳试剂是____________ (填标号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
②推测晶体中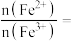
____________ 。
 和较多的
和较多的 、
、 ,为减少污染并促进废物利用,工厂计划从该废液中回收
,为减少污染并促进废物利用,工厂计划从该废液中回收 和金属铜并制得明矾,请根据以下流程图,回答下列问题:
和金属铜并制得明矾,请根据以下流程图,回答下列问题: 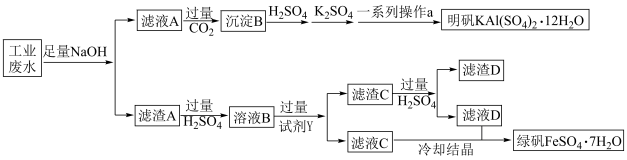
(2)生成沉淀B的离子方程式为
(3)溶液B中加入过量试剂Y发生化合反应的离子方程式为
(4)鉴别滤液D中金属阳离子的方法是
(5)绿矾在空气中容易被部分氧化,现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的
 溶液,过滤得沉淀4.66g,再通入56mL(标准状况)氯气恰好将其中的
溶液,过滤得沉淀4.66g,再通入56mL(标准状况)氯气恰好将其中的 完全氧化。
完全氧化。①为确定绿矾未被全部氧化,可选择的最佳试剂是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液②推测晶体中
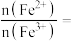
您最近一年使用:0次



