名校
1 . 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中只有C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
请回答下列问题:
(1)C是_______ (填元素名称)。
(2)上述元素中位于s区的有_______ (填元素符号)。
(3)与 互为等电子体的阴离子为
互为等电子体的阴离子为_______ 。
(4)已知C的氧化物CO与NiO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO_____ NiO(填“>”“<”或“=”)。
(5)浸金时,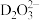 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成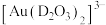 。
。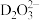 中的配位原子为
中的配位原子为_____ (填元素符号),其位置在______ (填“中心”或“端位”),理由是______ 。
 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。请回答下列问题:
(1)C是
(2)上述元素中位于s区的有
(3)与
 互为等电子体的阴离子为
互为等电子体的阴离子为(4)已知C的氧化物CO与NiO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO(5)浸金时,
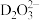 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成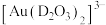 。
。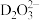 中的配位原子为
中的配位原子为
您最近一年使用:0次
名校
2 . 冠醚是一种超分子,它是由多个二元醇分子之间脱水形成的环状化合物。18—冠—6可用作相转移催化其与 形成的螯合离子结构如图所示。下列说法正确的是
形成的螯合离子结构如图所示。下列说法正确的是
 形成的螯合离子结构如图所示。下列说法正确的是
形成的螯合离子结构如图所示。下列说法正确的是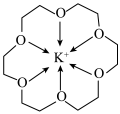
| A.该螯合离子形成的晶体类型为分子晶体 |
B.与二甲醚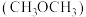 相比,该整合离子中“C-O-C”键角更大 相比,该整合离子中“C-O-C”键角更大 |
| C.该螯合离子中碳原子与氧原子杂化类型不同 |
| D.该螯合离子中所有非氢原子可以位于同一平面 |
您最近一年使用:0次
名校
3 . 合成氨反应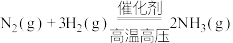 是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
(1)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:
①写出N2参与化学吸附的反应方程式:_____________ 。
②以上历程须克服的最大能垒为______ eV。
(2)t℃、0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:
______  ,该反应的
,该反应的
______ (用数字表达式表示,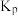 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
②下列叙述能说明该条件下反应达到平衡状态的是______ (填标号)。
a.氨气的体积分数保持不变
b.容器中氢氮比保持不变
c.N2和NH3的平均反应速率之比为1∶2
d.气体密度保持不变
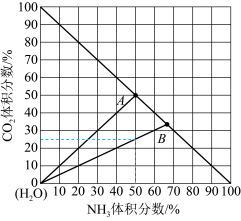
(3)如图是20℃时,NH3-CO2-H2O三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。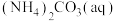 与
与 ,也可选择无水体系反应得到
,也可选择无水体系反应得到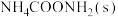 。
。
①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq)的最佳曲线是______ (填“A-H2O”或“B-H2O”)。
②B点可得到的产品是______ (填化学式)。
(4)钌系催化剂是目前合成氨最先进的催化剂。一种钌的化合物晶胞结构如图。该晶胞中与 等距最近的
等距最近的 有
有______ 个,若该晶胞边长为a pm,该晶体的密度为______  (
(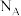 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
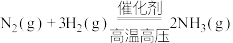 是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:(1)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:

①写出N2参与化学吸附的反应方程式:
②以上历程须克服的最大能垒为
(2)t℃、0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:


 ,该反应的
,该反应的
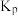 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。②下列叙述能说明该条件下反应达到平衡状态的是
a.氨气的体积分数保持不变
b.容器中氢氮比保持不变
c.N2和NH3的平均反应速率之比为1∶2
d.气体密度保持不变
(3)如图是20℃时,NH3-CO2-H2O三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。
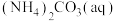 与
与 ,也可选择无水体系反应得到
,也可选择无水体系反应得到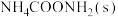 。
。①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq)的最佳曲线是
②B点可得到的产品是
(4)钌系催化剂是目前合成氨最先进的催化剂。一种钌的化合物晶胞结构如图。该晶胞中与
 等距最近的
等距最近的 有
有 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
4 . 化合物Ⅷ是一种用于制备神经抑制剂的中间体,其合成路线如下:
(1)化合物Ⅰ的分子式是________ 。化合物Ⅷ中的非含氧官能团的名称是________ 。
(2)化合物Ⅰ的沸点高于化合物Ⅱ,其原因是____________ 。
(3)反应①是原子利用率100%的反应,则a为________ 。
(4)反应②的反应类型为________ 。
(5)化合物Ⅲ有多种同分异构体,其中含 结构的有
结构的有________ 种(不计Ⅲ),其中核磁共振氢谱的峰面积比为6∶1∶1的结构简式为________ (写出其中一种)。
(6)写出以 和乙醇为原料合成化合物
和乙醇为原料合成化合物 的单体的合成路线(无机试剂任用)
的单体的合成路线(无机试剂任用)_______________ 。

(1)化合物Ⅰ的分子式是
(2)化合物Ⅰ的沸点高于化合物Ⅱ,其原因是
(3)反应①是原子利用率100%的反应,则a为
(4)反应②的反应类型为
(5)化合物Ⅲ有多种同分异构体,其中含
 结构的有
结构的有(6)写出以
 和乙醇为原料合成化合物
和乙醇为原料合成化合物 的单体的合成路线(无机试剂任用)
的单体的合成路线(无机试剂任用)
您最近一年使用:0次
名校
解题方法
5 . 一种制备 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数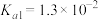 ,
,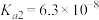 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数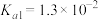 ,
,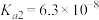 。下列说法正确的是
。下列说法正确的是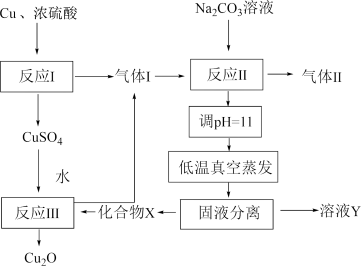
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比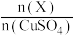 增大时,需补加 增大时,需补加 的量增多 的量增多 |
您最近一年使用:0次
2024-06-10更新
|
100次组卷
|
4卷引用:福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题
名校
6 . 下列实验操作、现象与结论相匹配的是
选项 | 实验操作 | 现象 | 结论 |
A | 常温,分别测定浓度均为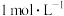 NaCl溶液和CH3COONH4溶液的pH NaCl溶液和CH3COONH4溶液的pH | pH均等于7 | 常温下,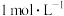 的NaCl溶液和CH3COONH4溶液中水的电离程度相等 的NaCl溶液和CH3COONH4溶液中水的电离程度相等 |
B | 常温,将50 mL苯与50 mL CH3COOH混合 | 混合溶液体积为101 mL | 混合过程中削弱了CH3COOH分子间的氢键,且CH3COOH分子与苯间的作用弱于氢键 |
C | 向Na2SO3和Na2S混合溶液中加入浓硫酸 | 溶液中出现淡黄色沉淀 | +4价和-2价硫可归中为0价 |
D | 取一小块鸡皮于表面皿上,将几滴浓硝酸滴到鸡皮上 | 一段时间后鸡皮变黄 | 鸡皮中含有脂肪 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
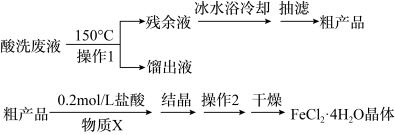
7 . 镀锌钢构件的酸洗废液中含有2.5mol。L-1盐酸、50%FeCl2·4H2O和2%ZnCl2。实验室从酸洗废液中回收盐酸和FeCl2·4H2O的实验流程如下:
回答下列问题:
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择___________ (填序号)。
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能___________ 。
②如果残余液过多,可能会导致___________ 。(答一条)
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是___________ 。
(4)重结晶前加入的物质X为___________ ;操作2的名称是___________ 。
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为___________ %(用含a、c的最简代数式表示)。
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。___________ 。
②亚甲基蓝中N原子的杂化方式有___________ 。
③DMA的碱性比苯胺强,说明理由___________ 。
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| FeCl2 | 49.7 | 59.0 | 62.5 | 66.7 | 70.0 | 78.3 | 88.7 | 94.9 |
| ZnCl2 | 342 | 363 | 395 | 437 | 452 | 488 | 541 | 614 |
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能
②如果残余液过多,可能会导致
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是
(4)重结晶前加入的物质X为
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。

②亚甲基蓝中N原子的杂化方式有
③DMA的碱性比苯胺强,说明理由
您最近一年使用:0次
8 . 乙二胺四乙酸(EDTA)是一种重要的络合剂,其能与绝大多数的金属离子形成稳定的配合物,简易机理如图所示。下列叙述错误的是

| A.EDTA的核磁共振氢谱上有3组峰 | B.EDTA中含有两种官能团 |
| C.螯合物中含有4个sp2-pπ键 | D.螯合物中有5个五元螯合环 |
您最近一年使用:0次
9 . 湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为________ 。
(2)“酸浸”中滤渣主要成分为________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:_________ 。
(5)“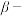 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为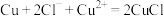 ,该反应的平衡常数
,该反应的平衡常数
________ 。[已知: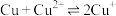
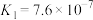 ;
; ]
]
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
________ ,
________ ;充电过程中ZnS到 的电极反应式为
的电极反应式为________ (x和y用具体数字表示)。
②若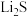 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为________ nm。
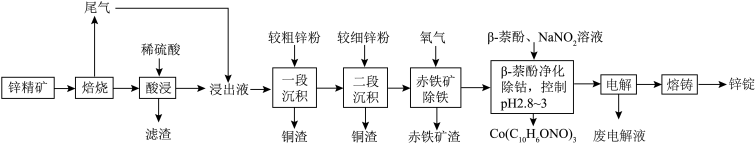
 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
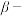 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为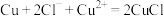 ,该反应的平衡常数
,该反应的平衡常数
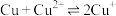
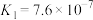 ;
; ]
](7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
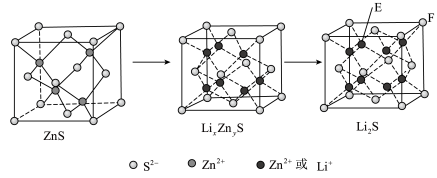


 的电极反应式为
的电极反应式为②若
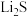 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
您最近一年使用:0次
名校
解题方法
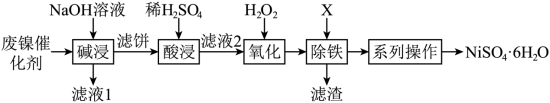
10 . 利用油脂厂废弃镍(Ni)催化剂(主要含有Ni,还含少量Al、Fe、NiO、Al2O3、Fe2O3)制备NiSO4·6H2O的工艺流程如下:
(1)为了加快“碱浸”的速率可以采取的措施是_______ (任写两条)。
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式____ 。
(3)“滤液2” 中含金属阳离子有_______ 。
(4)①“氧化”中反应的离子反应方程式是_______ 。
②“氧化”中可以代替H2O2的最佳物质是_______ (填标号)。
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的_______ 。
a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法_______ 。
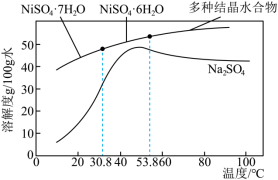
③结晶:将滤液蒸发、降温至稍高于_______ ℃结晶,过滤即获得产品,硫酸镍晶体溶解度曲线图如图所示。
(1)为了加快“碱浸”的速率可以采取的措施是
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式
(3)“滤液2” 中含金属阳离子有
(4)①“氧化”中反应的离子反应方程式是
②“氧化”中可以代替H2O2的最佳物质是
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O
 Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法
③结晶:将滤液蒸发、降温至稍高于
您最近一年使用:0次



