名校
解题方法
1 . 茶是中国人喜爱的一种饮品,茶叶中含有铁元素,可以用以下实验操作检验茶叶中的铁元素:A.取少量茶叶;B.检验滤液中的 Fe3+;C.过滤得到滤液;D.将茶叶灼烧为茶叶灰;E.用足量稀盐酸溶解茶叶灰,并加蒸馏水稀释;请回答下列问题。
(1)上述实验操作的正确顺序是___________ (填字母)。
(2)操作D所用仪器有:酒精灯、三脚架、泥三角、玻璃棒、___________ 。
(3)请选择检验滤液中含有Fe3+的最佳方法并写出相关反应的离子方程式___________ 。
(4)很多人喜欢用铁壶泡茶,请写出铁壶泡茶时可能发生反应的离子方程式___________ 。
(1)上述实验操作的正确顺序是
(2)操作D所用仪器有:酒精灯、三脚架、泥三角、玻璃棒、
(3)请选择检验滤液中含有Fe3+的最佳方法并写出相关反应的离子方程式
(4)很多人喜欢用铁壶泡茶,请写出铁壶泡茶时可能发生反应的离子方程式
您最近一年使用:0次
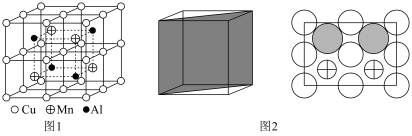
2 . 2022年北京冬季奥运会场馆建设使用了大量不锈钢材质,不锈钢属于铁碳合金,常含铬(Cr)、镍(Ni)等元素。回答下列问题:
(1)某铁酸盐晶体结构模型如图所示。该晶体的化学式是______ ,在晶体中1个Co原子周围距离最近的O原子数目为______ 个。______ 个,该铁镁合金中原子个数比
______ ;原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为 ,C为
,C为 ,B点坐标参数为
,B点坐标参数为______ . ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体中铬原子的半径为
,则晶体中铬原子的半径为______ cm(用含 的表达式表示)。
的表达式表示)。
(1)某铁酸盐晶体结构模型如图所示。该晶体的化学式是


 ,C为
,C为 ,B点坐标参数为
,B点坐标参数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体中铬原子的半径为
,则晶体中铬原子的半径为 的表达式表示)。
的表达式表示)。
A.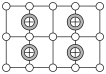 | B. | C. | D.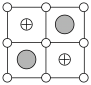 |
您最近一年使用:0次
名校
3 . 苯巴比妥是一种巴比妥类的镇静剂及安眠药,其合成路线如下所示(部分试剂和产物已略去):
(1)A B的反应试剂与条件为
B的反应试剂与条件为________ ,E含有的官能团名称为________ 。
(2)D的化学名称为________ 。
(3)F 苯巴比妥的化学方程式为
苯巴比妥的化学方程式为________ 。
(4)符合下列条件的苯巴比妥的同分异构体共有________ 种。
①分子中有2个苯环 ②既能与NaOH溶液反应也能与盐酸反应 ③核磁共振氢谱共5组峰
(5)苯巴比妥钠(结构为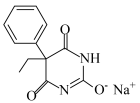 )是苯巴比妥的钠盐,两者均有镇静安眠的疗效。请从结构—性质—用途的角度分析以下原因:
)是苯巴比妥的钠盐,两者均有镇静安眠的疗效。请从结构—性质—用途的角度分析以下原因:
①苯巴比妥钠比苯巴比妥更适用于静脉注射:________
②苯巴比妥钠的水溶液易变质,需制成粉针剂(将药物与试剂混合后,经消毒干燥形成的粉状物品)保存:________ 。
(6)乙基巴比妥也是一种常用镇静剂,可用 和
和 等为原料合成,参照上述合成路线,在方框内写出相应的有机物,在箭头上下方写出适当的反应条件,将合成路线补充完整
等为原料合成,参照上述合成路线,在方框内写出相应的有机物,在箭头上下方写出适当的反应条件,将合成路线补充完整_______ 。

已知:ⅰ.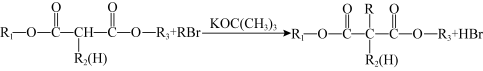
ⅱ.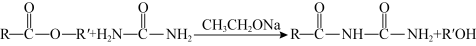
(1)A
 B的反应试剂与条件为
B的反应试剂与条件为(2)D的化学名称为
(3)F
 苯巴比妥的化学方程式为
苯巴比妥的化学方程式为(4)符合下列条件的苯巴比妥的同分异构体共有
①分子中有2个苯环 ②既能与NaOH溶液反应也能与盐酸反应 ③核磁共振氢谱共5组峰
(5)苯巴比妥钠(结构为
 )是苯巴比妥的钠盐,两者均有镇静安眠的疗效。请从结构—性质—用途的角度分析以下原因:
)是苯巴比妥的钠盐,两者均有镇静安眠的疗效。请从结构—性质—用途的角度分析以下原因:①苯巴比妥钠比苯巴比妥更适用于静脉注射:
②苯巴比妥钠的水溶液易变质,需制成粉针剂(将药物与试剂混合后,经消毒干燥形成的粉状物品)保存:
(6)乙基巴比妥也是一种常用镇静剂,可用
 和
和 等为原料合成,参照上述合成路线,在方框内写出相应的有机物,在箭头上下方写出适当的反应条件,将合成路线补充完整
等为原料合成,参照上述合成路线,在方框内写出相应的有机物,在箭头上下方写出适当的反应条件,将合成路线补充完整
您最近一年使用:0次
4 . 甲硫醇(CH3SH)是重要的有机化工中间体,可用于合成维生素。通过CH3OH和H2S合成CH3SH的主要反应为:
Ⅰ.
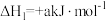
Ⅱ.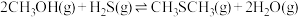
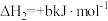
回答下列问题:
(1)计算反应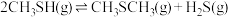 的△H=
的△H=________ kJ/mol。
(2)T1℃时,向恒容密闭容器中充入一定量CH3OH(g)和H2S(g)发生反应,下列事实能说明反应达到平衡状态的是________ (填选项字母);若按相同比例再充入一定量CH3OH(g)和H2S(g),CH3OH(g)的平衡转化率将________ (填“变大”“变小”或“不变”)。
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.H2S(g)的体积分数不再发生变化 D.CH3SCH3(g)和H2O(g)的物质的量之比不再变化
(3)T2℃时,向压强为P0的恒压密闭容器中按物质的量之比为1:2充入CH3OH(g)和H2S(g)发生反应,达到平衡时,CH3OH(g)的转化率为80%,CH3SCH3(g)的体积分数为5%。
①计算H2S(g)的选择性为________ (CH3SH的选择性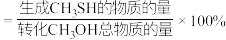 )。
)。
②反应Ⅰ的平衡常数Kp=________ (Kp是用分压表示的平衡常数,结果保留两位小数)。
(4)在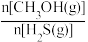 =1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。
=1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。________ Mpa/min(结果保留两位有效数字)。
②当温度高于370℃时,CH3OH(g)转化率随温度升高而降低的原因可能为________ 。
③从电负性的角度描述ⅲ→ⅰ中脱水的过程:________ 。
Ⅰ.

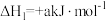
Ⅱ.
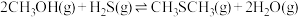
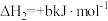
回答下列问题:
(1)计算反应
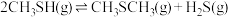 的△H=
的△H=(2)T1℃时,向恒容密闭容器中充入一定量CH3OH(g)和H2S(g)发生反应,下列事实能说明反应达到平衡状态的是
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.H2S(g)的体积分数不再发生变化 D.CH3SCH3(g)和H2O(g)的物质的量之比不再变化
(3)T2℃时,向压强为P0的恒压密闭容器中按物质的量之比为1:2充入CH3OH(g)和H2S(g)发生反应,达到平衡时,CH3OH(g)的转化率为80%,CH3SCH3(g)的体积分数为5%。
①计算H2S(g)的选择性为
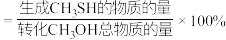 )。
)。②反应Ⅰ的平衡常数Kp=
(4)在
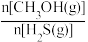 =1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。
=1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。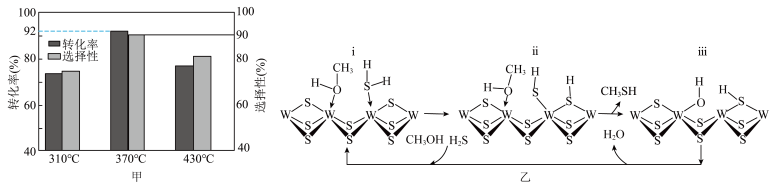
②当温度高于370℃时,CH3OH(g)转化率随温度升高而降低的原因可能为
③从电负性的角度描述ⅲ→ⅰ中脱水的过程:
您最近一年使用:0次
名校
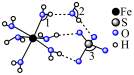
5 . 某实验小组探究 的制取、性质及其应用。按要求回答下列问题。
的制取、性质及其应用。按要求回答下列问题。
已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)
(无色)
【实验ⅰ】探究 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略) 溶液(
溶液( )中通入
)中通入 一段时间,至C中溶液的pH为7时向其中滴加一定量
一段时间,至C中溶液的pH为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。
(1)盛装稀盐酸的仪器名称为________ ,试剂a为________ 。
(2)向 溶液中通入
溶液中通入 的目的可能是
的目的可能是________ 。
(3)pH为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为________ 。
(4)同学甲在C中出现白色沉淀之后继续通 ,阐述你认为同学甲的操作合理与否及理由
,阐述你认为同学甲的操作合理与否及理由________ 。
【实验ⅱ和实验ⅲ】探究 的性质
的性质 ,请写出步骤②反应的离子方程式:
,请写出步骤②反应的离子方程式:_________ 。
(6)对比实验ⅱ和实验ⅲ,得出实验结论(填1点即可):_________ 。
【实验ⅳ】探究 的应用
的应用
(7)将 溶于乳酸
溶于乳酸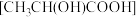 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是________ 。
 的制取、性质及其应用。按要求回答下列问题。
的制取、性质及其应用。按要求回答下列问题。已知:①
 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)
(无色)【实验ⅰ】探究
 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略)实验i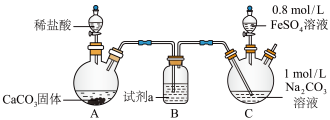
 溶液(
溶液( )中通入
)中通入 一段时间,至C中溶液的pH为7时向其中滴加一定量
一段时间,至C中溶液的pH为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。(1)盛装稀盐酸的仪器名称为
(2)向
 溶液中通入
溶液中通入 的目的可能是
的目的可能是(3)pH为7时滴加一定量
 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为(4)同学甲在C中出现白色沉淀之后继续通
 ,阐述你认为同学甲的操作合理与否及理由
,阐述你认为同学甲的操作合理与否及理由【实验ⅱ和实验ⅲ】探究
 的性质
的性质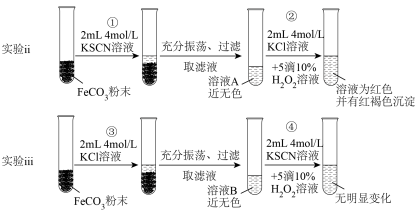
 ,请写出步骤②反应的离子方程式:
,请写出步骤②反应的离子方程式:(6)对比实验ⅱ和实验ⅲ,得出实验结论(填1点即可):
【实验ⅳ】探究
 的应用
的应用(7)将
 溶于乳酸
溶于乳酸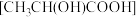 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
您最近一年使用:0次
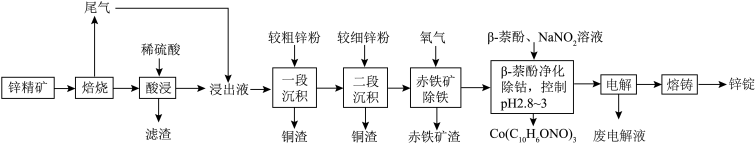
6 . 湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为________ 。
(2)“酸浸”中滤渣主要成分为________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:_________ 。
(5)“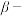 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为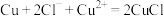 ,该反应的平衡常数
,该反应的平衡常数
________ 。[已知: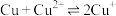
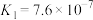 ;
; ]
]
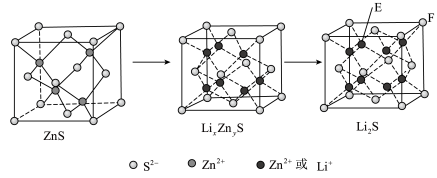
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
________ ,
________ ;充电过程中ZnS到 的电极反应式为
的电极反应式为________ (x和y用具体数字表示)。
②若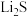 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为________ nm。
 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
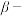 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为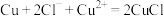 ,该反应的平衡常数
,该反应的平衡常数
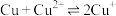
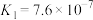 ;
; ]
](7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。


 的电极反应式为
的电极反应式为②若
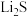 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
您最近一年使用:0次
名校
解题方法
7 . 某化学卷发水、烫发剂主要成分的结构如图所示,已知W、X、Y、Z、M均为短周期主族元素,且原子序数依次增大。下列说法正确的是
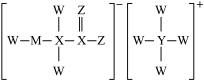
A.第一电离能大小比较: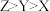 |
B.简单氢化物的沸点: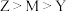 |
| C.X最高价氧化物对应的水化物能够促进水的电离 |
D.由W、X、Y、M四种元素组成的某种盐可与 发生显色反应 发生显色反应 |
您最近一年使用:0次
名校
解题方法
8 . 宏观辩识与微观探析是化学学科核心素养之一,下列化学变化对应的离子方程式正确的是
A.少量 通入到NaClO溶液中: 通入到NaClO溶液中: |
B.向含氯化铁的氯化镁溶液中加入氧化镁: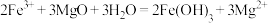 |
C.用氢氟酸生产磨砂玻璃的反应: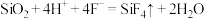 |
D.向 溶液加入适量 溶液加入适量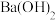 溶液至 溶液至 恰好完全沉淀: 恰好完全沉淀: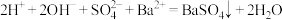 |
您最近一年使用:0次
名校
解题方法
9 . 观察下列结构示意图并结合相关信息,判断有关说法不正确的是
| 名称或化学式 | 玛瑙 | 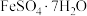 | 18-冠-6 |  |
| 结构示意图 |
|
|
|
|
A.玛瑙,又名马脑、码瑙或马瑙,属于共价晶体,且两种原子个数比为 |
B.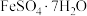 结构中键角1、2、3由大到小的顺序: 结构中键角1、2、3由大到小的顺序: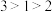 |
C.18-冠-6中O(灰球)电负性大,带负电荷,通过离子键与 作用,体现了超分子“分子识别”的特征 作用,体现了超分子“分子识别”的特征 |
D.固态硫 中S原子均为 中S原子均为 杂化 杂化 |
您最近一年使用:0次
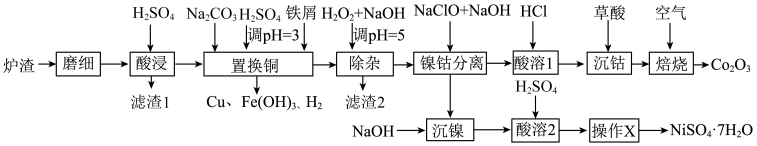
10 . 酸浸法回收废炉渣中(主要为铜、钴、镍、铁等金属元素的氧化物)的铜、钴、镍的流程如下: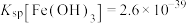 ,
, .
.
(1)“磨细”过程的目的是____________ .
(2)酸浸液中大量铁元素以 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为____________ .
(3)“滤渣2”主要成分为______ (填化学式)。
(4)“镍钴分离”过程 发生反应的离子方程式为
发生反应的离子方程式为____________ .
(5)“酸溶1”过程用 替换HCl,从绿色化学角度分析其可行性
替换HCl,从绿色化学角度分析其可行性____________ 。
(6)“焙烧”过程发生反应的化学方程式为____________ 。
(7)已知当 mol⋅L
mol⋅L 时,认为其沉淀完全。“沉镍”过程的目的是为了将
时,认为其沉淀完全。“沉镍”过程的目的是为了将 .此时应调节溶液的pH为
.此时应调节溶液的pH为______ 。
(8)“操作X”采用的结晶方法为______ 。
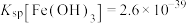 ,
, .
.(1)“磨细”过程的目的是
(2)酸浸液中大量铁元素以
 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为(3)“滤渣2”主要成分为
(4)“镍钴分离”过程
 发生反应的离子方程式为
发生反应的离子方程式为(5)“酸溶1”过程用
 替换HCl,从绿色化学角度分析其可行性
替换HCl,从绿色化学角度分析其可行性(6)“焙烧”过程发生反应的化学方程式为
(7)已知当
 mol⋅L
mol⋅L 时,认为其沉淀完全。“沉镍”过程的目的是为了将
时,认为其沉淀完全。“沉镍”过程的目的是为了将 .此时应调节溶液的pH为
.此时应调节溶液的pH为(8)“操作X”采用的结晶方法为
您最近一年使用:0次