1 . 已知X、Y是主族元素,I为电离能,单位是kJ·mol 。请根据下表数据判断下列说法中错误的是
。请根据下表数据判断下列说法中错误的是
 。请根据下表数据判断下列说法中错误的是
。请根据下表数据判断下列说法中错误的是| 元素 |  |  |  |  |
| x | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A.元素X的常见化合价是+1价 | B.元素X与氯形成化合物时,化学式可能是XCl |
| C.元素Y是第IIIA族元素 | D.若元素Y处于第三周期,它可与冷水剧烈反应 |
您最近一年使用:0次
2 . 下列说法正确的是
A.6C的电子排布式1s22s22 ,违反了泡利不相容原理 ,违反了泡利不相容原理 |
| B.价电子排布为5s25p2的元素位于第5周期IIA族,是p区元素 |
| C.ns电子的能量一定高于(n-1)p电子的能量 |
| D.电子排布式(26Fe)1s22s22p63s23p63d64s2违反了洪特规则 |
您最近一年使用:0次
3 . 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)分别向Na2SiO3溶液中加入下列物质,能生成不溶于NaOH溶液的白色沉淀的是________ 。
①K ②稀盐酸 ③CaCl2溶液 ④KNO3溶液
(2)胃舒平的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·4H2O)等化合物。写出三硅酸镁的氧化物形式为_______________ 。
(3)为什么实验室中盛放NaOH溶液的试剂瓶不能用玻璃塞(用离子方程式表示):_________________ 。
(4)当前制备高纯硅的主要生产过程示意图如下:_________________ 。
②高纯硅的用途:_____________ 。(写出一种)
③整个制备过程必须严格控制无水无氧。H2还原SiHCl3过程中若混有O2,可能引起的后果是_______________ 。
(1)分别向Na2SiO3溶液中加入下列物质,能生成不溶于NaOH溶液的白色沉淀的是
①K ②稀盐酸 ③CaCl2溶液 ④KNO3溶液
(2)胃舒平的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·4H2O)等化合物。写出三硅酸镁的氧化物形式为
(3)为什么实验室中盛放NaOH溶液的试剂瓶不能用玻璃塞(用离子方程式表示):
(4)当前制备高纯硅的主要生产过程示意图如下:

②高纯硅的用途:
③整个制备过程必须严格控制无水无氧。H2还原SiHCl3过程中若混有O2,可能引起的后果是
您最近一年使用:0次
4 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A、B、C、D为短周期元素,且只有A、D为非金属元素。A的氢化物溶于水得到的溶液能使酚酞溶液变红。B、C、D的最高价氧化物对应水化物相互之间能够两两反应,且D原子最外层电子数是C原子最外层电子数的2倍。B、E元素同主族,且原子序数相差8。
(1)E在元素周期表中的位置:___________ ,写出E的最高价氧化物对应水化物与C的单质反应的化学方程式:___________ 。
(2)A的氢化物溶于水后的电离方程式为___________ ;实验室制备A的氢化物的化学方程式为___________ 。
(3)B单质在空气中燃烧后的产物为___________ ,写出该产物和水反应的离子方程式:___________ 。
(1)E在元素周期表中的位置:
(2)A的氢化物溶于水后的电离方程式为
(3)B单质在空气中燃烧后的产物为
您最近一年使用:0次
5 . 铁和硒(Se)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:___________ ,其价电子轨道表示式为___________ 。
②比较键角大小:气态SeO3分子___________ Se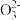 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是___________ 。
(2)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将N3-转化为N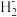 ,反应过程如图所示:
,反应过程如图所示:___________ 。
②与N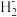 互为等电子体的一种分子为
互为等电子体的一种分子为___________ (填化学式)。
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

②比较键角大小:气态SeO3分子
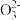 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(2)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将N3-转化为N
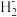 ,反应过程如图所示:
,反应过程如图所示: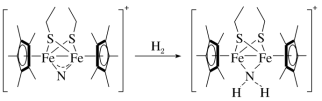
②与N
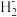 互为等电子体的一种分子为
互为等电子体的一种分子为
您最近一年使用:0次
6 . 铁及其化合物是日常生活生产中应用广泛的材料。请回答下列问题:
(1)1mol基态铁原子中未成对的电子数为___________ 。
(2)铁的常见氧化物中氧化铁比氧化亚铁稳定,试从原子结构角度解释原因:___________ 。
(3)铁作为过渡金属,能形成多种配位化合物。赤血盐{K3[Fe(CN)6]}为红色晶体,其配离子中提供空轨道的为___________ (填微粒符号),配位原子是___________ (填元素符号);Fe2+与1,10-邻二氮菲(phen)在水溶液中能形成稳定的螯合物,其结构如图,该螯合物中各元素的电负性由大到小的顺序为___________ ,N的杂化方式为___________ ,Fe2+的配位数为___________ 。
(1)1mol基态铁原子中未成对的电子数为
(2)铁的常见氧化物中氧化铁比氧化亚铁稳定,试从原子结构角度解释原因:
(3)铁作为过渡金属,能形成多种配位化合物。赤血盐{K3[Fe(CN)6]}为红色晶体,其配离子中提供空轨道的为

您最近一年使用:0次
解题方法
7 . 回答下列问题。
(1)写出铬原子价电子排布式:___________ ;与铬同一周期的元素原子中最外层电子数与铬原子的相同的元素有___________ (填元素符号)。
(2)第三周期第一电离能处于Al和P之间的元素有___________ 种。
(3)NO 互为等电子体的分子或离子为
互为等电子体的分子或离子为___________ 。
(4)1 mol CH2=CH-CH2OH含___________ molσ键,该分子中碳原子的杂化类型为___________ 。
(1)写出铬原子价电子排布式:
(2)第三周期第一电离能处于Al和P之间的元素有
(3)NO
 互为等电子体的分子或离子为
互为等电子体的分子或离子为(4)1 mol CH2=CH-CH2OH含
您最近一年使用:0次
8 . 下列关于杂化轨道的叙述不正确的是
| A.杂化轨道可用于形成σ键,也可用于形成π键 |
| B.杂化轨道可用来容纳未参与成键的孤电子对 |
| C.NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H原子的1个s轨道杂化而成的 |
| D.AB2型共价化合物的中心原子A采取的杂化方式可能不同 |
您最近一年使用:0次
9 . 下列物质的性质可用氢键来解释的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.F2、Cl2、Br2、I2的熔、沸点依次升高 |
| C.CH3COOH、H—O—H、C2H5—OH中—OH上氢原子的活泼性依次减弱 |
| D.C2H5OH的沸点比CH3—O—CH3的沸点高 |
您最近一年使用:0次
10 . 原子的第四能层填充有2个电子的元素种数为
| A.9种 | B.10种 | C.11种 | D.1种 |
您最近一年使用:0次



