1 . 下列物质的分类合理的是
A.酸性氧化物: 、 、 、 、 、 、 |
| B.混合物:碱石灰、氨水、水煤气、氢氧化铁胶体 |
| C.碱:熟石灰、纯碱、苛性钠、氢氧化钡 |
D.碱性氧化物: 、 、 、 、 、 、 |
您最近一年使用:0次
名校
2 . 化学与科技、生活、社会发展密切相关,下列有关说法不正确的是
| A.新冠病毒在空气中形成的气溶胶能产生丁达尔效应 |
| B.江河入海口沙洲的形成与胶体的聚沉有关 |
| C.“熬胆矾铁釜,久之亦化为铜”该过程发生了氧化还原反应 |
| D.北京冬奥会的颁奖礼服中含有的石墨烯(从石墨中分离出)是一种有机物 |
您最近一年使用:0次
名校
3 . 以银锰精矿(主分 、MnS、
、MnS、 )和氧化锰矿(主分
)和氧化锰矿(主分 )为原料联合提取银和锰的某流程如图。
)为原料联合提取银和锰的某流程如图。

已知:酸性条件下, 的氧化性强于
的氧化性强于 。
。
(1)“浸锰”过程利用 溶液浸出矿石中的锰元素,同时去除
溶液浸出矿石中的锰元素,同时去除 ,使银元素以
,使银元素以 的形式残留于浸锰渣中,以利于后续银的浸出。
的形式残留于浸锰渣中,以利于后续银的浸出。
①浸锰液中主要的金属阳离子有___________ 。
② 能浸出矿石中的锰元素,发生反应
能浸出矿石中的锰元素,发生反应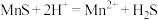 的平衡常数K值为
的平衡常数K值为_______ , 不能溶解于
不能溶解于 残留于浸锰渣中,可推断:
残留于浸锰渣中,可推断: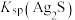
______ (填“>”或“>”) 。
。
常温下, 和MnS相应的平衡常数如表。
和MnS相应的平衡常数如表。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整______ ,
②结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用: :
:_______ , :
:________ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有___________ 、___________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。

解释t分钟后Ag的沉淀率逐渐减小的原因:___________ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势有:
①可将两种矿石中的锰元素同时提取到浸锰液中,得到 ,同时将银元素和锰元素分离开。
,同时将银元素和锰元素分离开。
②___________ 。
 、MnS、
、MnS、 )和氧化锰矿(主分
)和氧化锰矿(主分 )为原料联合提取银和锰的某流程如图。
)为原料联合提取银和锰的某流程如图。
已知:酸性条件下,
 的氧化性强于
的氧化性强于 。
。(1)“浸锰”过程利用
 溶液浸出矿石中的锰元素,同时去除
溶液浸出矿石中的锰元素,同时去除 ,使银元素以
,使银元素以 的形式残留于浸锰渣中,以利于后续银的浸出。
的形式残留于浸锰渣中,以利于后续银的浸出。①浸锰液中主要的金属阳离子有
②
 能浸出矿石中的锰元素,发生反应
能浸出矿石中的锰元素,发生反应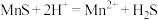 的平衡常数K值为
的平衡常数K值为 不能溶解于
不能溶解于 残留于浸锰渣中,可推断:
残留于浸锰渣中,可推断: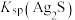
 。
。常温下,
 和MnS相应的平衡常数如表。
和MnS相应的平衡常数如表。 | MnS |
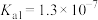 ; ; | 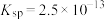 |
(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整

②结合平衡移动原理,解释浸出剂中
 、
、 的作用:
的作用: :
: :
:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。

解释t分钟后Ag的沉淀率逐渐减小的原因:
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势有:
①可将两种矿石中的锰元素同时提取到浸锰液中,得到
 ,同时将银元素和锰元素分离开。
,同时将银元素和锰元素分离开。②
您最近一年使用:0次
2024-01-18更新
|
152次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高二上学期12月月考化学试卷
名校
解题方法
4 . 二甲醚是一种重要的清洁燃料,工业上可以通过 、合成气(主要成分是一氧化碳和氢气)制得。
、合成气(主要成分是一氧化碳和氢气)制得。
I. 分子间脱水制二甲醚
分子间脱水制二甲醚

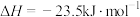 。在
。在 ℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
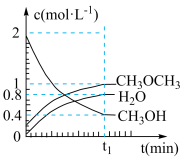
(1) 时刻反应达平衡后,其他条件不变,升高温度,平衡
时刻反应达平衡后,其他条件不变,升高温度,平衡___________ (填“向右”、“向左”或“不发生”)移动, 将
将___________ (填“增大”或“减小”)
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为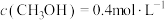 、
、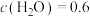
 、
、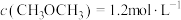 ,此时
,此时
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅱ.合成气制取二甲醚的原理如下:
反应1:
反应2:
(3)500K时,在2L密闭容器中充入4
 和8
和8
 ,4min达到平衡,平衡时
,4min达到平衡,平衡时 的转化率为80%,且
的转化率为80%,且 ,则反应2中
,则反应2中 的转化率
的转化率
___________ ,反应1的平衡常数
___________ (结果需化成最简比)。
 、合成气(主要成分是一氧化碳和氢气)制得。
、合成气(主要成分是一氧化碳和氢气)制得。I.
 分子间脱水制二甲醚
分子间脱水制二甲醚
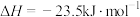 。在
。在 ℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
(1)
 时刻反应达平衡后,其他条件不变,升高温度,平衡
时刻反应达平衡后,其他条件不变,升高温度,平衡 将
将(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为
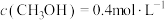 、
、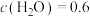
 、
、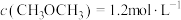 ,此时
,此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。Ⅱ.合成气制取二甲醚的原理如下:
反应1:

反应2:

(3)500K时,在2L密闭容器中充入4

 和8
和8
 ,4min达到平衡,平衡时
,4min达到平衡,平衡时 的转化率为80%,且
的转化率为80%,且 ,则反应2中
,则反应2中 的转化率
的转化率

您最近一年使用:0次
名校
解题方法
5 . 回答下列问题。
(1)向一容积为2L的恒容密闭容器中通入2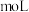
 和6
和6
 ,一定温度下发生反应
,一定温度下发生反应 。起始总压为p
。起始总压为p ,20min时达到化学平衡状态,测得
,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时总压为___________  。
。
②0~20min内,用 表示的平均反应速率
表示的平均反应速率
___________ , 的平衡浓度
的平衡浓度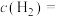
___________ 。该温度下,反应的平衡常数
___________ 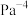 (用含p的式子表达,用平衡分压代替平衡浓度计算,分压-总压×物质的量分数)。
(用含p的式子表达,用平衡分压代替平衡浓度计算,分压-总压×物质的量分数)。
(2)工业上,以一定比例混合的 与
与 的混合气体以一定流速分别通过填充有催化剂I、催化剂Ⅱ的反应器,发生反应
的混合气体以一定流速分别通过填充有催化剂I、催化剂Ⅱ的反应器,发生反应 。
。 转化率与温度的关系如图所示。在催化剂Ⅱ作用下,温度高于
转化率与温度的关系如图所示。在催化剂Ⅱ作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是___________ 。

(3)在某压强下,反应Ⅲ
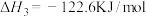

在不同温度、不同投料比时, 的平衡转化率如图所示。反应温度
的平衡转化率如图所示。反应温度
________  (选填“>”“<”或“=”);温度为
(选填“>”“<”或“=”);温度为 时,将6
时,将6
 和12
和12
 充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率
充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率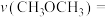
_________ ; 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为___________ 。
(1)向一容积为2L的恒容密闭容器中通入2
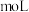
 和6
和6
 ,一定温度下发生反应
,一定温度下发生反应 。起始总压为p
。起始总压为p ,20min时达到化学平衡状态,测得
,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时总压为
 。
。②0~20min内,用
 表示的平均反应速率
表示的平均反应速率
 的平衡浓度
的平衡浓度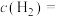

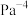 (用含p的式子表达,用平衡分压代替平衡浓度计算,分压-总压×物质的量分数)。
(用含p的式子表达,用平衡分压代替平衡浓度计算,分压-总压×物质的量分数)。(2)工业上,以一定比例混合的
 与
与 的混合气体以一定流速分别通过填充有催化剂I、催化剂Ⅱ的反应器,发生反应
的混合气体以一定流速分别通过填充有催化剂I、催化剂Ⅱ的反应器,发生反应 。
。 转化率与温度的关系如图所示。在催化剂Ⅱ作用下,温度高于
转化率与温度的关系如图所示。在催化剂Ⅱ作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是
(3)在某压强下,反应Ⅲ

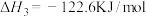

在不同温度、不同投料比时,
 的平衡转化率如图所示。反应温度
的平衡转化率如图所示。反应温度
 (选填“>”“<”或“=”);温度为
(选填“>”“<”或“=”);温度为 时,将6
时,将6
 和12
和12
 充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率
充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率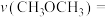
 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为
您最近一年使用:0次
名校
解题方法
6 . 周期表中ⅥA族元素及其化合物应用广泛。O3具有杀菌、消毒、漂白等作用;H2S是一种易燃的有毒气体(燃烧热为562.2 kJ/mol),常用于沉淀重金属离子;氯化亚砜(SOCl2)是重要的有机试剂;硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,Se是人体不可或缺的微量元素,工业上通过电解强碱性Na2TeO3溶液制备Te。下列方程式书写正确的是
A.SOCl2遇水强烈水解:SOCl2+H2O=2H++ +2Cl- +2Cl- |
| B.H2S与硫酸铜溶液反应:Cu2++H2S=CuS↓+2H+ |
| C.H2S的燃烧:H2S(g)+2O2(g)=SO3(g)+H2O(l) △H= -562.2kJ/mol |
D.工业制Te阴极反应: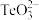 +6H++4e-=Te+3H2O +6H++4e-=Te+3H2O |
您最近一年使用:0次
2024-01-18更新
|
307次组卷
|
3卷引用:福建省泉州市永春一中、培元中学、石光中学、季延中学2023-2024学年高三下学期第二次联合考试化学试题
名校
解题方法
7 . 实验室中利用如图装置(部分装置省略)制备 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
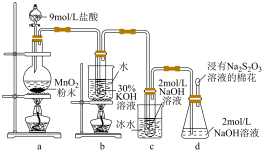
(1)盛放9mol/L盐酸的仪器名称是_______ 。
(2)b中发生化学反应的离子方程式是_______ 。
(3)d中浸有 溶液的棉花的作用是
溶液的棉花的作用是_______ 。
(4)下列相关说法不正确的是_______(填标号)。
(5)当b中试管内溶液由黄色变为无色时,反应到达终点。实际操作时,发现溶液由黄色变为紫红色甚至产生棕色沉淀影响产品纯度。针对该现象,可能混入的物质是_______ 。
(6)取少量 和NaClO溶液分别置于1号和2号试管中,滴加
和NaClO溶液分别置于1号和2号试管中,滴加 溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下
溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下 的氧化能力小于NaClO
的氧化能力小于NaClO_______ 。(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、 溶液)
溶液)
(7) 中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
_______  (填“>”或“<”)。
(填“>”或“<”)。
 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
(1)盛放9mol/L盐酸的仪器名称是
(2)b中发生化学反应的离子方程式是
(3)d中浸有
 溶液的棉花的作用是
溶液的棉花的作用是(4)下列相关说法不正确的是_______(填标号)。
| A.使用选择9mol/L盐酸替换浓盐酸,有利于减少HCl挥发 |
| B.控制液体滴加速率以维持氯气气流稳定,有利于减少反应过程倒吸的可能 |
C.反应结束后,b中液体经冷却结晶、过滤、冷水洗涤、干燥,可得 晶体 晶体 |
| D.增大装置c中NaOH溶液的浓度,有利于提高NaClO产率 |
(5)当b中试管内溶液由黄色变为无色时,反应到达终点。实际操作时,发现溶液由黄色变为紫红色甚至产生棕色沉淀影响产品纯度。针对该现象,可能混入的物质是
(6)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加
和NaClO溶液分别置于1号和2号试管中,滴加 溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下
溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下 的氧化能力小于NaClO
的氧化能力小于NaClO 溶液)
溶液)(7)
 中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
8 . 在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
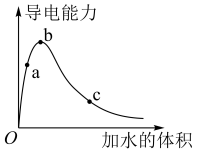
(1)a、b、c三点醋酸电离程度由大到小的顺序为___________ ;a、b、c三点对应的溶液中 最大的是
最大的是___________ 。
(2)常温下, 溶液的
溶液的
①该溶液中由水电离出的 浓度是
浓度是___________  。
。
②计算 的电离平衡常数
的电离平衡常数
___________ 。
(3)常温下在c点对应的溶液中加水稀释过程中,下列表达式的数值一定变小的是___________。
(4)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
①根据电离常数判断下列反应不可能发生的是___________
A.
B.
C.
D.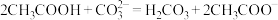
②25℃时,pH相等的三种溶液① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液,浓度由大到小的顺序为
溶液,浓度由大到小的顺序为___________ (填序号)。
③25℃时,向 溶液中通入少量
溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。

(1)a、b、c三点醋酸电离程度由大到小的顺序为
 最大的是
最大的是(2)常温下,
 溶液的
溶液的
①该溶液中由水电离出的
 浓度是
浓度是 。
。②计算
 的电离平衡常数
的电离平衡常数
(3)常温下在c点对应的溶液中加水稀释过程中,下列表达式的数值一定变小的是___________。
A. | B. | C.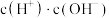 | D. |
(4)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 |  |  |  |
| 电离平衡常数 |  | 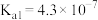  | 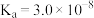 |
A.

B.

C.

D.
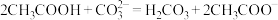
②25℃时,pH相等的三种溶液①
 溶液、②
溶液、② 溶液、③
溶液、③ 溶液,浓度由大到小的顺序为
溶液,浓度由大到小的顺序为③25℃时,向
 溶液中通入少量
溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
10-11高二下·山东济宁·期中
名校
9 . 构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序,若以E表示某能级的能量,下列能量大小顺序正确的是
A.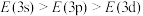 | B. |
C. | D.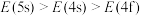 |
您最近一年使用:0次
2024-01-17更新
|
303次组卷
|
32卷引用:2012-2013福建省仙游二中高二下学期第一次月考化学试卷
(已下线)2012-2013福建省仙游二中高二下学期第一次月考化学试卷(已下线)2010-2011学年福建省漳州市芗城中学高二下学期期末考试化学试卷(已下线)2011-2012学年福建省漳州市芗城中学高二下学期期末考试化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2016-2017学年四川省三台中学校高二上月考化学试卷吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】天津市静海区第一中学2018-2019学年高二下学期5月月考化学试题辽宁省丹东市凤城市第一中学2019-2020学年高二上学期12月月考化学试题宁夏贺兰县景博中学2021-2022学年高二下学期第一次月考化学试题四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题四川省宜宾市叙州区第一中学校2022-2023学年高二上学期第一学月考试化学试题福建省诏安县桥东中学2021-2022学年高二下学期期末考试化学试题陕西省咸阳市实验中学2022-2023学年高二上学期第一次月考化学试题陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期3月第一次月考化学试题陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期3月第一次月考化学试题(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012学年四川省巴中市四县中高二上期期末联考化学试卷(已下线)2011-2012学年黑龙江省鹤岗一中高二下学期期中考试化学试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷2015-2016学年山西省康杰中学高二下期中化学试卷【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期中考试化学试题2020届高三化学选修三二轮专题复习——能级、能层、原子轨道宁夏银川市长庆高级中学2019-2020学年高二下学期期中考试化学试题海南省三亚华侨学校2019-2020学年高二上学期期末考试化学试题四川省阿坝州九寨沟2019-2020学年高二上学期期末考试化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第2节 原子结构与元素周期表高二选择性必修2(人教版2019)第一章 原子结构与性质 第一节 原子结构 课时2 构造原理与电子排布式 电子云与原子轨道四川省荥经中学2020-2021学年高二上学期期中考试化学试题广东省茂名市电白区2021-2022学年高二上学期期末考试(选择性)化学试题第一节 原子结构 第2课时 构造原理与电子排布式,电子云与原子轨道(已下线)1.1.2 构造原理与电子排布式 电子云与原子轨道(基础)1.1.2 构造原理与电子排布式 电子云与原子轨道-随堂练习
名校
10 . 下列措施或事实能用勒夏特列原理解释的是
| A.含有酚酞的氨水中加入少量氯化铵,溶液颜色变浅 |
| B.在合成氨(正反应放热)的反应中,升温有利于氨的合成 |
| C.钢铁在潮湿的空气中更容易生锈 |
D. 、 、 、 、 三者的平衡混合气加压后颜色变深 三者的平衡混合气加压后颜色变深 |
您最近一年使用:0次



