名校
解题方法
1 . 已知下列反应的平衡常数: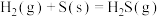 ,
, ;
; ,
, ;则反应
;则反应 的平衡常数是
的平衡常数是
 ,
, ;
; ,
, ;则反应
;则反应 的平衡常数是
的平衡常数是A. | B. | C. | D. |
您最近一年使用:0次
2024-03-05更新
|
172次组卷
|
65卷引用:福建省福州第十五中学2022-2023学年高二上学期11月线上限时训练化学试题
福建省福州第十五中学2022-2023学年高二上学期11月线上限时训练化学试题福建省泰宁第一中学2019-2020学年高二上学期第一阶段考试化学(选考)试题广西柳州市第三中学2022-2023学年高二上学期10月月考化学试题陕西省宝鸡市千阳县中学2022-2023学年高二上学期第一次月考(理)化学试题福建省建瓯市芝华中学2022-2023学年高二上学期期中考试化学试题2016届湖南省衡阳县第四中学高三9月月考试化学试卷2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2016-2017学年四川省成都外国语学校高二上10月月考化学试卷陕西省渭南市尚德中学2017-2018学年高二第一次教学质量检测化学试题湖南省娄底市第四中学2018-2019学年高二上学期10月月考化学试题甘肃省甘谷第一中学2019-2020学年高二上学期第一次月考化学试题山东省日照市第一中学2019-2020学年高二10月月考化学试题安徽省亳州市涡阳县第九中学2019-2020学年高一7月月考化学试题安徽省舒城中学2020-2021学年高二上学期第二次月考化学试题河北省鸡泽县第一中学2020-2021学年高二上学期第一次月考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题黑龙江省伊春市伊美区第二中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市一〇三中学2020-2021学年高二10月月考化学试题(已下线)【浙江新东方】绍兴qw122天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题黑龙江省绥化市望奎县第一中学2021-2022学年高二上学期第一次月考化学试题重庆市清华中学校2021—2022学年上学期高二10月月考化学试题福建省福州黎明中学2021-2022学年高二上学期期中考试化学试题(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)广东省揭阳华侨高级中学2021-2022学年高二上学期第一次阶段考试化学试题(已下线)2.2.1 化学平衡状态 化学平衡常数 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)福建省建瓯市芝华中学2021-2022学年高二上学期期中考试化学试题河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期9月月考化学试题2015-2016学年重庆市第一中学高二上期中测试化学试卷2015-2016学年吉林省松原市油田高中高一下期末化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期末考试化学试题甘肃省兰州第一中学2017-2018学年高二上学期期中考试化学(理)试题江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题四川省遂宁市2018-2019学年高二下学期期末考试化学试题(已下线)2019年9月16日《每日一题》选修4—— 化学平衡常数吉林省吉化第一高级中学校2019-2020学年高二9月月考化学试题新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题广东省梅州市水寨中学2019-2020学年高二上学期期中考试化学试题湖南省长沙市长郡中学2019-2020学年高二上学期期中考试化学试题安徽省黄山市“八校联盟”2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2019-2020学年高二下学期开学考试化学试题(已下线)【南昌新东方】江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题广东省广州大学附属中学2019-2020学年高一下学期期末考试化学试题广东省广州大学附属中学等三校2019~2020学年高一下学期期末联考化学试题(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.3化学平衡常数(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时1 化学平衡常数 平衡转化率人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时2 化学平衡常数及相关计算选择性必修1(SJ)专题2第二单元课时3 化学平衡常数平衡转化率(已下线)第20讲 化学平衡常数及转化率的计算(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向23 化学平衡常数及其应用-备战2022年高考化学一轮复习考点微专题湖南省武冈市第二中学2021-2022学年高二上学期开学摸底考试化学试题江苏省盐城市实验高级中学(新洋高级中学)2020-2021学年高二下学期期中考试化学试题(已下线)2.2.3 化学平衡常数(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题2.2.3化学平衡常数 课中第二章 化学反应速率与化学平衡 第二节 化学平衡 第2课时 化学平衡常数(已下线)第3讲 化学平衡计算 平衡常数甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题黑龙江省佳木斯市四校联考2023-2024学年高二上学期11月期中化学考试试题广东省台山市某校2023-2024学年高二上学期期中考试化学试题甘肃省武威市民勤县第一中学2023-2024学高二下学期开学考试化学试题湖南省衡阳县第四中学2023-2024学年高二上学期11月期中化学试题
名校
2 . 氢能是发展中的新能源,它的利用包括氢的制备和储存。回答下列问题:
(1)如图为碱性氢氧燃料电池的示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①在导线中电子流动方向为_____ (用a、b表示)。
②正极反应式为_____ 。
(2)氢氧燃料电池工作时,H2和O2连续由外部供给,因此储氢是关键技术之一、某些金属氢化物可做储氢材料,在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s)达到化学平衡。下列有关叙述正确的是
MHx+2y(s)达到化学平衡。下列有关叙述正确的是_____ 。
a.v(放氢)=v(吸氢)
b.若通入惰性气体Ar,压强增大,反应速率增大
c.容器内气体压强保持不变
d.吸收ymolH2只需1molMHx
(3)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_____ 。
(4)化工生产的副产品氢气,也是氢气的一种来源。电解法制取Na2FeO4的同时还能获得氢气:Fe+2H2O+2OH- FeO
FeO +3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO
+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
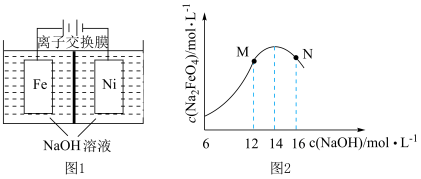
①电解一段时间后,c(OH−)降低的区域在_____ (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_____ 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:_____ 。
(1)如图为碱性氢氧燃料电池的示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①在导线中电子流动方向为
②正极反应式为
(2)氢氧燃料电池工作时,H2和O2连续由外部供给,因此储氢是关键技术之一、某些金属氢化物可做储氢材料,在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)
 MHx+2y(s)达到化学平衡。下列有关叙述正确的是
MHx+2y(s)达到化学平衡。下列有关叙述正确的是a.v(放氢)=v(吸氢)
b.若通入惰性气体Ar,压强增大,反应速率增大
c.容器内气体压强保持不变
d.吸收ymolH2只需1molMHx
(3)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为
(4)化工生产的副产品氢气,也是氢气的一种来源。电解法制取Na2FeO4的同时还能获得氢气:Fe+2H2O+2OH-
 FeO
FeO +3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO
+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH−)降低的区域在
②电解过程中,须将阴极产生的气体及时排出,其原因是
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:
您最近一年使用:0次
3 . 我国将力争2030年前实现碳达峰、2060年前实现碳中和,是党中央经过深思熟虑做出的重要决策,事关中华民族永续发展和构建人类命运共同体。研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
I.利用二氧化碳催化加氢制甲醇。回答下列问题:
某温度下,二氧化碳与氢气反应制甲醇的总反应为 ,
,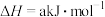 。
。
(1)已知 、
、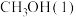 的燃烧热分别为
的燃烧热分别为 、
、 ,且
,且
 ,则
,则
_____ 。
在体积为4.0L的密闭容器中充入0.8molCO2和2.0molH2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,测得CO2、CH3OH的物质的量随时间变化如图:
CH3OH(g)+H2O(g) ΔH<0,测得CO2、CH3OH的物质的量随时间变化如图:
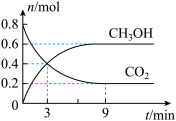
(2) 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为_____ 。
(3)该反应的平衡常数表达式K=_____ ;若在上述平衡体系中再充入0.4molCO2和1.2molH2O(g)(保持温度不变),则此平衡将_____ 移动(填“向正反应方向”、“不”、“向逆反应方向”)。
(4)下列措施能使 增大的是_____。
增大的是_____。
Ⅱ.利用CO2、NH3为原料生产尿素[CO(NH2)2],反应原理为:2NH3(g)+CO2(g) H2O(l)+CO(NH2)2(s) ΔH=-178kJ∙mol-1.T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。
H2O(l)+CO(NH2)2(s) ΔH=-178kJ∙mol-1.T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。
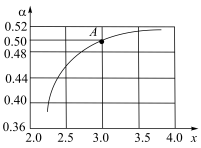
(5)图中A点NH3的平衡转化率α=_____ %。
(6)当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_____ (kPa)-3(Kp为以分压表示的平衡常数,分压=总压×体积分数)。
I.利用二氧化碳催化加氢制甲醇。回答下列问题:
某温度下,二氧化碳与氢气反应制甲醇的总反应为
 ,
,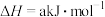 。
。(1)已知
 、
、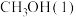 的燃烧热分别为
的燃烧热分别为 、
、 ,且
,且
 ,则
,则
在体积为4.0L的密闭容器中充入0.8molCO2和2.0molH2,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0,测得CO2、CH3OH的物质的量随时间变化如图:
CH3OH(g)+H2O(g) ΔH<0,测得CO2、CH3OH的物质的量随时间变化如图:
(2)
 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为(3)该反应的平衡常数表达式K=
(4)下列措施能使
 增大的是_____。
增大的是_____。A.将 从体系中分离 从体系中分离 |
| B.充入He,使体系压强增大 |
| C.降低温度、增大压强 |
D.再充入 |
Ⅱ.利用CO2、NH3为原料生产尿素[CO(NH2)2],反应原理为:2NH3(g)+CO2(g)
 H2O(l)+CO(NH2)2(s) ΔH=-178kJ∙mol-1.T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。
H2O(l)+CO(NH2)2(s) ΔH=-178kJ∙mol-1.T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。
(5)图中A点NH3的平衡转化率α=
(6)当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=
您最近一年使用:0次
名校
解题方法
4 . 化学电源在日常生活和高科技领域中都有广泛应用。下列说法正确的是


| A.甲:溶液中Cu2+经盐桥流向锌电极 |
| B.乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH- |
| C.丙:二氧化锰作正极,发生还原反应 |
| D.丁:使用一段时间后,电解质溶液的酸性增强 |
您最近一年使用:0次
名校
5 . NA代表阿伏加德罗常数,下列说法正确的是
| A.标况下22.4LCl2与足量Fe反应生成FeCl3,转移电子数为3NA |
B.0.1mol/LK2CO3溶液中 数目小于0.1NA 数目小于0.1NA |
C.N2(g)+3H2(g)  2NH3(g) △H=-93kJ/mol,若该条件下反应放热31kJ,则转移电子数为2NA 2NH3(g) △H=-93kJ/mol,若该条件下反应放热31kJ,则转移电子数为2NA |
| D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA |
您最近一年使用:0次
名校
6 . 将浓度均为0.02mol•L-1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学再室温下对该“碘钟实验”的原理进行探究。
资料:该“碘钟实验”的总反应为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O
+2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O =2I-+S4O
=2I-+S4O 。
。
(1)反应A的离子方程式是_____ ;对于总反应,I-的作用相当于_____ 。
(2)为证明反应A、B的存在,进行实验I.
实验I:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是_____
(3)为探究硫酸浓度对溶液变蓝快慢的影响,进行实验Ⅱ、实验Ⅲ.
(各溶液浓度均为0.02mol•L-1)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是15min,实验Ⅲ是20min。
①实验Ⅲ中,x、y、z所对应的数值分别是_____ 。
②对比试验Ⅱ、实验Ⅲ,可得出的实验结论是_____ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ.(各溶液浓度均为0.02mol•L-1)
实验过程中,溶液始终未出现变蓝的现象。试结合该“碘钟实验”总反应方程式,推测反应A与反应B速率的相对快慢关系:_____ 。
资料:该“碘钟实验”的总反应为H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O
+2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O =2I-+S4O
=2I-+S4O 。
。(1)反应A的离子方程式是
(2)为证明反应A、B的存在,进行实验I.
实验I:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是
(3)为探究硫酸浓度对溶液变蓝快慢的影响,进行实验Ⅱ、实验Ⅲ.
(各溶液浓度均为0.02mol•L-1)
| 用量/mL | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | 试剂X溶液 | H2O |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 | x | y | z |
①实验Ⅲ中,x、y、z所对应的数值分别是
②对比试验Ⅱ、实验Ⅲ,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ.(各溶液浓度均为0.02mol•L-1)
| 用量/mL | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | 试剂X溶液 | H2O |
| 实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
您最近一年使用:0次
名校
7 . 某合成氨速率方程为: (k为速率常数),部分数据如下表。下列说法正确的是
(k为速率常数),部分数据如下表。下列说法正确的是
 (k为速率常数),部分数据如下表。下列说法正确的是
(k为速率常数),部分数据如下表。下列说法正确的是| 实验 |  | 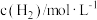 | 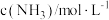 |  |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
| A.α=1,γ=-1 |
| B.采用适当催化剂,反应活化能、焓变均减小 |
| C.恒容容器中反应时,充He气,压强增大反应速率加快 |
| D.k与物质性质有关,与反应温度、压强、反应物浓度无关 |
您最近一年使用:0次
名校
8 . 下列事实能用勒夏特列(平衡移动)原理解释的是
A.反应Fe3++3SCN- Fe(SCN)3,平衡后加入铁粉溶液颜色变浅 Fe(SCN)3,平衡后加入铁粉溶液颜色变浅 |
B.硫酸工业中的重要反应2SO2+O2 2SO3,工业上常加入V2O5做催化剂 2SO3,工业上常加入V2O5做催化剂 |
C.密闭容器中发生反应H2(g)+I2(g) 2HI(g),平衡后增大压强气体颜色变深 2HI(g),平衡后增大压强气体颜色变深 |
D.合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,工业上采用高温条件更有利于合成氨 2NH3(g) ΔH=-92.4kJ/mol,工业上采用高温条件更有利于合成氨 |
您最近一年使用:0次
名校
解题方法
9 . 常温下,下列各组离子在给定环境中能大量共存的是
A.食盐水: 、Fe2+、NO 、Fe2+、NO 、Br- 、Br- |
B.白醋:Ca2+、Na+、Br-、HCO |
| C.84消毒液:Ba2+、K+、I-、Cl- |
D.明矾溶液:K+、Ba2+、NO 、 、 |
您最近一年使用:0次
名校
解题方法
10 . 化学与社会、生活、生产密切相关,下列有关说法错误的是
| A.洗涤油污常用热的Na2CO3溶液,这是利用了盐类水解的原理 |
| B.航天员所穿航天服的主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| C.“闽鹭”是我国制造的第四艘LNG船,船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| D.高纯硅是制备光导纤维的原料 |
您最近一年使用:0次



