名校
解题方法
1 . 一种制备 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数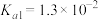 ,
,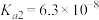 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数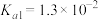 ,
,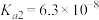 。下列说法正确的是
。下列说法正确的是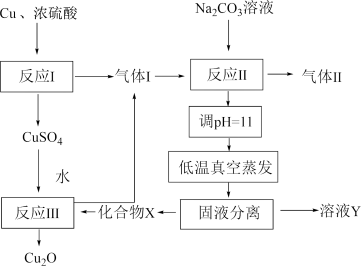
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比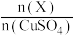 增大时,需补加 增大时,需补加 的量增多 的量增多 |
您最近一年使用:0次
2024-06-10更新
|
100次组卷
|
4卷引用:福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题
解题方法
2 . 回答下列问题
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是___________ 。
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐( )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
体积比为___________ 。___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式___________ 。
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐(
 )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
体积比为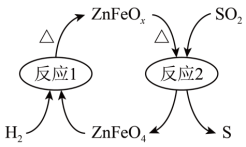
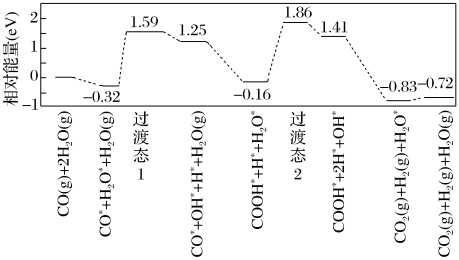
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1)下列反应是氧化还原反应且是吸热反应的是___________ 。
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2•8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为___________ 。金属的两种常见电化学防护方法如下图所示,图甲中铁闸门连接电源的___________ (填“正极”或“负极”),图乙所示金属的防护方法称为___________ 。
(1)下列反应是氧化还原反应且是吸热反应的是
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2•8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为
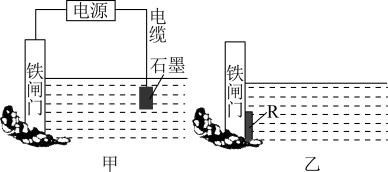
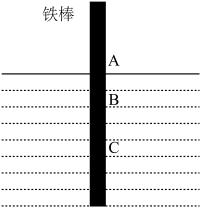
| A.铁棒AB段发生的反应为O2+2H2O+4e-=4OH- |
| B.腐蚀过程中在铁棒上会产生微电流,且方向是从BC段到AB段 |
| C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 |
| D.产生这种现象的本质是铁棒所处的化学环境不同 |
您最近一年使用:0次
解题方法
4 . 如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:___________ 。
(2)写出乙池石墨电极的名称为___________ (填“正极”“负极”或“阴极”“阳极”)。写出乙池中电解总反应的化学方程式:___________ 。
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生___________ g沉淀,此时乙池中溶液的体积为400 mL,该溶液的pH=___________ 。
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将___________ (填“增大”“减小”或“不变”,下同),丙中溶液的pH将___________ 。
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的___________ 极,电解质溶液最好用___________ 。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___________ 作电极。阳极反应的电极方程式为___________ 。
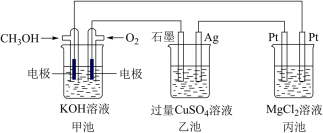
(2)写出乙池石墨电极的名称为
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的

您最近一年使用:0次
解题方法
5 . 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
请回答:
(1)实验计时方法是从溶液混合开始记时,至___________ 时记时结束。
(2)V1=___________ ,V2=___________ ;设计实验Ⅰ、Ⅲ的目的是探究___________ 对反应速率的影响。
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=___________ 。
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①___________ 不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ 。
| 实验编号 | 0.01mol•L﹣1 酸性KMnO4溶液 | 0.1mol•L﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
| Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
| Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始记时,至
(2)V1=
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是
您最近一年使用:0次
解题方法
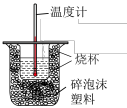
6 . 50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。实验数据如下表。
(1)①从实验装置看,图中还缺少的一种玻璃仪器是___________ 。在实验过程中,该仪器搅拌的正确操作方法是:___________ 。
②近似认为0.55 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1.则中和热ΔH=___________ (取小数点后一位)。中和热测定时采用稍过量的氢氧化钠的原因:___________ 。
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是___________ (填字母)。
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较
会___________ (填“偏大”“偏小”或“无影响”)。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:___________ 。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
则N2(g)+3H2(g)═2NH3(g) △H=___________ kJ•mol-1(用小写字母表示)。
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=___________ kJ•mol-1。
起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | |||
HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)①从实验装置看,图中还缺少的一种玻璃仪器是
②近似认为0.55 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1.则中和热ΔH=
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较
会
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
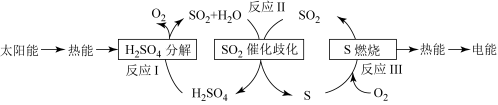
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | a | b | c |
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=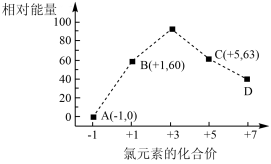
您最近一年使用:0次
名校
解题方法
7 . 镁菱锌矿(主要成分为ZnCO3、MgCO3等,含有少量FeCO3、CaCO3等杂质)可用于生产媒染剂、防腐剂ZnSO4•7H2O以及耐火材料MgO。制备工艺流程如图:
回答下列有关问题:
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是_______ 。
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为_______ 。
(3)“沉锌”时,加入氨水调节pH的范围是_______ 。
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、_______ 制得的ZnSO4•7H2O在烘干时需减压烘干的原因是_______ 。
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:_______ 。
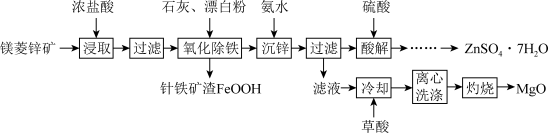
| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Mg2+ | Ca2+ |
| 开始沉淀 | 2.7 | 7.6 | 6.2 | 9.4 | 13 |
| 完全沉淀 | 3.7 | 9.6 | 8.2 | 12.4 | _______ |
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为
(3)“沉锌”时,加入氨水调节pH的范围是
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:
您最近一年使用:0次
名校
解题方法
8 . 利用油脂厂废弃镍(Ni)催化剂(主要含有Ni,还含少量Al、Fe、NiO、Al2O3、Fe2O3)制备NiSO4·6H2O的工艺流程如下:
(1)为了加快“碱浸”的速率可以采取的措施是_______ (任写两条)。
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式____ 。
(3)“滤液2” 中含金属阳离子有_______ 。
(4)①“氧化”中反应的离子反应方程式是_______ 。
②“氧化”中可以代替H2O2的最佳物质是_______ (填标号)。
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的_______ 。
a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法_______ 。
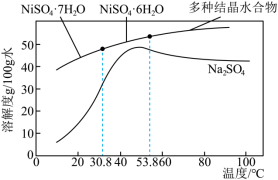
③结晶:将滤液蒸发、降温至稍高于_______ ℃结晶,过滤即获得产品,硫酸镍晶体溶解度曲线图如图所示。
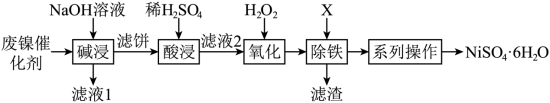
(1)为了加快“碱浸”的速率可以采取的措施是
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式
(3)“滤液2” 中含金属阳离子有
(4)①“氧化”中反应的离子反应方程式是
②“氧化”中可以代替H2O2的最佳物质是
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O
 Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法
③结晶:将滤液蒸发、降温至稍高于
您最近一年使用:0次
名校
9 . 对下列现象或事实的解释正确的是
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 工人将模具干燥后再注入熔融钢水 | 铁与 高温下会反应 高温下会反应 |
| D | SO2通入Na2S溶液,溶液变浑浊 | SO2具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 二氧化钼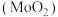 是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为
是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
(1)已知:①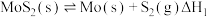
②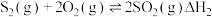
③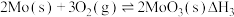
则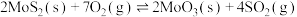 的
的
_______ (用含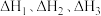 的代数式表示)。
的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应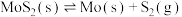 。
。
①下列说法正确的是_______ (填序号)。
A.气体的密度不变,则反应一定达到了平衡状态
B.气体的相对分子质量不变,反应不一定处于平衡状态
C.增加 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时 的浓度为
的浓度为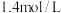 ,充入一定量的
,充入一定量的 ,反应再次达到平衡,
,反应再次达到平衡, 浓度
浓度_______ (填“ ”“
”“ ”或“
”或“ ”)
”)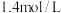 。
。
(3)在 恒容密闭容器中充入
恒容密闭容器中充入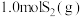 和
和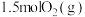 ,若仅发生反应:
,若仅发生反应: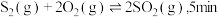 后反应达到平衡,此时容器压强为起始时的
后反应达到平衡,此时容器压强为起始时的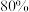 ,则
,则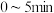 内,
内, 的反应速率为
的反应速率为_______  。
。
(4)在恒容密闭容器中,加入足量的 和
和 ,仅发生反应:
,仅发生反应: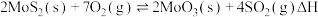 。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
。测得氧气的平衡转化率与起始压强、温度的关系如图所示。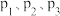 的大小:
的大小:_______ 。
②若在 为
为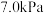 下,初始通入
下,初始通入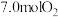 ,则
,则 点平衡常数
点平衡常数
_______ 。(用气体平衡分压代替气体平衡浓度计算,分压 总压
总压 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
(5) 可采用“电解法”制备,装置如图所示,写出电解时阴极的电极反应式:
可采用“电解法”制备,装置如图所示,写出电解时阴极的电极反应式:_______ 。
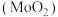 是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为
是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:(1)已知:①
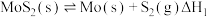
②
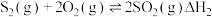
③
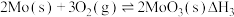
则
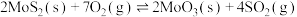 的
的
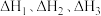 的代数式表示)。
的代数式表示)。(2)若在恒温恒容条件下,仅发生反应
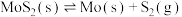 。
。①下列说法正确的是
A.气体的密度不变,则反应一定达到了平衡状态
B.气体的相对分子质量不变,反应不一定处于平衡状态
C.增加
 的量,平衡正向移动
的量,平衡正向移动②达到平衡时
 的浓度为
的浓度为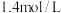 ,充入一定量的
,充入一定量的 ,反应再次达到平衡,
,反应再次达到平衡, 浓度
浓度 ”“
”“ ”或“
”或“ ”)
”)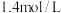 。
。(3)在
 恒容密闭容器中充入
恒容密闭容器中充入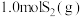 和
和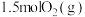 ,若仅发生反应:
,若仅发生反应: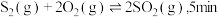 后反应达到平衡,此时容器压强为起始时的
后反应达到平衡,此时容器压强为起始时的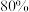 ,则
,则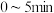 内,
内, 的反应速率为
的反应速率为 。
。(4)在恒容密闭容器中,加入足量的
 和
和 ,仅发生反应:
,仅发生反应: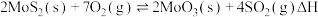 。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
。测得氧气的平衡转化率与起始压强、温度的关系如图所示。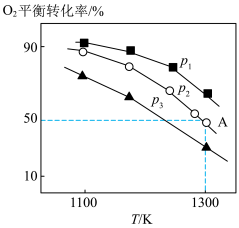
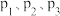 的大小:
的大小:②若在
 为
为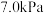 下,初始通入
下,初始通入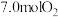 ,则
,则 点平衡常数
点平衡常数
 总压
总压 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。(5)
 可采用“电解法”制备,装置如图所示,写出电解时阴极的电极反应式:
可采用“电解法”制备,装置如图所示,写出电解时阴极的电极反应式: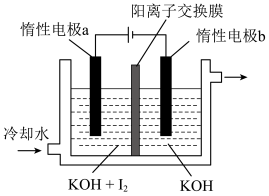
您最近一年使用:0次



