湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为________ 。
(2)“酸浸”中滤渣主要成分为________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:_________ 。
(5)“ 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为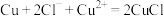 ,该反应的平衡常数
,该反应的平衡常数
________ 。[已知: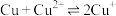
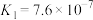 ;
; ]
]
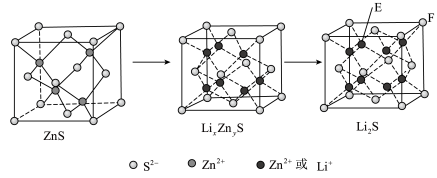
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
________ ,
________ ;充电过程中ZnS到 的电极反应式为
的电极反应式为________ (x和y用具体数字表示)。
②若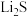 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为________ nm。
 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为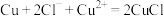 ,该反应的平衡常数
,该反应的平衡常数
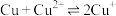
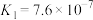 ;
; ]
](7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。


 的电极反应式为
的电极反应式为②若
 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
更新时间:2024-05-28 20:16:48
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】铬元素是一种重金属元素,工业上处理含铬废水并将其资源化的工艺有多种,其中两种工艺如图所示:
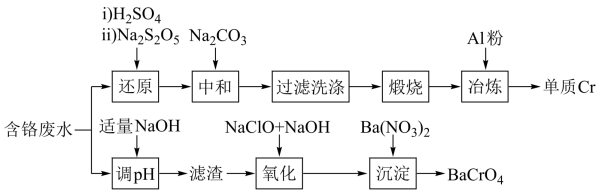
已知含铬废水中铬元素主要存在微粒为Cr3+、CrO 、Cr2O
、Cr2O 。“中和”过程中,产生Cr(OH)3。回答下列问题:
。“中和”过程中,产生Cr(OH)3。回答下列问题:
(1)“还原”时,先加入H2SO4酸化的目的是___________ ,用硫酸而不用盐酸,原因是___________ ,再加入Na2S2O5固体,其发生反应的离子方程式为___________ 。
(2)“中和”时加入Na2CO3的作用是___________ ,“过滤洗涤”时,洗涤沉淀的操作为___________ 。
(3)写出“氧化”时,发生反应的化学方程式___________ 。
(4)已知Ksp(BaCrO4) = 2.4×10-10,利用氧化法除铬时,欲使废液中铬元素的含量不高于0.26 mg·L-1,则此滤液中c(Ba2+)的范围为___________ 。

已知含铬废水中铬元素主要存在微粒为Cr3+、CrO
 、Cr2O
、Cr2O 。“中和”过程中,产生Cr(OH)3。回答下列问题:
。“中和”过程中,产生Cr(OH)3。回答下列问题:(1)“还原”时,先加入H2SO4酸化的目的是
(2)“中和”时加入Na2CO3的作用是
(3)写出“氧化”时,发生反应的化学方程式
(4)已知Ksp(BaCrO4) = 2.4×10-10,利用氧化法除铬时,欲使废液中铬元素的含量不高于0.26 mg·L-1,则此滤液中c(Ba2+)的范围为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】重铬酸钠(Na2Cr2O7)是工业上和实验室常用的强氧化剂,以铬矿石(主要成分Cr2O3,含FeO、MgO、SiO2等杂质)为主要原料制取重铬酸钠晶体Na2Cr2O7·H2O的流程如下:
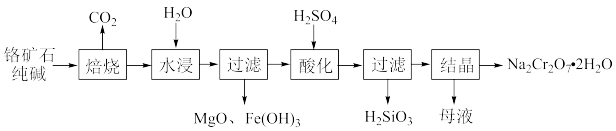
(1)将铬矿石、纯碱混合后在空气中焙烧,有Na2CrO4、NaFeO2和Na2SiO3生成。写出焙烧时生成Na2CrO4的化学反应方程式:_______ 。
(2)写出水浸时NaFeO2所发生反应的化学反应方程式:_______ 。
(3)向过滤后所得MgO、Fe(OH)3沉淀中分批次加入一定量的H2SO4,可以依次溶解MgO和Fe(OH)3。如果要控制溶液中c(Mg2+)>1 mol·L-1、c(Fe3+)<1×10-5 mol·L-1,则需控制溶液的pH的范围是_______ 。{已知Ksp[Mg(OH)2]=1×10-10.8、Ksp[Fe(OH)3]=1×10-37.4}
(4)酸化时Na2CrO4转化为Na2Cr2O7,写出转化时Na2CrO4发生反应的离子方程式:_______ 。
(5)为测定所得Na2Cr2O7·2H2O样品的纯度,现进行如下实验:准确称取样品0.5000g,溶于水配成100mL溶液,取出25.00mL于锥形瓶中,加入足量的硫酸和NaI溶液 的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2
的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2 =2I-+
=2I-+ )。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
)。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程_______ (杂质不参与反应)。

(1)将铬矿石、纯碱混合后在空气中焙烧,有Na2CrO4、NaFeO2和Na2SiO3生成。写出焙烧时生成Na2CrO4的化学反应方程式:
(2)写出水浸时NaFeO2所发生反应的化学反应方程式:
(3)向过滤后所得MgO、Fe(OH)3沉淀中分批次加入一定量的H2SO4,可以依次溶解MgO和Fe(OH)3。如果要控制溶液中c(Mg2+)>1 mol·L-1、c(Fe3+)<1×10-5 mol·L-1,则需控制溶液的pH的范围是
(4)酸化时Na2CrO4转化为Na2Cr2O7,写出转化时Na2CrO4发生反应的离子方程式:
(5)为测定所得Na2Cr2O7·2H2O样品的纯度,现进行如下实验:准确称取样品0.5000g,溶于水配成100mL溶液,取出25.00mL于锥形瓶中,加入足量的硫酸和NaI溶液
 的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2
的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2 =2I-+
=2I-+ )。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
)。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】以红土镍矿(主要成分是 ,含
,含 (等)为原料制备硝酸镍的流程如图所示:
(等)为原料制备硝酸镍的流程如图所示:

注: 为
为 和
和 的混合气体。回答下列问题:
的混合气体。回答下列问题:
(1)基态镍原子价电子排布式为_______ 。
(2)“除铁铝”阶段需要先用 溶液将
溶液将 氧化为
氧化为 。
。 属于
属于_______ (“极性”或“非极性”)分子。
(3)“除镁钙”阶段为加入 除尽
除尽 ,除
,除 后的滤液中
后的滤液中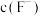 至少应为
至少应为_______  [当溶液中某离子浓度小于
[当溶液中某离子浓度小于 时,可认为该离子沉淀完全。已知该实验条件下
时,可认为该离子沉淀完全。已知该实验条件下 ,
, ]。
]。
(4)“净化液电解”阶段,析镍过程中存在竞争反应,该竞争反应的电极反应式为_______ 。
(5)工业制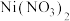 成品时,先用硝酸将
成品时,先用硝酸将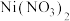 溶液酸化至
溶液酸化至 ,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是
,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是_______ (任答两点)。
(6)工业上用 溶液吸收
溶液吸收 制备硝酸钠,其流程如图所示:
制备硝酸钠,其流程如图所示:
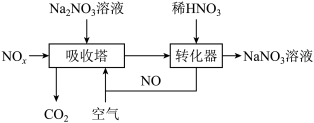
①吸收塔得到 、
、 混合溶液。键角:
混合溶液。键角:
_______  (填“>”、“=”或“<”),
(填“>”、“=”或“<”), 、N、O三种元素中电负性最大的是
、N、O三种元素中电负性最大的是_______ (填元素符号)。
②写出转化器中发生反应的化学方程式:_______ 。
 ,含
,含 (等)为原料制备硝酸镍的流程如图所示:
(等)为原料制备硝酸镍的流程如图所示:
注:
 为
为 和
和 的混合气体。回答下列问题:
的混合气体。回答下列问题:(1)基态镍原子价电子排布式为
(2)“除铁铝”阶段需要先用
 溶液将
溶液将 氧化为
氧化为 。
。 属于
属于(3)“除镁钙”阶段为加入
 除尽
除尽 ,除
,除 后的滤液中
后的滤液中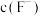 至少应为
至少应为 [当溶液中某离子浓度小于
[当溶液中某离子浓度小于 时,可认为该离子沉淀完全。已知该实验条件下
时,可认为该离子沉淀完全。已知该实验条件下 ,
, ]。
]。(4)“净化液电解”阶段,析镍过程中存在竞争反应,该竞争反应的电极反应式为
(5)工业制
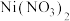 成品时,先用硝酸将
成品时,先用硝酸将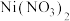 溶液酸化至
溶液酸化至 ,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是
,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是(6)工业上用
 溶液吸收
溶液吸收 制备硝酸钠,其流程如图所示:
制备硝酸钠,其流程如图所示:
①吸收塔得到
 、
、 混合溶液。键角:
混合溶液。键角:
 (填“>”、“=”或“<”),
(填“>”、“=”或“<”), 、N、O三种元素中电负性最大的是
、N、O三种元素中电负性最大的是②写出转化器中发生反应的化学方程式:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)镓的基态原子电子排布式是_____________________ 。
(2)已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是_____________________ 。
(3)多酚氧化酶与植物的抗病性有关。配合物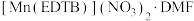 是多酚氧化酶的模型配合物。
是多酚氧化酶的模型配合物。
 (EDTA)+
(EDTA)+ (邻苯二氨)
(邻苯二氨)
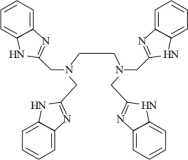 (EDTB)
(EDTB)
①EDTA中N的杂化轨道类型为______________ 。
②邻苯二胺分子中 键的数目为
键的数目为______________ 。
③EDTB分子中所含元素的电负性由小到大的顺序为______________ 。
④配离子 中的配位原子是
中的配位原子是______________ 。
(4)向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色透明溶液,向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解、后析出的原因是(用离子方程式和简单的文字说明加以解释):___________________________________ 。
(5)氮化铝在电子工业上有广泛应用,其晶胞如图1所示。N原子所在空隙的类型是_______ (填“正四面体”“正八面体”或“立方体”)空隙,该空隙的填充率为______________ 。

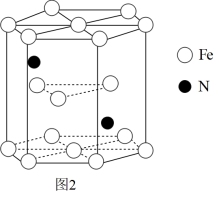
(6)铁和氮组成一种过渡金属氮化物,其结构如图2所示。直六棱柱的底边边长为xcm,高为ycm,阿伏加德罗常数的值为NA,则晶体的密度算式为_______  。
。
(1)镓的基态原子电子排布式是
(2)已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是
(3)多酚氧化酶与植物的抗病性有关。配合物
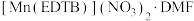 是多酚氧化酶的模型配合物。
是多酚氧化酶的模型配合物。 (EDTA)+
(EDTA)+ (邻苯二氨)
(邻苯二氨)
 (EDTB)
(EDTB)①EDTA中N的杂化轨道类型为
②邻苯二胺分子中
 键的数目为
键的数目为③EDTB分子中所含元素的电负性由小到大的顺序为
④配离子
 中的配位原子是
中的配位原子是(4)向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色透明溶液,向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解、后析出的原因是(用离子方程式和简单的文字说明加以解释):
(5)氮化铝在电子工业上有广泛应用,其晶胞如图1所示。N原子所在空隙的类型是

(6)铁和氮组成一种过渡金属氮化物,其结构如图2所示。直六棱柱的底边边长为xcm,高为ycm,阿伏加德罗常数的值为NA,则晶体的密度算式为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】碳及钾元素形成的单质及其化合物有重要的应用。回答下列问题:
(1)放射性同位素 常用于测定古生物体的年龄,它可由中子轰击A原子制得:
常用于测定古生物体的年龄,它可由中子轰击A原子制得: 。则基态A原子的价电子排布式为
。则基态A原子的价电子排布式为_____ ;第四周期副族元素基态原子中,与A含有相同未成对电子数相同的元素有_____ (填元素符号)。
(2)碳元素可与氮等其他元素形成许多胺类物质,其中烟碱和多巴胺的结构如下:

烟碱中N原子的杂化方式为_____ ;多巴胺的沸点比烟碱高,其原因为_____ 。
(3) 可用于超微量Cu(Ⅱ)的测定。
可用于超微量Cu(Ⅱ)的测定。 中阴离子空间构型是
中阴离子空间构型是_____ ,与其互为等电子体的一种分子为_____ 。
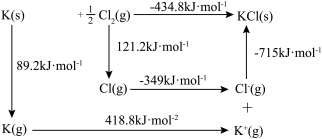
(4)KCl可用作氮肥的生产,其晶体的晶格能可通过下图热化学循环计算得到。则K原子的第一电离能为_____  ,Cl—Cl键键能为
,Cl—Cl键键能为_____  。
。
(5)石墨层间插入碱金属K可形成一系列夹层化合物,其导电性和磁性发生很大的变化。某种夹层化合物的结构如下图所示,每隔两层插入一层钾原子,与钾层相邻的上下两层碳原子的排列方式相同。
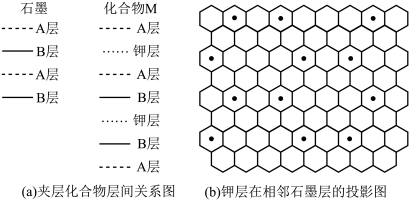
图(b)中正六边形的顶点代表碳原子,黑点代表钾原子。
①距离钾原子最近的碳原子的个数为_____ ;该夹层化合物的化学式为_____ 。
②若钾层相邻两个K之间的最近距离为dpm,则石墨层中C—C键键长为_____ pm。
(1)放射性同位素
 常用于测定古生物体的年龄,它可由中子轰击A原子制得:
常用于测定古生物体的年龄,它可由中子轰击A原子制得: 。则基态A原子的价电子排布式为
。则基态A原子的价电子排布式为(2)碳元素可与氮等其他元素形成许多胺类物质,其中烟碱和多巴胺的结构如下:

烟碱中N原子的杂化方式为
(3)
 可用于超微量Cu(Ⅱ)的测定。
可用于超微量Cu(Ⅱ)的测定。 中阴离子空间构型是
中阴离子空间构型是(4)KCl可用作氮肥的生产,其晶体的晶格能可通过下图热化学循环计算得到。则K原子的第一电离能为
 ,Cl—Cl键键能为
,Cl—Cl键键能为 。
。
(5)石墨层间插入碱金属K可形成一系列夹层化合物,其导电性和磁性发生很大的变化。某种夹层化合物的结构如下图所示,每隔两层插入一层钾原子,与钾层相邻的上下两层碳原子的排列方式相同。

图(b)中正六边形的顶点代表碳原子,黑点代表钾原子。
①距离钾原子最近的碳原子的个数为
②若钾层相邻两个K之间的最近距离为dpm,则石墨层中C—C键键长为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】氟(F)、氯(Cl)属于卤素,它们在自然界都以典型的盐类存在,是典型成盐元素。
(1)基态氟原子的轨道表示式为_______ ,其处于最高能级的电子云轮廓图为_______ 。
(2)三氟化氮( )和三氯化氮(
)和三氯化氮( )是两种强氧化剂。
)是两种强氧化剂。
① 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为_______ ,分子的空间构型为_______ 。
② 的键角小于
的键角小于 的原因为
的原因为_______ 。
(3) 是一种重要的化工原料,
是一种重要的化工原料, 的VSEPR模型为
的VSEPR模型为_______ 。
(4)氟化钙和氯化钙均为离子晶体,其中氟化钙的立方晶胞图如图所示。已知氟化钙晶胞参数为a pm, 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。

①每个氟化钙晶胞中含有 的数目为
的数目为_______ 个;离子晶体中离子的配位数是指一个离子周围最近的异电性离子的数目,则 的配位数为
的配位数为_______ 。
②以“ ”表示
”表示 ,“
,“ ”表示
”表示 ,画出氟化钙晶胞沿z轴方向投影图
,画出氟化钙晶胞沿z轴方向投影图_______ 。
③氟化钙的密度为_______  (列出计算式)。
(列出计算式)。
(1)基态氟原子的轨道表示式为
(2)三氟化氮(
 )和三氯化氮(
)和三氯化氮( )是两种强氧化剂。
)是两种强氧化剂。①
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为②
 的键角小于
的键角小于 的原因为
的原因为(3)
 是一种重要的化工原料,
是一种重要的化工原料, 的VSEPR模型为
的VSEPR模型为(4)氟化钙和氯化钙均为离子晶体,其中氟化钙的立方晶胞图如图所示。已知氟化钙晶胞参数为a pm,
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。
①每个氟化钙晶胞中含有
 的数目为
的数目为 的配位数为
的配位数为②以“
 ”表示
”表示 ,“
,“ ”表示
”表示 ,画出氟化钙晶胞沿z轴方向投影图
,画出氟化钙晶胞沿z轴方向投影图③氟化钙的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态Cu原子的电子所占据的最高能层符号为____ ;基态Cu+较基态Cu2+稳定的原因是____ ;Cu2O和Cu2S都是离子晶体,熔点较高的是____ 。
(2)CuSO4稀溶液中存在[Cu(H2O)6]2+,[Cu(H2O)6]2+的空间构型为____ ;下列对[Cu(H2O)6]2+中Cu2+杂化方式推断合理的是____ (填标号)。
A.sp3 B.sp3d C.sp3d2 D.dsp2
(3)Cu2+可形成[Cu(en)2NH3](BF4)2,其中en代表H2N—CH2—CH2—NH2。该化合物分子中,VSEPR模型为四面体的非金属原子共有____ 个;C、N、F的电负性由大到小的顺序为____ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为____ ;该晶体的化学式为____ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为(0,0,0)、( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为____ ;晶胞中C、D间距离d=____ pm。
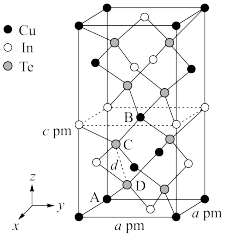
(1)基态Cu原子的电子所占据的最高能层符号为
(2)CuSO4稀溶液中存在[Cu(H2O)6]2+,[Cu(H2O)6]2+的空间构型为
A.sp3 B.sp3d C.sp3d2 D.dsp2
(3)Cu2+可形成[Cu(en)2NH3](BF4)2,其中en代表H2N—CH2—CH2—NH2。该化合物分子中,VSEPR模型为四面体的非金属原子共有
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为___________ ;实验室用KSCN溶液、苯酚(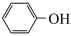 )检验Fe3+,N、O、S的第一电离能由大到小的顺序为
)检验Fe3+,N、O、S的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(2)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1mol Fe(CO)5分子中含σ键数目为___________ ,与CO互为等电子体的离子是___________ (填化学式,写一种)
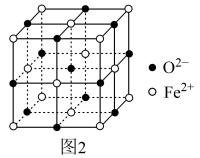
(3)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为___________ 。

(4)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为___________ ;Fe2+与O2-的最短间距为___________ pm。
(1)基态Fe3+的电子排布式为
 )检验Fe3+,N、O、S的第一电离能由大到小的顺序为
)检验Fe3+,N、O、S的第一电离能由大到小的顺序为(2)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1mol Fe(CO)5分子中含σ键数目为
(3)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为

(4)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】电池在人类生产生活中具有十分重要的作用,其中锂离子电池与太阳能电池占有很大比重。太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)基态亚铜离子中电子占据的原子轨道数目为___________ 。
(2)若基态硒原子价层电子排布式写成4s24p 4p
4p ,则其违背了
,则其违背了___________ 。
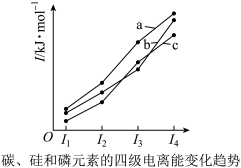
(3)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是___________ (填标号)。
(4)元素X与硅同主族且原子半径最小,X形成的最简单氢化物分子Q,该分子其中心原子的杂化类型为___________ 写出一种与Q互为等电子体的阳离子___________
(5)GaAs的熔点为1238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为___________ ,GaAs的熔点___________ (填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________

(1)基态亚铜离子中电子占据的原子轨道数目为
(2)若基态硒原子价层电子排布式写成4s24p
 4p
4p ,则其违背了
,则其违背了(3)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是

(4)元素X与硅同主族且原子半径最小,X形成的最简单氢化物分子Q,该分子其中心原子的杂化类型为
(5)GaAs的熔点为1238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为

您最近一年使用:0次



