名校
1 . 六种36号以前的元素的性质或结构信息见表,试根据信息回答有关问题。
(1)A是_______ (填元素名称),在元素周期表中的位置_______ 。
(2)B的基态原子的核外电子占据的最高能级的轨道形状和该能级所能容纳的最多电子数分别为_______ 、_______ 。
(3)写出C元素基态原子的价层电子轨道表示式_______ ,其基态原子的电子有_______ 种空间运动状态。
(4)D、E的元素符号分别为_______ 。
| 元素 | 性质或结构信息 |
| A | 基态原子有5个原子轨道填充有电子,有3个未成对电子 |
| B | 基态原子有16个不同运动状态的电子 |
| C | 基态原子的价电子排布为3d104sx,在化合物中只有一种常见化合价 |
| D、E | 两种元素的基态原子都只有一个未成对电子,它们相互形成的离子的电子层结构相同,并且最高能级的电子对数等于其最高能层的电子层数 |
(2)B的基态原子的核外电子占据的最高能级的轨道形状和该能级所能容纳的最多电子数分别为
(3)写出C元素基态原子的价层电子轨道表示式
(4)D、E的元素符号分别为
您最近一年使用:0次
名校
2 . Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)基态Cu2+核外电子排布式为____ 。
(2) 的空间构型为
的空间构型为_____ (用文字描述);Cu2+与OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为______ (填元素符号)。CuSO4和NaOH反应得到的氢氧化铜还能与氨水反应,写出氢氧化铜与氨水的化学反应方程式_________ 。
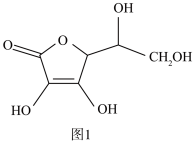
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________ ;推测抗坏血酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。抗坏血酸中是否存在手性碳原子?_______ (填“是”或“否”)______ 。若晶胞的边长为a pm,则Cu2O的密度表达式为____ g·cm-3。(NA代表阿伏加德罗常数的值)
(1)基态Cu2+核外电子排布式为
(2)
 的空间构型为
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
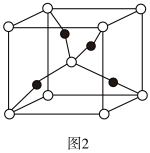
您最近一年使用:0次
名校
解题方法
3 . 华铁粉的主要成分为醋酸亚铁,可清热解毒,凉血消肿。以粗氯化铁(含少量 )为原料制备华铁粉的流程如下:
)为原料制备华铁粉的流程如下:
 )为原料制备华铁粉的流程如下:
)为原料制备华铁粉的流程如下: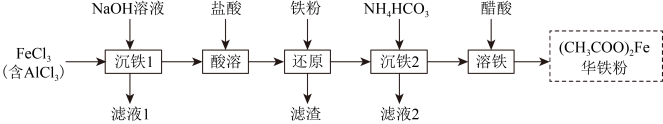
A.“沉铁1”中可用氨水替代 溶液 溶液 |
B.“还原”时加入铁粉的目的是将 转化成 转化成 |
C.滤液2的主要成分是 |
D.“溶铁”的离子方程式为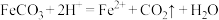 |
您最近一年使用:0次
4 . 三氯甲硅烷(SiHCl3)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8℃,熔点为-126.5℃,易水解。实验室根据反应Si+3HCl SiHCl3+H2,利用如下装置制备SiHCl3粗品(加热及夹持装置略)。回答下列问题:
SiHCl3+H2,利用如下装置制备SiHCl3粗品(加热及夹持装置略)。回答下列问题: ,一段时间后接通冷凝装置,加热开始反应。操作(ii)为
,一段时间后接通冷凝装置,加热开始反应。操作(ii)为___________ ;判断制备反应结束的实验现象是___________ 。为防止SiHCl3发生水解,应___________ 。(实验装置改造方法)
(2)采用如下方法测定溶有少量 的SiHCl3纯度。
的SiHCl3纯度。
m1g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:
①___________ ,②___________ (填操作名称),③称量等操作,测得所得固体氧化物质量为m2g,从下列仪器中选出①中需使用的仪器为___________ (填标号)。测得样品纯度为___________ (用含m1、m2的代数式表示)。
 SiHCl3+H2,利用如下装置制备SiHCl3粗品(加热及夹持装置略)。回答下列问题:
SiHCl3+H2,利用如下装置制备SiHCl3粗品(加热及夹持装置略)。回答下列问题: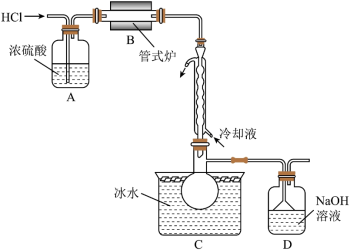
 ,一段时间后接通冷凝装置,加热开始反应。操作(ii)为
,一段时间后接通冷凝装置,加热开始反应。操作(ii)为(2)采用如下方法测定溶有少量
 的SiHCl3纯度。
的SiHCl3纯度。m1g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:
①
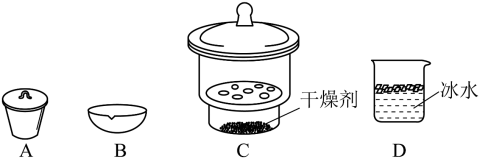
您最近一年使用:0次
5 . 实现碳中和已经成为全球的广泛共识,化学科学在此过程中发挥着至关重要的作用。
Ⅰ. 加氢可制备甲酸(
加氢可制备甲酸( )。
)。
温度为 时,将等物质的量的
时,将等物质的量的 和
和 充入体积为
充入体积为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应:
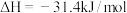 、
、 。
。
(1)实验测得;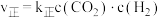 ,
, ,
,
为速率常数。保持其他条件不变,温度为 时
时 ,则
,则
____  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是____ 。
Ⅱ. 加氢还可制备甲醇(
加氢还可制备甲醇( )。
)。
(2)在恒温,体积为 恒容密闭容器中,充入
恒容密闭容器中,充入 和
和 ,进行反应
,进行反应
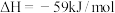 。
。 时测得
时测得 和
和 的体积分数之比为
的体积分数之比为 。回答下列问题:
。回答下列问题:
①反应开始到 ,氢气的平均反应速率
,氢气的平均反应速率
____ 。
②下列能说明该反应已达平衡状态的是____ 。
A.气体的平均摩尔质量不变 B.混合气体密度不变
C.体系中 与
与 的浓度比不变 D.容器内压强不变
的浓度比不变 D.容器内压强不变
(3)在容积可变的密闭容器中充入 和
和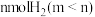 ,在恒温恒压条件下只发生反应
,在恒温恒压条件下只发生反应
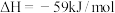 ,在下图中画出
,在下图中画出 的平衡转化率随温度(
的平衡转化率随温度(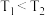 )、压强的变化图
)、压强的变化图________ 。
Ⅰ.
 加氢可制备甲酸(
加氢可制备甲酸( )。
)。温度为
 时,将等物质的量的
时,将等物质的量的 和
和 充入体积为
充入体积为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应: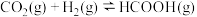
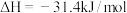 、
、 。
。(1)实验测得;
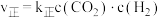 ,
, ,
,
为速率常数。保持其他条件不变,温度为
 时
时 ,则
,则
 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是Ⅱ.
 加氢还可制备甲醇(
加氢还可制备甲醇( )。
)。(2)在恒温,体积为
 恒容密闭容器中,充入
恒容密闭容器中,充入 和
和 ,进行反应
,进行反应
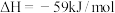 。
。 时测得
时测得 和
和 的体积分数之比为
的体积分数之比为 。回答下列问题:
。回答下列问题:①反应开始到
 ,氢气的平均反应速率
,氢气的平均反应速率
②下列能说明该反应已达平衡状态的是
A.气体的平均摩尔质量不变 B.混合气体密度不变
C.体系中
 与
与 的浓度比不变 D.容器内压强不变
的浓度比不变 D.容器内压强不变(3)在容积可变的密闭容器中充入
 和
和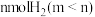 ,在恒温恒压条件下只发生反应
,在恒温恒压条件下只发生反应
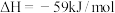 ,在下图中画出
,在下图中画出 的平衡转化率随温度(
的平衡转化率随温度(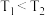 )、压强的变化图
)、压强的变化图
您最近一年使用:0次
2024-02-14更新
|
128次组卷
|
2卷引用:海南省海南中学2023- 2024学年高三上学期第4次月考化学试题
6 . 硫及其化合物在日常生活、工业生产中都非常普遍。
(1)变废为宝是治理污染的常用手段。以 为催化剂,将
为催化剂,将 氧化为
氧化为 ,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
(i)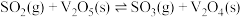
(ii)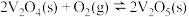
能量变化如图所示。
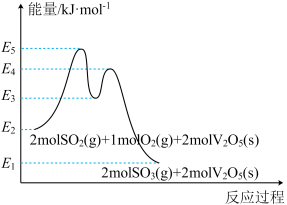
总反应 的
的
_____  (用
(用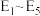 中的合理数据组成的代数式表示)。决定
中的合理数据组成的代数式表示)。决定 催化氧化总反应速率的是步骤
催化氧化总反应速率的是步骤____ (填i或ii),其活化能为______  (用
(用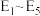 中的合理数据组成的代数式表示)。
中的合理数据组成的代数式表示)。
(2)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为: ,
, 。
。
① 时,
时, 溶液的
溶液的
_____ 7(填“>”“<”或“=”)。
② 的稀硫酸中,
的稀硫酸中,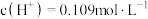 ,则硫酸第二步电离的电离常数
,则硫酸第二步电离的电离常数
_______ (只列式,不计算)。
(3)液态水中,水存在自偶电离: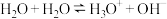 。平常书写的
。平常书写的 ,实际上是纯水或水溶液中
,实际上是纯水或水溶液中 的缩写。如
的缩写。如 在水中电离,完整写法是
在水中电离,完整写法是 。
。
①液态的醋酸(用 表示)中,同样存在
表示)中,同样存在 的自偶电离,其方程式可表示为
的自偶电离,其方程式可表示为____ 。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量 溶于冰醋酸中,第一步电离的完整写法是
溶于冰醋酸中,第一步电离的完整写法是____ 。若保持温度不变,关于该所得溶液,下列说法正确的是____ 。
A.加入少量冰醋酸,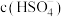 与
与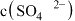 均减小
均减小
B.加入少量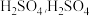 的电离程度增大
的电离程度增大
C.加入少量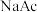 固体,
固体,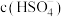 与
与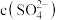 的比值减小
的比值减小
D.加入少量 固体,
固体,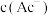 减小
减小
(1)变废为宝是治理污染的常用手段。以
 为催化剂,将
为催化剂,将 氧化为
氧化为 ,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:(i)
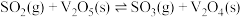
(ii)
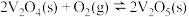
能量变化如图所示。

总反应
 的
的
 (用
(用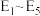 中的合理数据组成的代数式表示)。决定
中的合理数据组成的代数式表示)。决定 催化氧化总反应速率的是步骤
催化氧化总反应速率的是步骤 (用
(用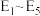 中的合理数据组成的代数式表示)。
中的合理数据组成的代数式表示)。(2)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:
 ,
, 。
。①
 时,
时, 溶液的
溶液的
②
 的稀硫酸中,
的稀硫酸中,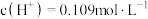 ,则硫酸第二步电离的电离常数
,则硫酸第二步电离的电离常数
(3)液态水中,水存在自偶电离:
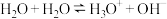 。平常书写的
。平常书写的 ,实际上是纯水或水溶液中
,实际上是纯水或水溶液中 的缩写。如
的缩写。如 在水中电离,完整写法是
在水中电离,完整写法是 。
。①液态的醋酸(用
 表示)中,同样存在
表示)中,同样存在 的自偶电离,其方程式可表示为
的自偶电离,其方程式可表示为②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量
 溶于冰醋酸中,第一步电离的完整写法是
溶于冰醋酸中,第一步电离的完整写法是A.加入少量冰醋酸,
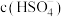 与
与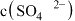 均减小
均减小B.加入少量
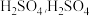 的电离程度增大
的电离程度增大C.加入少量
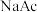 固体,
固体,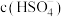 与
与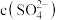 的比值减小
的比值减小D.加入少量
 固体,
固体,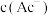 减小
减小
您最近一年使用:0次
2024-02-14更新
|
73次组卷
|
2卷引用:海南省海南中学2023- 2024学年高三上学期第4次月考化学试题
7 . 常温下, 和
和 在水中达到沉淀溶解平衡时
在水中达到沉淀溶解平衡时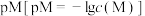 与pH的关系如图所示。下列叙述正确的是
与pH的关系如图所示。下列叙述正确的是

 和
和 在水中达到沉淀溶解平衡时
在水中达到沉淀溶解平衡时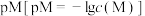 与pH的关系如图所示。下列叙述正确的是
与pH的关系如图所示。下列叙述正确的是
A.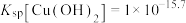 |
B.a、b点 的溶解度相同 的溶解度相同 |
| C.若“沉铁”时,pH从2.0提高到2.5,铁的损失率降低 |
D.只有浓度相同的 和 和 ,才可通过分步沉淀进行分离 ,才可通过分步沉淀进行分离 |
您最近一年使用:0次
解题方法
8 . 利用 微型原电池能除去酸性废液中的甲酸,反应原理如图所示。下列叙述正确的是
微型原电池能除去酸性废液中的甲酸,反应原理如图所示。下列叙述正确的是
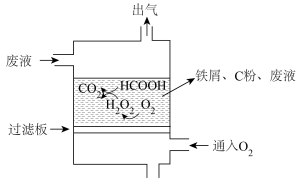
 微型原电池能除去酸性废液中的甲酸,反应原理如图所示。下列叙述正确的是
微型原电池能除去酸性废液中的甲酸,反应原理如图所示。下列叙述正确的是
A.负极的电极反应式为 |
| B.若不通入氧气,“出气”口可能逸出氢气 |
C.若处理1molHCOOH,电路中理论上转移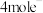 |
| D.该电池在高温下工作能增大HCOOH的清除效率 |
您最近一年使用:0次
名校
9 . X、Y、Z、W为前四周期原子序数依次增大的四种元素,X、Y、Z的原子半径和最外层电子数如右图所示。W的基态原子最外层只有1个电子且内层电子全部充满。下列说法正确的是


| A.第一电离能:X<Y |
| B.X、Y的简单氢化物的稳定性:X<Y |
| C.Z元素最高正化合价为+7价 |
| D.W的基态原子的电子排布式:1s22s22p63s23p64s1 |
您最近一年使用:0次
10 .  是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
(1)已知:①

②
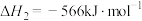
③
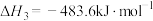
则 的
的
___________  。
。
(2)恒温恒容条件下,向密闭容器中充入1
 和2
和2
 合成
合成 ,下列叙述正确的是___________(填字母)。
,下列叙述正确的是___________(填字母)。
(3)一定温度下,保持总压强为2.0 ,向密闭容器中充入1
,向密闭容器中充入1
 和1.6
和1.6
 ,发生反应:
,发生反应: 、
、 。反应达到平衡时
。反应达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为80%(已知:甲酸的选择性
的选择性为80%(已知:甲酸的选择性 。该温度下,
。该温度下, 的平衡常数
的平衡常数
___________  。
。
(4)常温下,向 溶液中滴加
溶液中滴加 溶液。溶液的
溶液。溶液的 与
与 的关系如图所示。
的关系如图所示。
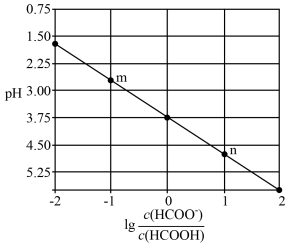
则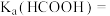
___________ ,n点溶液中离子浓度由大到小的排序为___________ 。
 是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:(1)已知:①


②

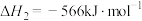
③

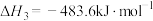
则
 的
的
 。
。(2)恒温恒容条件下,向密闭容器中充入1

 和2
和2
 合成
合成 ,下列叙述正确的是___________(填字母)。
,下列叙述正确的是___________(填字母)。| A.气体压强不随时间变化时达到平衡状态 |
B.平衡时 的最大体积分数为50% 的最大体积分数为50% |
C.平衡后及时移走 ,平衡常数增大 ,平衡常数增大 |
D.平衡后再充入 , , 的平衡转化率增大 的平衡转化率增大 |
(3)一定温度下,保持总压强为2.0
 ,向密闭容器中充入1
,向密闭容器中充入1
 和1.6
和1.6
 ,发生反应:
,发生反应: 、
、 。反应达到平衡时
。反应达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为80%(已知:甲酸的选择性
的选择性为80%(已知:甲酸的选择性 。该温度下,
。该温度下, 的平衡常数
的平衡常数
 。
。(4)常温下,向
 溶液中滴加
溶液中滴加 溶液。溶液的
溶液。溶液的 与
与 的关系如图所示。
的关系如图所示。
则
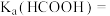
您最近一年使用:0次
2023-12-16更新
|
217次组卷
|
2卷引用:海南省琼中黎族苗族自治县琼中中学 屯昌县屯昌中学2023-2024学年高三上学期12月联考化学试题



