名校
1 . 利用 合成甲醇、二甲醚技术是有效利用
合成甲醇、二甲醚技术是有效利用 资源,实现“碳中和”目标的重要途径。
资源,实现“碳中和”目标的重要途径。
(1)开发 直接催化加氢合成二甲醚技术是很好的一个研究方向。
直接催化加氢合成二甲醚技术是很好的一个研究方向。
主反应: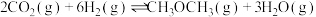

副反应:

①已知25℃和101kPa下,H2(g)、CO(g)的燃烧热 分别为-285.8kJ/mol、-283.0kJ/mol,
分别为-285.8kJ/mol、-283.0kJ/mol,
 ,则
,则
_______ kJ/mol。
②其他条件相同时,反应温度对 平衡转化率影响如图所示。温度低于280℃时,
平衡转化率影响如图所示。温度低于280℃时, 平衡转化率随温度的升高而减小的原因可能是
平衡转化率随温度的升高而减小的原因可能是_______ 。 ,反应平衡时测得
,反应平衡时测得 的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性
的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性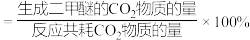 ),则副反应
),则副反应 的
的
_______ (保留两位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)利用 合成甲醇也是有效利用
合成甲醇也是有效利用 资源的重要途径。将原料气
资源的重要途径。将原料气 充入某一恒容密闭容器中,只发生
充入某一恒容密闭容器中,只发生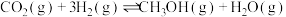
 ,在不同催化剂作用下,反应
,在不同催化剂作用下,反应 时
时 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。_______ 。
A.使用催化剂Ⅰ时,d点已达到平衡
B. 的平衡常数大于
的平衡常数大于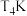 的平衡常数
的平衡常数
C.若a点时, ,则此条件下反应已达到最大限度
,则此条件下反应已达到最大限度
D.c点转化率比a点低的原因一定是催化剂活性降低
②若图中a点时反应已达平衡,现原料气按 充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出
充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出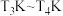 之间
之间 的平衡转化率变化曲线
的平衡转化率变化曲线______ 。
(3)水煤气变换反应的机理被广泛研究,其中有一种为羧基机理,某催化剂催化 (*表示吸附态、
(*表示吸附态、 表示活化能)步骤如下:
表示活化能)步骤如下:
Ⅰ.

Ⅱ._______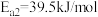
Ⅲ.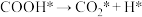

Ⅳ._______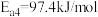
①请补充其中的一个反应式:Ⅱ_______ 。
②反应 的决速步骤是
的决速步骤是_______ (填序号)。
 合成甲醇、二甲醚技术是有效利用
合成甲醇、二甲醚技术是有效利用 资源,实现“碳中和”目标的重要途径。
资源,实现“碳中和”目标的重要途径。(1)开发
 直接催化加氢合成二甲醚技术是很好的一个研究方向。
直接催化加氢合成二甲醚技术是很好的一个研究方向。主反应:
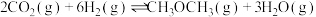

副反应:


①已知25℃和101kPa下,H2(g)、CO(g)的燃烧热
 分别为-285.8kJ/mol、-283.0kJ/mol,
分别为-285.8kJ/mol、-283.0kJ/mol,
 ,则
,则
②其他条件相同时,反应温度对
 平衡转化率影响如图所示。温度低于280℃时,
平衡转化率影响如图所示。温度低于280℃时, 平衡转化率随温度的升高而减小的原因可能是
平衡转化率随温度的升高而减小的原因可能是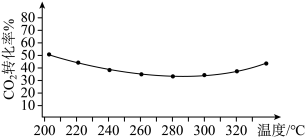
 ,反应平衡时测得
,反应平衡时测得 的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性
的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性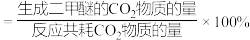 ),则副反应
),则副反应 的
的
(2)利用
 合成甲醇也是有效利用
合成甲醇也是有效利用 资源的重要途径。将原料气
资源的重要途径。将原料气 充入某一恒容密闭容器中,只发生
充入某一恒容密闭容器中,只发生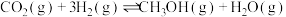
 ,在不同催化剂作用下,反应
,在不同催化剂作用下,反应 时
时 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。
A.使用催化剂Ⅰ时,d点已达到平衡
B.
 的平衡常数大于
的平衡常数大于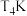 的平衡常数
的平衡常数C.若a点时,
 ,则此条件下反应已达到最大限度
,则此条件下反应已达到最大限度D.c点转化率比a点低的原因一定是催化剂活性降低
②若图中a点时反应已达平衡,现原料气按
 充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出
充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出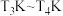 之间
之间 的平衡转化率变化曲线
的平衡转化率变化曲线(3)水煤气变换反应的机理被广泛研究,其中有一种为羧基机理,某催化剂催化
 (*表示吸附态、
(*表示吸附态、 表示活化能)步骤如下:
表示活化能)步骤如下:Ⅰ.


Ⅱ._______
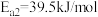
Ⅲ.
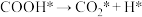

Ⅳ._______
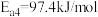
①请补充其中的一个反应式:Ⅱ
②反应
 的决速步骤是
的决速步骤是
您最近一年使用:0次
2 . 下列离子方程式正确的是
| A.金属钠投入硫酸镁溶液中:2Na+2H2O+Mg2+=2Na++H2↑+Mg(OH)2 |
B.硫酸铵稀溶液和稀氢氧化钡溶液反应: + + +Ba2++OH-=BaSO4↓+NH3·H2O +Ba2++OH-=BaSO4↓+NH3·H2O |
| C.往酸性FeCl2溶液中滴加适量的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
D.氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++ +OH-=H2O+CaCO3↓ +OH-=H2O+CaCO3↓ |
您最近一年使用:0次
3 .  和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下:
和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下:不正确 的是
 和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下:
和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下: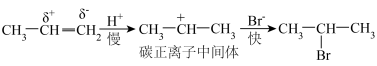
A.碳正离子中间体稳定性: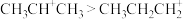 |
B.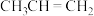 与氢卤酸反应时速率大小HI>HBr>HCl 与氢卤酸反应时速率大小HI>HBr>HCl |
C.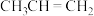 与甲硼烷( 与甲硼烷(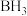 )加成最终能得到 )加成最终能得到 |
D.乙炔可通过如下流程合成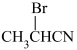 : : 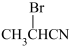 |
您最近一年使用:0次
名校
解题方法
4 . 氨是最重要的化学品之一,工农业中有很广泛的应用。工业合成氨为 和
和 反应生成
反应生成 :
:
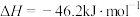 。
。
(1)提高合成氨平衡产率的条件有___________ 。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)在不同压强下,以两种不同组成进料,反应达平衡时氨的物质的量分数与温度的计算结果如下图所示。其中一种进料组成为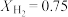 、
、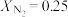 ,另一种为
,另一种为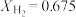 、
、 、
、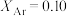 。
。___________ 。
A.图中压强由小到大的顺序为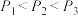
B.进料组成中含有惰性气体Ar的图是图1
C.工业上控制温度(773K)远高于室温,主要是为了使催化剂活性最大
D.合成氨反应在不同温度下的 和
和 都小于零
都小于零
②图2中,当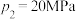 、
、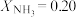 时,该温度下,
时,该温度下, 的平衡转化率
的平衡转化率
___________ 。
(3) 和
和 在催化剂作用下合成氨的初始阶段生成
在催化剂作用下合成氨的初始阶段生成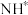 的机理可能有如下两种(
的机理可能有如下两种(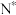 表示被吸附于催化剂表面的N):
表示被吸附于催化剂表面的N):
机理1: ;
;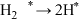 ;
;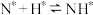
机理2: ;
;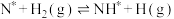
上述反应均为基元反应。保持温度和 的浓度不变,测得
的浓度不变,测得 和
和 在该催化剂作用下反应的初始速率与
在该催化剂作用下反应的初始速率与 浓度的关系如图所示。能合理解释图中曲线变化的机理为
浓度的关系如图所示。能合理解释图中曲线变化的机理为___________ (填“机理1”或“机理2”),判断的理由是___________ 。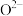 )燃料电池,具有全固态结构、能量效率高、环保等特点。写出该电池负极电极反应式
)燃料电池,具有全固态结构、能量效率高、环保等特点。写出该电池负极电极反应式___________ 。
 和
和 反应生成
反应生成 :
:
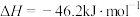 。
。(1)提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)在不同压强下,以两种不同组成进料,反应达平衡时氨的物质的量分数与温度的计算结果如下图所示。其中一种进料组成为
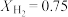 、
、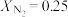 ,另一种为
,另一种为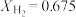 、
、 、
、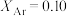 。
。
A.图中压强由小到大的顺序为
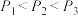
B.进料组成中含有惰性气体Ar的图是图1
C.工业上控制温度(773K)远高于室温,主要是为了使催化剂活性最大
D.合成氨反应在不同温度下的
 和
和 都小于零
都小于零②图2中,当
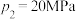 、
、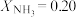 时,该温度下,
时,该温度下, 的平衡转化率
的平衡转化率
(3)
 和
和 在催化剂作用下合成氨的初始阶段生成
在催化剂作用下合成氨的初始阶段生成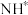 的机理可能有如下两种(
的机理可能有如下两种(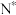 表示被吸附于催化剂表面的N):
表示被吸附于催化剂表面的N):机理1:
 ;
;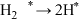 ;
;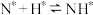
机理2:
 ;
;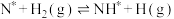
上述反应均为基元反应。保持温度和
 的浓度不变,测得
的浓度不变,测得 和
和 在该催化剂作用下反应的初始速率与
在该催化剂作用下反应的初始速率与 浓度的关系如图所示。能合理解释图中曲线变化的机理为
浓度的关系如图所示。能合理解释图中曲线变化的机理为
 )燃料电池,具有全固态结构、能量效率高、环保等特点。写出该电池负极电极反应式
)燃料电池,具有全固态结构、能量效率高、环保等特点。写出该电池负极电极反应式
您最近一年使用:0次
解题方法
5 . 醛酮在酸或碱的催化下生成偕二醇的反应历程如下:
下列说法不正确的是
酸催化历程: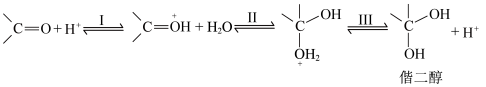
碱催化历程: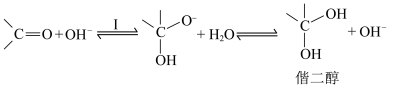
| 羰基化合物 |  |  |  |
| 平衡常数K | 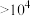 | 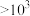 | 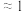 |
A.酸催化历程的步骤I中 与羰基中的O结合,增大了碳氧双键的极性 与羰基中的O结合,增大了碳氧双键的极性 |
B.对比酸和碱的催化历程可知,与羰基反应的活性: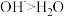 |
C.无论酸或碱催化,生成偕二醇的平衡常数: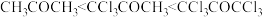 |
D.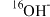 催化下, 催化下,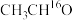 的 的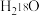 溶液中无法生成 溶液中无法生成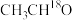 |
您最近一年使用:0次
6 . 连二亚硫酸钠( )俗称保险粉,是一种白色晶体,常用作纺织工业的漂白剂、脱色剂等。已知
)俗称保险粉,是一种白色晶体,常用作纺织工业的漂白剂、脱色剂等。已知 易溶于水,不溶于乙醇,具有极强的还原性。某兴趣小组用下图所示装置制备连二亚硫酸钠(夹持及加热装置已略去)。回答下列问题。
易溶于水,不溶于乙醇,具有极强的还原性。某兴趣小组用下图所示装置制备连二亚硫酸钠(夹持及加热装置已略去)。回答下列问题。___________ 。
(2)仪器B中生成的气体通入D中,与甲酸钠和 反应,除生成
反应,除生成 外还产生了一种无毒气体,该反应的化学方程式为
外还产生了一种无毒气体,该反应的化学方程式为___________ 。
(3)按气流方向完成合理的连接顺序:___________ 。
a→___________→___________→___________→___________→f
(4)下列说法正确的是___________。
(5)称取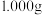 制得的
制得的 产品溶于冷水配成
产品溶于冷水配成 溶液,取出
溶液,取出 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用 碱性
碱性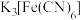 标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为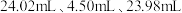 。
。
已知: 将
将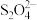 氧化为
氧化为 ,自身被还原为
,自身被还原为 。
。
①指示剂的条件电位要在滴定突跃电位之间,本实验滴定突跃范围为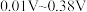 ,请根据下表所信息,选择合适指示剂,滴定终点的现象为
,请根据下表所信息,选择合适指示剂,滴定终点的现象为___________ 。
②样品中 的质量分数为
的质量分数为___________ %(杂质不参与反应,保留3位有效数字)。
 )俗称保险粉,是一种白色晶体,常用作纺织工业的漂白剂、脱色剂等。已知
)俗称保险粉,是一种白色晶体,常用作纺织工业的漂白剂、脱色剂等。已知 易溶于水,不溶于乙醇,具有极强的还原性。某兴趣小组用下图所示装置制备连二亚硫酸钠(夹持及加热装置已略去)。回答下列问题。
易溶于水,不溶于乙醇,具有极强的还原性。某兴趣小组用下图所示装置制备连二亚硫酸钠(夹持及加热装置已略去)。回答下列问题。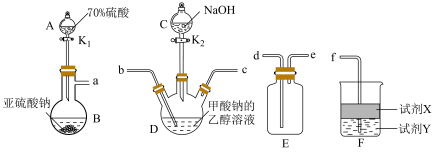
(2)仪器B中生成的气体通入D中,与甲酸钠和
 反应,除生成
反应,除生成 外还产生了一种无毒气体,该反应的化学方程式为
外还产生了一种无毒气体,该反应的化学方程式为(3)按气流方向完成合理的连接顺序:
a→___________→___________→___________→___________→f
(4)下列说法正确的是___________。
A.为减小杂质的生成,应打开 一段时间后再打开 一段时间后再打开 |
B.从D中混合产物分离出 晶体的操作是蒸发浓缩、冷却结晶、过滤 晶体的操作是蒸发浓缩、冷却结晶、过滤 |
| C.为防止产品变质,应选择低温烘干的干燥方式 |
D.仪器F中的试剂可以是:X为 溶液、Y为 溶液、Y为 ,目的是防止倒吸 ,目的是防止倒吸 |
(5)称取
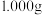 制得的
制得的 产品溶于冷水配成
产品溶于冷水配成 溶液,取出
溶液,取出 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用 碱性
碱性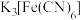 标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为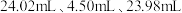 。
。已知:
 将
将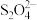 氧化为
氧化为 ,自身被还原为
,自身被还原为 。
。①指示剂的条件电位要在滴定突跃电位之间,本实验滴定突跃范围为
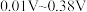 ,请根据下表所信息,选择合适指示剂,滴定终点的现象为
,请根据下表所信息,选择合适指示剂,滴定终点的现象为| 指示剂 | 条件电位(V) | 颜色变化 | |
| 氧化态 | 还原态 | ||
| 亚甲基蓝 | 0.36 | 蓝色 | 无色 |
| 二苯胺 | 0.76 | 紫色 | 无色 |
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
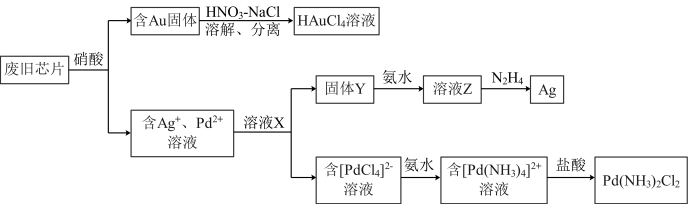
7 . 如图所示可以分离并回收废旧芯片中的几种贵金属。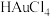 是一种强酸:②
是一种强酸:② 难溶。
难溶。
请回答:
(1)含金固体可溶于 和NaCl的混合溶液,写出反应的离子方程式:
和NaCl的混合溶液,写出反应的离子方程式:______ 。常温时 在碱性条件下能还原Z,写出反应的化学方程式:
在碱性条件下能还原Z,写出反应的化学方程式:______ 。
(2)金的分离还可以加王水,银钯的分离可重复利用某些溶液。
①下列说法正确的是______ 。
A.芯片中的金是芯片连接的绝佳材料,只是利用其物理性质
B.溶液X可以是NaCl溶液
C.配位能力:
D. 不直接还原固体Y可能的原因是得到的Ag纯度更高
不直接还原固体Y可能的原因是得到的Ag纯度更高
②加入盐酸,调pH≈1能将 转化为
转化为 ,解释其原因
,解释其原因______ 。
(3)溶液Z中加NaCl溶液是否有沉淀?______ (填“有”或“没有”)。设计实验验证溶液Z中银元素的存在______ 。
 是一种强酸:②
是一种强酸:② 难溶。
难溶。请回答:
(1)含金固体可溶于
 和NaCl的混合溶液,写出反应的离子方程式:
和NaCl的混合溶液,写出反应的离子方程式: 在碱性条件下能还原Z,写出反应的化学方程式:
在碱性条件下能还原Z,写出反应的化学方程式:(2)金的分离还可以加王水,银钯的分离可重复利用某些溶液。
①下列说法正确的是
A.芯片中的金是芯片连接的绝佳材料,只是利用其物理性质
B.溶液X可以是NaCl溶液
C.配位能力:

D.
 不直接还原固体Y可能的原因是得到的Ag纯度更高
不直接还原固体Y可能的原因是得到的Ag纯度更高②加入盐酸,调pH≈1能将
 转化为
转化为 ,解释其原因
,解释其原因(3)溶液Z中加NaCl溶液是否有沉淀?
您最近一年使用:0次
名校
8 . 某聚合物Z的合成路线如下:
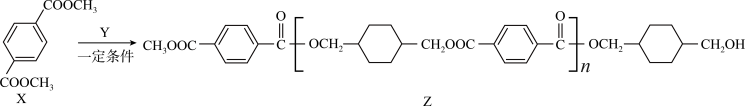
| A.X分子中所有原子共平面,有两种化学环境的氢原子 |
B.生成1mol Z,理论上同时生成 |
C.1mol Z与NaOH溶液充分反应,最多消耗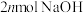 |
D.Y为 |
您最近一年使用:0次
名校
9 . 丙酮与 反应并进一步转化为2-氰基丙烯,过程如下:
反应并进一步转化为2-氰基丙烯,过程如下: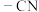 )是一个强吸电子基团。下列说法正确的是
)是一个强吸电子基团。下列说法正确的是
 反应并进一步转化为2-氰基丙烯,过程如下:
反应并进一步转化为2-氰基丙烯,过程如下: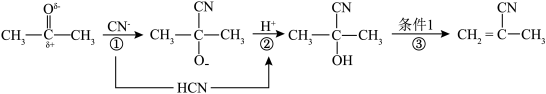
 )是一个强吸电子基团。下列说法正确的是
)是一个强吸电子基团。下列说法正确的是A.步骤③,“条件1”可以是 醇溶液,加热 醇溶液,加热 |
B.步骤①,丙酮中羰基的 键共用电子对转化为碳原子与氰基间的 键共用电子对转化为碳原子与氰基间的 键共用电子对 键共用电子对 |
C.反应物中加不等质量 固体,随着 固体,随着 增加,反应速率先增大后减小 增加,反应速率先增大后减小 |
D.酸性: |
您最近一年使用:0次
2024-06-08更新
|
157次组卷
|
2卷引用:浙江省杭州市学军中学2023-2024学年高三下学期5月阶段性考试
名校
解题方法
10 . 科学家在电极表面沉积非晶态 以高选择性合成
以高选择性合成 ,装置及阴极转化过程如题图所示。阴极区溶液酸化后可得
,装置及阴极转化过程如题图所示。阴极区溶液酸化后可得 。下列说法正确的是[已知:
。下列说法正确的是[已知: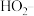 选择性
选择性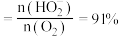 ,*表示吸附在
,*表示吸附在 表面的原子]
表面的原子]
 以高选择性合成
以高选择性合成 ,装置及阴极转化过程如题图所示。阴极区溶液酸化后可得
,装置及阴极转化过程如题图所示。阴极区溶液酸化后可得 。下列说法正确的是[已知:
。下列说法正确的是[已知: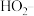 选择性
选择性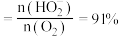 ,*表示吸附在
,*表示吸附在 表面的原子]
表面的原子]
A.阴极生成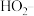 的反应式为: 的反应式为: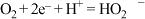 |
B. 参与阴极反应,共转移电子 参与阴极反应,共转移电子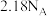 |
C.电解后,阳极室溶液中的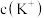 增大 增大 |
D.形成 吸附态有利于 吸附态有利于 键断裂 键断裂 |
您最近一年使用:0次
2024-06-07更新
|
78次组卷
|
2卷引用:浙江省杭州市学军中学2023-2024学年高三下学期5月阶段性考试



