名校
1 . NaDCC(结构简式为 ),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
原理: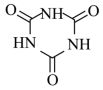 (氰尿酸)+2NaClO
(氰尿酸)+2NaClO
 +NaOH+H2O
+NaOH+H2O
实验装置:
①向D中加入10mL40%NaOH溶液,水浴控温10℃左右,搅拌。
②A中加入KMnO4固体,B中加入浓盐酸,混合使之反应,打开磁力搅拌器。
③D中pH降至8左右时,向其中加入一定量氰尿酸,保持10℃左右,边搅拌边持续通入A中产生的气体,至D中有较多晶体析出,停止反应;
④将D中的混合物用冰水浴冷却,过滤,洗涤,低温晾干得到NaDCC晶体。
Ⅱ.NaDCC有效氯含量测定:
⑤用250mL碘量瓶称取0.2000gNaDCC晶体样品,加蒸馏水100mL,摇动至样品完全溶解,加适量的碘化钾和稀硫酸,避光放置5min。再用少量水冲洗碘量瓶瓶塞和瓶内壁。
⑥用滴定管快速滴入0.2000
 Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。
Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。⑦完成一次空白试验,消耗Na2S2O3溶液0.16mL。
已知:
 ;样品有效氯=
;样品有效氯=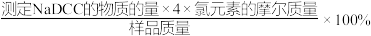 。
。请回答下列问题:
(1)仪器B的名称是
(2)若步骤②中通入气体过快,仪器D中反应热量未及时散失,可生成较多NaClO3副产物,该副反应的离子方程式为
(3)步骤④中洗涤的具体操作是
(4)已知NaDCC在酸性环境中还原得到氰尿酸和氯化物,写出步骤⑤中样品加入适量的碘化钾和稀硫酸的离子反应方程式
(5)步骤⑥中使用的最佳指示剂是
(6)计算得样品有效氯为
您最近一年使用:0次
解题方法
2 . 烯烃在有机合成中有重要作用,其反应机理及合成路线是化学研究的热点。回答下列问题:
Ⅰ.乙烯催化氧化的过程如图所示(部分相关离子未画出): 的作用是
的作用是___________ ,乙烯催化氧化反应的化学方程式为___________ 。
Ⅱ.苯乙烯在一定条件下有如图所示转化关系:___________ 。
(3)产物C可能的结构简式为___________ (任写一种)。
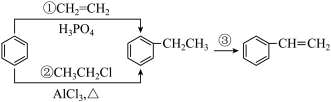
(4)以下是合成苯乙烯的一种路线:___________ ,写出反应②的化学方程式:___________
(5)已知: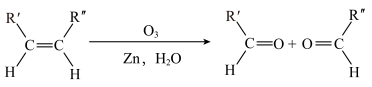 ,该反应为烯烃的臭氧化反应,R、R'和R''可以为任意烃基或者H原子。由此推断分子式为
,该反应为烯烃的臭氧化反应,R、R'和R''可以为任意烃基或者H原子。由此推断分子式为 的烯烃发生臭氧化反应最多有
的烯烃发生臭氧化反应最多有___________ 种产物。
Ⅰ.乙烯催化氧化的过程如图所示(部分相关离子未画出):
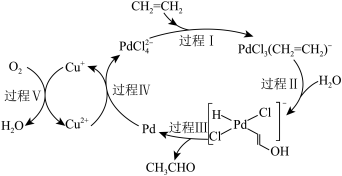
 的作用是
的作用是Ⅱ.苯乙烯在一定条件下有如图所示转化关系:
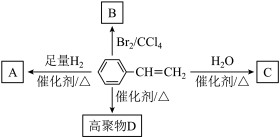
(3)产物C可能的结构简式为
(4)以下是合成苯乙烯的一种路线:
(5)已知:
 ,该反应为烯烃的臭氧化反应,R、R'和R''可以为任意烃基或者H原子。由此推断分子式为
,该反应为烯烃的臭氧化反应,R、R'和R''可以为任意烃基或者H原子。由此推断分子式为 的烯烃发生臭氧化反应最多有
的烯烃发生臭氧化反应最多有
您最近一年使用:0次
名校
3 . 硫元素广泛存在于自然界中,是动植物生长不可缺少的元素。
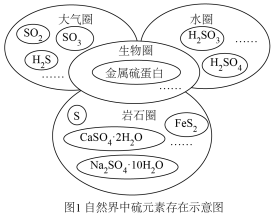
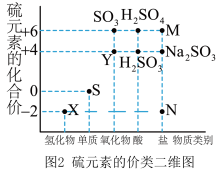
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
II.小组同学利用图3装置测定空气中 的含量。
的含量。___________ ,该装置中发生反应的离子方程式为___________ 。
(5)若空气流速为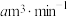 ,当观察到装置内
,当观察到装置内___________ 时,结束计时,测定耗时tmin,假定空气中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是___________  。
。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是II.小组同学利用图3装置测定空气中
 的含量。
的含量。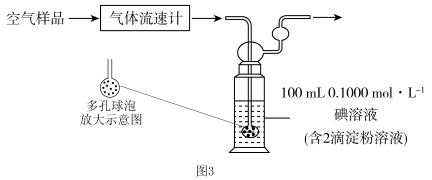
(5)若空气流速为
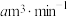 ,当观察到装置内
,当观察到装置内 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是 。
。
您最近一年使用:0次
解题方法
4 . 某废水处理过程中始终保持 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与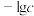 关系如下图所示,c为
关系如下图所示,c为 、
、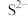 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知:
。已知: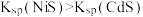 。下列说法正确的是
。下列说法正确的是
 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与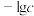 关系如下图所示,c为
关系如下图所示,c为 、
、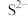 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知:
。已知: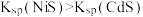 。下列说法正确的是
。下列说法正确的是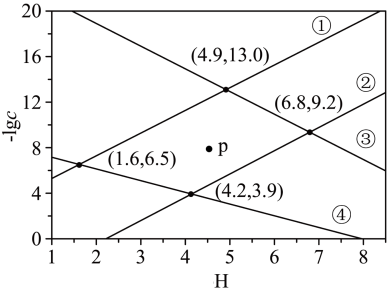
A.④为pH与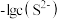 的关系曲线 的关系曲线 |
B.p点生成的沉淀中含有 和 和 |
C. 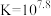 |
D.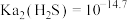 |
您最近一年使用:0次
5 . 用平衡移动原理,分析一定温度下 在不同pH的
在不同pH的 体系中的可能产物。
体系中的可能产物。
已知:
ⅰ.图1中曲线表示 体系中各含碳粒子的物质的量分数与pH的关系。
体系中各含碳粒子的物质的量分数与pH的关系。
ⅱ.2中曲线Ⅰ的离子浓度关系符合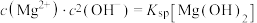 ;
;
曲线Ⅱ的离子浓度关系符合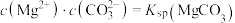 [注:起始
[注:起始 mol⋅L
mol⋅L ,不同pH下
,不同pH下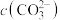 由图1得到]。
由图1得到]。
 在不同pH的
在不同pH的 体系中的可能产物。
体系中的可能产物。已知:
ⅰ.图1中曲线表示
 体系中各含碳粒子的物质的量分数与pH的关系。
体系中各含碳粒子的物质的量分数与pH的关系。ⅱ.2中曲线Ⅰ的离子浓度关系符合
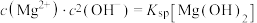 ;
;曲线Ⅱ的离子浓度关系符合
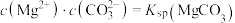 [注:起始
[注:起始 mol⋅L
mol⋅L ,不同pH下
,不同pH下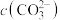 由图1得到]。
由图1得到]。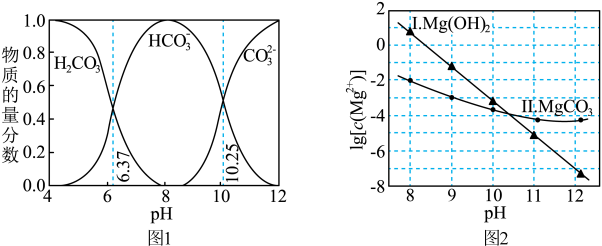
A.由图1可知,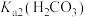 的数量级是 的数量级是 |
B.由图2,若初始状态 , , ,无沉淀生成 ,无沉淀生成 |
C.由图2,若初始状态 , ,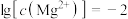 ,平衡后溶液中存在 ,平衡后溶液中存在 mol/L mol/L |
D.由图1和图2,若初始状态 , ,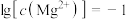 ,发生反应: ,发生反应: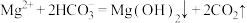 |
您最近一年使用:0次
2024-06-17更新
|
48次组卷
|
2卷引用:安徽省江南十校2023-2024学年高二下学期5月阶段联考化学B试题
名校
解题方法
6 . 亚氯酸钠有强氧化性,是一种重要的含氯消毒剂,实验室可通过以下原理制备亚氯酸钠:
制备方法:在A装置制备 气体,并将
气体,并将 气体导入B装置中进一步反应得到亚氯酸钠
气体导入B装置中进一步反应得到亚氯酸钠
溶液,最后对B中溶液进行结晶操作获得 晶体。
晶体。____________ 。
(2)装置A中反应的离子方程式为____________ 。
(3)装置B中 在反应中为
在反应中为____________ (填氧化剂或还原剂),其电子式为______ ,若实验中 气体的流速过快可能会导致产品中混有较多的
气体的流速过快可能会导致产品中混有较多的______ 杂质。
(4)利用上述原理制备出 晶体的样品,可以用“间接碘量法”测定样品(杂质与
晶体的样品,可以用“间接碘量法”测定样品(杂质与 和
和 都不反应)的纯度。测定时进行如下实验:准确称取m g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:
都不反应)的纯度。测定时进行如下实验:准确称取m g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应: ,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol⋅L
,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol⋅L
 标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:
标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知: )。
)。
①所称取的样品中 的质量分数为
的质量分数为______ (用含c、V、m的代数式表示)。
②若滴定时其它操作正确,盛装 标准液的滴定管滴定前尖嘴处有气泡而滴定后气泡消失,则所测得
标准液的滴定管滴定前尖嘴处有气泡而滴定后气泡消失,则所测得 晶体纯度
晶体纯度______ (填偏高、偏低或无影响)。
制备方法:在A装置制备
 气体,并将
气体,并将 气体导入B装置中进一步反应得到亚氯酸钠
气体导入B装置中进一步反应得到亚氯酸钠溶液,最后对B中溶液进行结晶操作获得
 晶体。
晶体。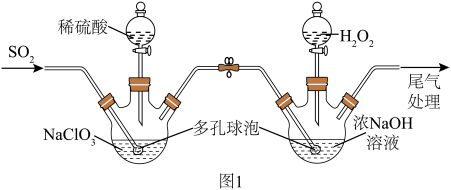
(2)装置A中反应的离子方程式为
(3)装置B中
 在反应中为
在反应中为 气体的流速过快可能会导致产品中混有较多的
气体的流速过快可能会导致产品中混有较多的(4)利用上述原理制备出
 晶体的样品,可以用“间接碘量法”测定样品(杂质与
晶体的样品,可以用“间接碘量法”测定样品(杂质与 和
和 都不反应)的纯度。测定时进行如下实验:准确称取m g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:
都不反应)的纯度。测定时进行如下实验:准确称取m g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应: ,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol⋅L
,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol⋅L
 标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:
标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知: )。
)。①所称取的样品中
 的质量分数为
的质量分数为②若滴定时其它操作正确,盛装
 标准液的滴定管滴定前尖嘴处有气泡而滴定后气泡消失,则所测得
标准液的滴定管滴定前尖嘴处有气泡而滴定后气泡消失,则所测得 晶体纯度
晶体纯度
您最近一年使用:0次
2024-06-16更新
|
32次组卷
|
2卷引用:安徽省江南十校2023-2024学年高二下学期5月阶段联考化学B试题
7 . 工业上以磷矿石[主要成分: 、
、 、
、 和有机碳等]为原料生产磷酸和石膏(
和有机碳等]为原料生产磷酸和石膏( ),流程示意图如下:
),流程示意图如下:
回答下列问题:
(1)为提高酸浸速率,可采取的措施有_______ 。(写出1条即可)
(2)生成的HF与 反应,生成二元强酸
反应,生成二元强酸 的离子方程式是:
的离子方程式是:_______ 。
(3)酸浸时 与
与 反应的化学方程式是:
反应的化学方程式是:_______ 。
(4)粗磷酸中的有机碳被 氧化为
氧化为 脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析
脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析 时有机碳脱除率最高的原因:
时有机碳脱除率最高的原因:_______ 。
(5)脱氟过程中发生的化学反应方程式是:_______ ,若按物质的量之比 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,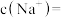
_______  ;
;
(6)脱硫过程中,分批加入一定量的 达到脱硫的目的,其反应离子方程式是
达到脱硫的目的,其反应离子方程式是_______ 。
(7)该工艺中通常使用一定浓度的 溶液洗涤磷石膏(
溶液洗涤磷石膏(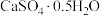 ),原因是
),原因是_____ 。
(8) 浓度(以
浓度(以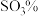 计)、
计)、 浓度(以
浓度(以 计)。一定温度下,石膏存在形式与溶液中
计)。一定温度下,石膏存在形式与溶液中 和
和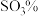 的关系如图所示,下列条件能实现
的关系如图所示,下列条件能实现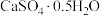 转化为
转化为 的是
的是_______ (填字母)。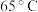 、
、 、
、
B. 、
、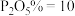 、
、
C.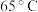 、
、 、
、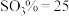
(9)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗
,消耗 溶液
溶液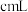 ,精制磷酸中
,精制磷酸中 的质量分数是
的质量分数是_______ 。
 、
、 、
、 和有机碳等]为原料生产磷酸和石膏(
和有机碳等]为原料生产磷酸和石膏( ),流程示意图如下:
),流程示意图如下:
| 物质 | 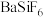 |  |  |  |  |
 |  |  |  | 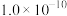 |  |
(1)为提高酸浸速率,可采取的措施有
(2)生成的HF与
 反应,生成二元强酸
反应,生成二元强酸 的离子方程式是:
的离子方程式是:(3)酸浸时
 与
与 反应的化学方程式是:
反应的化学方程式是:(4)粗磷酸中的有机碳被
 氧化为
氧化为 脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析
脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析 时有机碳脱除率最高的原因:
时有机碳脱除率最高的原因:温度 | 40 | 50 | 60 | 70 | 80 | 85 | 90 |
有机碳脱出率约为 | 72 | 75 | 78 | 80 | 82 | 78 | 75 |
 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,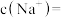
 ;
;(6)脱硫过程中,分批加入一定量的
 达到脱硫的目的,其反应离子方程式是
达到脱硫的目的,其反应离子方程式是(7)该工艺中通常使用一定浓度的
 溶液洗涤磷石膏(
溶液洗涤磷石膏(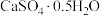 ),原因是
),原因是(8)
 浓度(以
浓度(以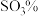 计)、
计)、 浓度(以
浓度(以 计)。一定温度下,石膏存在形式与溶液中
计)。一定温度下,石膏存在形式与溶液中 和
和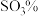 的关系如图所示,下列条件能实现
的关系如图所示,下列条件能实现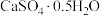 转化为
转化为 的是
的是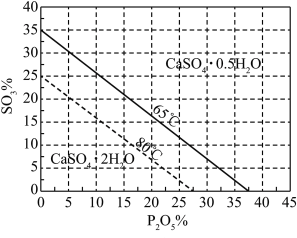
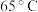 、
、 、
、
B.
 、
、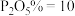 、
、
C.
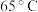 、
、 、
、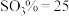
(9)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用
 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗
,消耗 溶液
溶液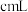 ,精制磷酸中
,精制磷酸中 的质量分数是
的质量分数是
您最近一年使用:0次
8 . 下列方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 证明 和 和 光照下发生取代反应 光照下发生取代反应 | 将装有干燥 的集气瓶倒扣在装有干燥 的集气瓶倒扣在装有干燥 的集气瓶上,抽出玻璃片,置于光照条件下反应 的集气瓶上,抽出玻璃片,置于光照条件下反应 | 观察到集气瓶内出现白雾,则可证明 和 和 光照下发生取代反应 光照下发生取代反应 |
| B | 检验 溶液中是否含有 溶液中是否含有 | 将 溶液滴入到酸性 溶液滴入到酸性 溶液中 溶液中 | 观察到 溶液由紫红色变无色,证明 溶液由紫红色变无色,证明 溶液中含有 溶液中含有 |
| C | 探究 、 、 、 、 的氧化性强弱 的氧化性强弱 | 先向NaBr溶液中通入足量 ,再将通入 ,再将通入 后的溶液加入 后的溶液加入 淀粉溶液中 淀粉溶液中 | NaBr溶液变橙黄色,KI淀粉溶液变蓝色,证明氧化性 |
| D | 浓硫酸滴入蔗糖中,产生的气体通入澄清石灰水 | 蔗糖变黑、体积膨胀,澄清石灰水变浑浊 | 浓硫酸具有脱水性和强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 中国在氢能研究方面已取得显著进展。绿氢的生产及储存作为氢能利用的关键技术,是当前关注的热点之一、
I.制氢
(1)化学制氢。工业上制取氢气时涉及的一个重要反应是: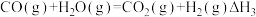
已知:①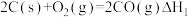
②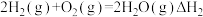
利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应的 。
。
(2)电化学制氢。光、电催化——化学环反应耦合分解 制
制 的原理示意图如下图所示。
的原理示意图如下图所示。_______ 。
②除了 外,
外,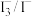 也能实现如图所示循环过程。结合化学用语,说明
也能实现如图所示循环过程。结合化学用语,说明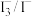 能够使S源源不断产生的原因:
能够使S源源不断产生的原因:_______ 。
Ⅱ.储氢与释氢
(3) 是一种重要的储氢载体,能与水反应生成
是一种重要的储氢载体,能与水反应生成 ,且反应前后B的化合价不变,反应消耗
,且反应前后B的化合价不变,反应消耗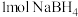 时转移的电子数目为
时转移的电子数目为_______ 。
(4)有机物释氢与储氢。其中一种方法为利用环己烷和苯之间的可逆反应来实现释氢和储氢。
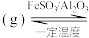
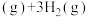
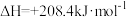 。
。
①在某温度下,向恒容容器中加入环己烷,其起始浓度为 ,平衡时苯的浓度为
,平衡时苯的浓度为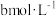 ,该反应的平衡常数
,该反应的平衡常数
_______ 。
②有利于释氢的措施为:_______ (从反应限度的角度回答)。
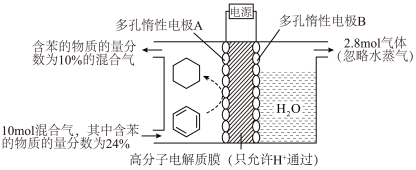
(5)一定条件下,下图所示装置可实现有机物的电化学储氢(忽略其它有机物)。_______ 。
②该储氢装置的电流效率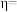
_______ 。( )(计算结果保留小数点后一位)
)(计算结果保留小数点后一位)
I.制氢
(1)化学制氢。工业上制取氢气时涉及的一个重要反应是:
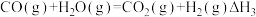
已知:①
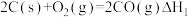
②
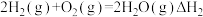
利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。(2)电化学制氢。光、电催化——化学环反应耦合分解
 制
制 的原理示意图如下图所示。
的原理示意图如下图所示。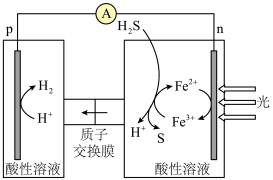
②除了
 外,
外,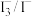 也能实现如图所示循环过程。结合化学用语,说明
也能实现如图所示循环过程。结合化学用语,说明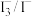 能够使S源源不断产生的原因:
能够使S源源不断产生的原因:Ⅱ.储氢与释氢
(3)
 是一种重要的储氢载体,能与水反应生成
是一种重要的储氢载体,能与水反应生成 ,且反应前后B的化合价不变,反应消耗
,且反应前后B的化合价不变,反应消耗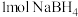 时转移的电子数目为
时转移的电子数目为(4)有机物释氢与储氢。其中一种方法为利用环己烷和苯之间的可逆反应来实现释氢和储氢。

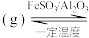

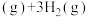
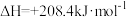 。
。①在某温度下,向恒容容器中加入环己烷,其起始浓度为
 ,平衡时苯的浓度为
,平衡时苯的浓度为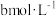 ,该反应的平衡常数
,该反应的平衡常数
②有利于释氢的措施为:
(5)一定条件下,下图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
②该储氢装置的电流效率
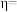
 )(计算结果保留小数点后一位)
)(计算结果保留小数点后一位)
您最近一年使用:0次
10 . 某实验小组对KSCN的性质进行探究,设计如下实验:
(1) 存在两种结构式,分别为
存在两种结构式,分别为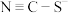 和
和 ,
, 是二者的互变异构的混合物,请写出
是二者的互变异构的混合物,请写出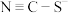 的电子式
的电子式___________ 。
(2)①用离子方程式表示实验 溶液变红的原因
溶液变红的原因___________ 、___________ 。
②针对实验 中红色褪去的原因,小组同学认为是
中红色褪去的原因,小组同学认为是 被酸性
被酸性 氧化为
氧化为 ,并设计如如图实验装置证实了猜想是成立的。
,并设计如如图实验装置证实了猜想是成立的。 溶液是
溶液是___________ , 溶液是
溶液是___________ ,检验产物 的操作及现象是
的操作及现象是___________ 。
(3)工业上测定钛铁合金中钛含量的其中一步反应原理是:以 为指示剂,用
为指示剂,用 标准溶液滴定
标准溶液滴定 (
( ),反应的化学方程式为:
),反应的化学方程式为: ,每
,每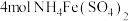 参加反应时转移电子的物质的量为
参加反应时转移电子的物质的量为___________ 。
(4)针对实验 “红色明显变浅”的现象,实验小组进行探究。
“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知: 和
和 反应的溶液体系中也存在
反应的溶液体系中也存在 平衡体系。当弱电解质溶液加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使
平衡体系。当弱电解质溶液加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使 平衡体系中的
平衡体系中的 跟
跟 结合成
结合成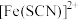 的机会减少,溶液红色变浅。乙同学认为
的机会减少,溶液红色变浅。乙同学认为 可以与
可以与 反应生成无色络合离子,进一步使
反应生成无色络合离子,进一步使 平衡左移,红色明显变浅,而
平衡左移,红色明显变浅,而 与
与 难络合,于是乙设计了如下实验:
难络合,于是乙设计了如下实验:___________ 。
| 试管中试剂 | 实验 | 滴加试剂 | 现象 |
|  | i.先加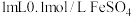 溶液 溶液ii.再加硫酸酸化的  溶液 溶液 | i.无明显现象 ii.先变红,后褪色 |
 | iii.先加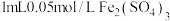 溶液 溶液iv.再滴加  溶液 溶液 | i.溶液变红 iv.红色明显变浅 |
(1)
 存在两种结构式,分别为
存在两种结构式,分别为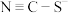 和
和 ,
, 是二者的互变异构的混合物,请写出
是二者的互变异构的混合物,请写出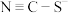 的电子式
的电子式(2)①用离子方程式表示实验
 溶液变红的原因
溶液变红的原因②针对实验
 中红色褪去的原因,小组同学认为是
中红色褪去的原因,小组同学认为是 被酸性
被酸性 氧化为
氧化为 ,并设计如如图实验装置证实了猜想是成立的。
,并设计如如图实验装置证实了猜想是成立的。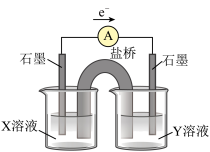
 溶液是
溶液是 溶液是
溶液是 的操作及现象是
的操作及现象是(3)工业上测定钛铁合金中钛含量的其中一步反应原理是:以
 为指示剂,用
为指示剂,用 标准溶液滴定
标准溶液滴定 (
( ),反应的化学方程式为:
),反应的化学方程式为: ,每
,每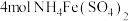 参加反应时转移电子的物质的量为
参加反应时转移电子的物质的量为(4)针对实验
 “红色明显变浅”的现象,实验小组进行探究。
“红色明显变浅”的现象,实验小组进行探究。甲同学查资料得知:
 和
和 反应的溶液体系中也存在
反应的溶液体系中也存在 平衡体系。当弱电解质溶液加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使
平衡体系。当弱电解质溶液加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使 平衡体系中的
平衡体系中的 跟
跟 结合成
结合成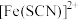 的机会减少,溶液红色变浅。乙同学认为
的机会减少,溶液红色变浅。乙同学认为 可以与
可以与 反应生成无色络合离子,进一步使
反应生成无色络合离子,进一步使 平衡左移,红色明显变浅,而
平衡左移,红色明显变浅,而 与
与 难络合,于是乙设计了如下实验:
难络合,于是乙设计了如下实验: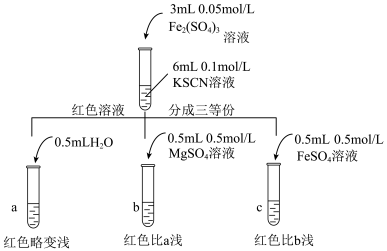
您最近一年使用:0次




