名校
1 . 有关反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法中错误的是
| A.FeS2既是氧化剂也是还原剂 |
| B.CuSO4在反应中被还原 |
| C.被还原的S和被氧化的S的质量之比为3∶7 |
| D.14 mol CuSO4氧化了1 mol FeS2 |
您最近一年使用:0次
2018-01-01更新
|
650次组卷
|
9卷引用:2016届安徽省皖南八校高三上学期第一次联考化学试卷
名校
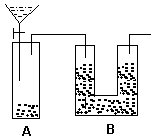
2 . 现有一瓶含NaCl杂质的Na2CO3样品,某同学设计了一种测定其纯度的方法,装置如下图,其中A容器中盛有样品10.0 g,分液漏斗内盛有稀硫酸,B容器内为碱石灰固体。
(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,可是结果数据出现了较大偏差(容器内反应均完全,装置内空气的影响忽略不计),请你分析可能的原因______ 。
(2)通过仔细分析,该同学重新设计了一套实验装置如下图,请回答有关问题:
(可供选择的试剂还有 Zn片、浓硫酸、NaOH溶液、CaCO3固体、蒸馏水)
①该套装置未画完整,请在你认为需要补充装置的虚框内画出合适的简图,并注明试剂。______
②A装置的广口瓶中应加入的试剂是__________ ;该装置的作用是________________ 。
③如果实验后测得E装置质量增重3.52 g,则该Na2CO3试样的纯度为__________ 。
(3)测定该Na2CO3试样纯度的方法有多种,请你利用不同的反应原理 再设计一套方案。
要求写出实验操作流程和试样中Na2CO3纯度的表达式__________ 。(试剂任选)
操作流程按下列图示表述:

①操作流程为:

②实验时称量样品的质量为a克,所测物质的质量为b克,该试样中Na2CO3纯度的表达式为:__________ 。
(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,可是结果数据出现了较大偏差(容器内反应均完全,装置内空气的影响忽略不计),请你分析可能的原因
(2)通过仔细分析,该同学重新设计了一套实验装置如下图,请回答有关问题:
(可供选择的试剂
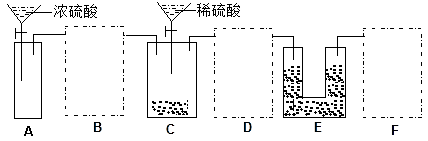
①该套装置未画完整,请在你认为需要补充装置的虚框内画出合适的简图,并注明试剂。
②A装置的广口瓶中应加入的试剂是
③如果实验后测得E装置质量增重3.52 g,则该Na2CO3试样的纯度为
(3)测定该Na2CO3试样纯度的方法有多种,请你利用
要求写出实验操作流程和试样中Na2CO3纯度的表达式
操作流程按下列图示表述:

①操作流程为:

②实验时称量样品的质量为a克,所测物质的质量为b克,该试样中Na2CO3纯度的表达式为:
您最近一年使用:0次
名校
3 . 已知纯水能发生微弱的电离,其电离方程式可表示为:2H2O H3O++OH-(H3O+通常简写为H+)。
H3O++OH-(H3O+通常简写为H+)。
在水中发生的反应举例:
NaOH+HCl==NaCl+H2O,
Na2O+2HCl==2NaCl+H2O。
(1)液态氨(NH3)与纯水相似,其电离方程式可表示为_________________ 。
(2)写出下列物质在液态氨中发生反应的化学方程式:
①NaNH2+NH4Cl—_______________ ;
②K3N+(NH4)2SO4—_____________ 。
 H3O++OH-(H3O+通常简写为H+)。
H3O++OH-(H3O+通常简写为H+)。在水中发生的反应举例:
NaOH+HCl==NaCl+H2O,
Na2O+2HCl==2NaCl+H2O。
(1)液态氨(NH3)与纯水相似,其电离方程式可表示为
(2)写出下列物质在液态氨中发生反应的化学方程式:
①NaNH2+NH4Cl—
②K3N+(NH4)2SO4—
您最近一年使用:0次
4 . 顺式一茉莉酮的一种合成路线如下(部分反应条件已略去,-Ph代表苯基):[

回答下列问题:
(1)化合物A的名称为_____________ ;G与I的关系是_______________ 。
(2)C中所含官能团是_____________ (填名称)。
(3)反应②的化学方程式为______________________ ,②的反应类型是 _____________ ;④的反应类型是______________________
(4)G的一种同分异构体能与FeCl3溶液发生显色反应且核磁共振氢谱显示只有4组峰,则符合条件的异构体的结构简式为____________ (有几个写几个)。
(5)参照顺式一茉莉酮的上述合成路线,设计一条由Cl2 C=C=O和乙烯为起始原料制备聚γ一丁内酯( )的合成路线
)的合成路线_______________________ 。

回答下列问题:
(1)化合物A的名称为
(2)C中所含官能团是
(3)反应②的化学方程式为
(4)G的一种同分异构体能与FeCl3溶液发生显色反应且核磁共振氢谱显示只有4组峰,则符合条件的异构体的结构简式为
(5)参照顺式一茉莉酮的上述合成路线,设计一条由Cl2 C=C=O和乙烯为起始原料制备聚γ一丁内酯(
 )的合成路线
)的合成路线
您最近一年使用:0次
5 . 卤族元素是典型的非金属元素,卤素单质及其化合物在工农业生产和生活中都有重要的用途。
(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是________ 。
(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等。卤素互化物中的化学键类型是______ (填标号)。
(3)BeCl2的分子空间构型为__________ ;BF3分子中B-F键的键角为_____________ 。
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式是否相同?____________ 。如果相同,则其杂化方式为 ___________ ;如果不相同,则其杂化方式分别为 ______________ 。(后两个空只能填一个,若两空都填,则不给分)
(5)HF的相对分子质量小于HCl,但其沸点却高于HCl,其原因是________________
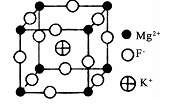
(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为_________________________ ;列式计算该晶体的密度(g.cm-3)
(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是
(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等。卤素互化物中的化学键类型是
| A.极性键 | B.非极性键 | C.离子键 | D.σ键 |
(3)BeCl2的分子空间构型为
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式是否相同?
(5)HF的相对分子质量小于HCl,但其沸点却高于HCl,其原因是
(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为

您最近一年使用:0次
6 . 冰晶石(Na3 AlF6)难溶于水,广泛应用于铝的冶炼。工业上用萤石(CaF2)为原料生产Na3 AlF6:
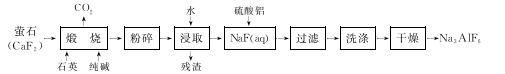
回答下列问题:
(1)在铝的冶炼中,Na3AlF6的作用是____________________ 。
(2)煅烧时总反应的化学方程式为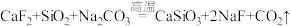 ,用水浸取后残渣的主要成分是
,用水浸取后残渣的主要成分是___________________
(3)煅烧后的固体在浸取前进行粉碎的目的是__________________ ,为达到相同目的,常温浸取时还可采取的措施是 ______________ 。
(4)写出向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:___________ 。NaF溶液呈碱性,用离子方程式表示其原因:_____________________ ,因此在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物
(5)97.5 kg含CaF2 80%萤石(杂质不含氟元素)理论上可生产Na3 AlF6______________ kg(设生产过程中的每一步含氟物质均完全转化)。

回答下列问题:
(1)在铝的冶炼中,Na3AlF6的作用是
(2)煅烧时总反应的化学方程式为
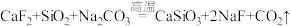 ,用水浸取后残渣的主要成分是
,用水浸取后残渣的主要成分是(3)煅烧后的固体在浸取前进行粉碎的目的是
(4)写出向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:
(5)97.5 kg含CaF2 80%萤石(杂质不含氟元素)理论上可生产Na3 AlF6
您最近一年使用:0次
7 . 莫尔盐[(NH4)2Fe(SO4)2•6H2O]在定量分析中常用作标定高锰酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验莫尔盐晶体强热时的分解产物。装置C中可观察到的现象是__________ ,由此可知莫尔盐晶体分解的产物中有 ___ 。装置B的主要作用是__________ 。

(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3 (g)、SO2 (g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
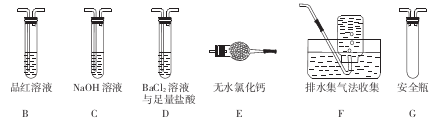
①乙组同学的实验中,装置依次连接的合理顺序为A、______________ 。
②装置D中足量盐酸的作用是_______________ ;含有SO3的实验现象是_____________ ;含有SO2的实验现象是_______________________
(3)设计实验证明:
①莫尔盐是否已氧化变质。_____________________ 。
②莫尔盐可用于标定高锰酸钾溶液的浓度(并写出相应的离子方程式)。________________ 。
(1)甲组同学按照如图所示的装置,通过实验检验莫尔盐晶体强热时的分解产物。装置C中可观察到的现象是

(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3 (g)、SO2 (g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。

①乙组同学的实验中,装置依次连接的合理顺序为A、
②装置D中足量盐酸的作用是
(3)设计实验证明:
①莫尔盐是否已氧化变质。
②莫尔盐可用于标定高锰酸钾溶液的浓度(并写出相应的离子方程式)。
您最近一年使用:0次
8 . 等物质的量的甲酸、乙酸及甘油(如图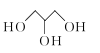 )混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)
)混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)
 )混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)
)混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)| A.4种 | B.5种 | C.6种 | D.7种 |
您最近一年使用:0次
9 . 2015年9月20日“长征六号”运载火箭成功将20颗微小卫星送入太空,创造了中国航天一箭多星的新纪录。“长征六号”运载火箭采用无毒环保的过氧化氢一煤油为推进剂。
(1)石油经过________ 可获得汽油、煤油、柴油、重油等,通过将重油_______ 可获得更多的汽油、煤油等轻质油。
(2)煤油中的主要组成元素是________ (填元素符号)。
(3)在H2O2水溶液中加入少量MnO2粉末时迅速产生大量气泡,该气体能使带火星的木条复燃,该反应中,还原产物是____________ (填化学式),每产生1mol气体时转移电子的物质的量为__________ 。
(4)H2O2不稳定,下列各表为在不同条件下1h内H2O2的分解率(均以质量分数为30%的H2O2溶液开始实验):
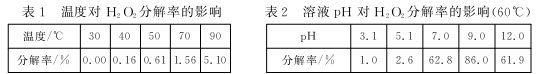
①在60℃、pH=3.1条件下,H2O2的分解速率为__________ mol/(L·min)(已知30%的H2O2溶液的密度为1.11 g/cm3,反应过程中溶液体积变化忽略不计,计算结果保留两位有效数字)。
②结合表中的规律,推测H2O2在下列条件下分解速率依次增大的顺序为_____________ (填标号)。
a.30℃、pH =13.0,H2O2溶液的质量分数为30%
b.70℃、pH=9.0,H2O2溶液的质量分数为30%
c.70℃、pH =13.0,H2O2溶液的质量分数为30%
(1)石油经过
(2)煤油中的主要组成元素是
(3)在H2O2水溶液中加入少量MnO2粉末时迅速产生大量气泡,该气体能使带火星的木条复燃,该反应中,还原产物是
(4)H2O2不稳定,下列各表为在不同条件下1h内H2O2的分解率(均以质量分数为30%的H2O2溶液开始实验):

①在60℃、pH=3.1条件下,H2O2的分解速率为
②结合表中的规律,推测H2O2在下列条件下分解速率依次增大的顺序为
a.30℃、pH =13.0,H2O2溶液的质量分数为30%
b.70℃、pH=9.0,H2O2溶液的质量分数为30%
c.70℃、pH =13.0,H2O2溶液的质量分数为30%
您最近一年使用:0次
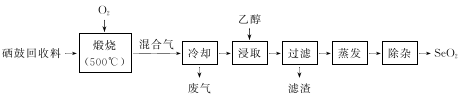
10 . 硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯。从该回收料中回收硒的工艺流程如下图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):
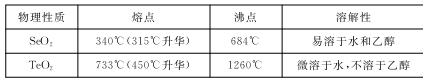
部分物质的物理性质如下表:
回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第_________ 周期,第______ 族;H2 SeO4的酸性比H2SO4的酸性 ______________ (填“强”或“弱”)。
(2)实验中往往需将硒鼓回收料粉碎,其目的是_________
(3)乙醇浸取后过滤所得滤渣的主要成分是_____________ 。蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是______________________ 。
(4)以SO2为还原剂可将SeO2还原为单质硒,写出反应的化学方程式:________________________

部分物质的物理性质如下表:

回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第
(2)实验中往往需将硒鼓回收料粉碎,其目的是
(3)乙醇浸取后过滤所得滤渣的主要成分是
(4)以SO2为还原剂可将SeO2还原为单质硒,写出反应的化学方程式:
您最近一年使用:0次



