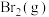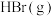名校
解题方法
1 . I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,以气体Z表示的平均反应速率为___________ 。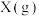 的平衡转化率为
的平衡转化率为___________ 。反应开始时与反应达平衡状态时的压强之比为___________
(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是___________。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
Ⅱ.下图是甲烷—氧气燃料电池原理示意图,回答下列问题。___________ ;
(5)a极的电极反应式为___________ ;
(6)标准状况下,消耗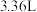 甲烷,电路中转移的电子数目为
甲烷,电路中转移的电子数目为___________ .

(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
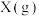 的平衡转化率为
的平衡转化率为(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是___________。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
| A.①②⑤ | B.①③④ | C.②③④ | D.③④⑤ |
Ⅱ.下图是甲烷—氧气燃料电池原理示意图,回答下列问题。

(5)a极的电极反应式为
(6)标准状况下,消耗
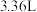 甲烷,电路中转移的电子数目为
甲烷,电路中转移的电子数目为
您最近一年使用:0次
解题方法
2 . 氧化锌在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种由含锌烟灰(含有ZnO、CuO、PbO、FeO、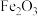 、MnO、
、MnO、 、CdO等)制备氧化锌的工艺流程如图所示。
、CdO等)制备氧化锌的工艺流程如图所示。
(ⅱ)二价金属氧化物能分别与氨形成配位化合物,如Fe(Ⅱ)、Mn(Ⅱ)可生成 、
、 ;
;
(ⅲ)Fe、Mn元素对应优势微粒与溶液的pH及氧化剂氧化电位(Eh)关系如图: 见下表:
见下表:
回答下列问题:
(1)O的价电子排布图为___________ ,Zn在周期表中的位置是___________ 。
(2)“氧化预处理”时,加入 溶液的目的为氧化含锌烟灰中的铁(Ⅱ)和锰(Ⅱ),则氧化产物为
溶液的目的为氧化含锌烟灰中的铁(Ⅱ)和锰(Ⅱ),则氧化产物为___________ 。
(3)“浸出”阶段溶解ZnO时消耗的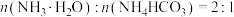 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(4)“深度净化”时,可采用以下两种方案:
方案甲:加入足量锌粉。该方案所得滤渣c中除了含Zn、Cd之外,还含有___________ (填化学式)。
方案乙:加入 粉末。已知杂质离子浓度较为接近且远小于含锌离子的浓度。则杂质离子生成沉淀的先后顺序依次为
粉末。已知杂质离子浓度较为接近且远小于含锌离子的浓度。则杂质离子生成沉淀的先后顺序依次为___________ (写沉淀的化学式);工业生产中常采用方案甲而不采用方案乙,其原因为___________ 。
(5)“蒸氨”时得到混合气体e和固体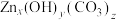 。混合气体e可返回至
。混合气体e可返回至___________ 工序循环利用。
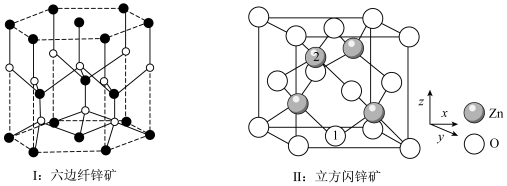
(6)氧化锌有六边纤锌矿和立方闪锌矿两种常见晶体结构,晶胞结构如图。___________ 。
②原子1的分数坐标为 ,则原子2的分数坐标为
,则原子2的分数坐标为___________ 。
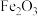 、MnO、
、MnO、 、CdO等)制备氧化锌的工艺流程如图所示。
、CdO等)制备氧化锌的工艺流程如图所示。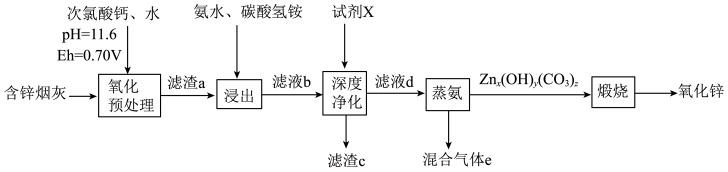
(ⅱ)二价金属氧化物能分别与氨形成配位化合物,如Fe(Ⅱ)、Mn(Ⅱ)可生成
 、
、 ;
;(ⅲ)Fe、Mn元素对应优势微粒与溶液的pH及氧化剂氧化电位(Eh)关系如图:

 见下表:
见下表:| 物质 | MnS | FeS | ZnS | PbS | CdS | CuS |
 | 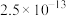 |  |  | 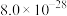 | 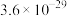 |  |
(1)O的价电子排布图为
(2)“氧化预处理”时,加入
 溶液的目的为氧化含锌烟灰中的铁(Ⅱ)和锰(Ⅱ),则氧化产物为
溶液的目的为氧化含锌烟灰中的铁(Ⅱ)和锰(Ⅱ),则氧化产物为(3)“浸出”阶段溶解ZnO时消耗的
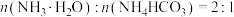 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)“深度净化”时,可采用以下两种方案:
方案甲:加入足量锌粉。该方案所得滤渣c中除了含Zn、Cd之外,还含有
方案乙:加入
 粉末。已知杂质离子浓度较为接近且远小于含锌离子的浓度。则杂质离子生成沉淀的先后顺序依次为
粉末。已知杂质离子浓度较为接近且远小于含锌离子的浓度。则杂质离子生成沉淀的先后顺序依次为(5)“蒸氨”时得到混合气体e和固体
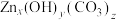 。混合气体e可返回至
。混合气体e可返回至(6)氧化锌有六边纤锌矿和立方闪锌矿两种常见晶体结构,晶胞结构如图。
②原子1的分数坐标为
 ,则原子2的分数坐标为
,则原子2的分数坐标为
您最近一年使用:0次
2024-05-14更新
|
75次组卷
|
2卷引用:2024届新疆高三下学期5月第三次适应性检测理综试卷-高中化学
解题方法
3 . 清华大学段吴泓副教授课题组首次利用糠醛创制了一种如图a所示的新型可充放电的“生物质电池”,该电池在充放电过程中可生产高附加值化学品糠醇和糠酸盐,其原理可用图b表示。下列说法正确的是




| A.该装置在生成糠酸盐时将电能转化为化学能 |
| B.膜a为阴离子交换膜 |
| C.充电时电极B附近碱性增强 |
| D.若使用铅蓄电池为其充电,当1mol糠醛转化时,Pb电极增重96g |
您最近一年使用:0次
2024-05-14更新
|
70次组卷
|
2卷引用:2024届新疆高三下学期5月第三次适应性检测理综试卷-高中化学
4 . N-甲基咪唑的结构简式为: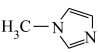 ,且4个碳原子和2个氮原子共平面,下列说法不正确的是
,且4个碳原子和2个氮原子共平面,下列说法不正确的是
| A.电负性:H<C<N<O |
B.咪唑分子中存在大π键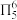 |
C.N-甲基咪唑分子中氮原子的杂化方式为 、 、 |
| D.N-甲基咪唑可以做配位体形成配位键 |
您最近一年使用:0次
2024-05-12更新
|
163次组卷
|
3卷引用:2024届新疆高三下学期5月第三次适应性检测理综试卷-高中化学
5 . 常温下0.2mol•L-1NaHCO3溶液与0.1mol•L-1Na2CO3溶液等体积混合后,下列关于说法不正确 的是
A.NaHCO3=Na++ | B.c(Na+)>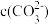 > > >c(OH-) >c(OH-) |
C.c(H+)+c(Na+)=c(OH-)+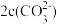 + + | D.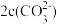 + + + +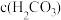 <c(Na+) <c(Na+) |
您最近一年使用:0次
名校
解题方法
6 . 铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________ ,占据最高能级的电子云轮廓图形状为___________ 。
(2)通常情况下, 可由六氟铝酸铵
可由六氟铝酸铵 受热分解制得,请写出该反应的化学方程式:
受热分解制得,请写出该反应的化学方程式:___________ 。
(3) 具有较高的熔点(1040℃),属于
具有较高的熔点(1040℃),属于___________ (填晶体类型)晶体; 在178℃时升华,写出
在178℃时升华,写出 、
、 晶体类型不同的原因
晶体类型不同的原因___________ (从原子结构与元素性质的角度作答)。
(4) 在水溶液中实际上是以
在水溶液中实际上是以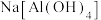 的形式存在。其中
的形式存在。其中 为配离子,Al原子的杂化方式为
为配离子,Al原子的杂化方式为___________ ,该阴离子中存在的化学键有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石( )晶体的晶胞如图所示,已知立方体边长为
)晶体的晶胞如图所示,已知立方体边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)通常情况下,
 可由六氟铝酸铵
可由六氟铝酸铵 受热分解制得,请写出该反应的化学方程式:
受热分解制得,请写出该反应的化学方程式:(3)
 具有较高的熔点(1040℃),属于
具有较高的熔点(1040℃),属于 在178℃时升华,写出
在178℃时升华,写出 、
、 晶体类型不同的原因
晶体类型不同的原因(4)
 在水溶液中实际上是以
在水溶液中实际上是以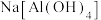 的形式存在。其中
的形式存在。其中 为配离子,Al原子的杂化方式为
为配离子,Al原子的杂化方式为A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石(
 )晶体的晶胞如图所示,已知立方体边长为
)晶体的晶胞如图所示,已知立方体边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。
(列出计算式)。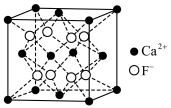
您最近一年使用:0次
2024-03-05更新
|
573次组卷
|
3卷引用:新疆阿克苏市实验中学2022-2023学年高二下学期第三次月考化学试题
名校
7 . A、B、C是三种常见短周期元素的单质,常温下D为无色液体,E是一种常见的温室气体,F是化合物.其转化关系如图(反应条件和部分产物略去)。试回答:

(1)E的结构式是______ 。
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;______ ;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是______ 。
已知
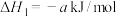
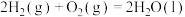
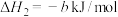
(4)已知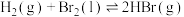
 ;蒸发1mol
;蒸发1mol  需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为______ 。
(5)以NaCl等为原料制备 的过程如下:
的过程如下:
①在无隔膜、微酸性条件下电解,发生反应: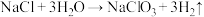 (未配平)。
(未配平)。
②在电解后溶液中加入KCl发生复分解反应,降温结晶,得
③一定条件下反应: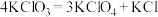 ,将产物分离得到
,将产物分离得到 。
。
该过程制得的 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为
全部转化为 ,反应为:
,反应为: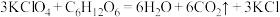 ,加入少量
,加入少量 溶液作指示剂,用
溶液作指示剂,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色 沉淀。计算
沉淀。计算 样品的纯度
样品的纯度______ (用含c、V的代数式表示)。

(1)E的结构式是
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和
 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是已知

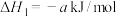
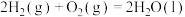
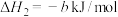
(4)已知
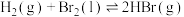
 ;蒸发1mol
;蒸发1mol 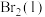 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为物质 |
|
|
|
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
(5)以NaCl等为原料制备
 的过程如下:
的过程如下:①在无隔膜、微酸性条件下电解,发生反应:
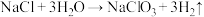 (未配平)。
(未配平)。②在电解后溶液中加入KCl发生复分解反应,降温结晶,得

③一定条件下反应:
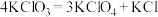 ,将产物分离得到
,将产物分离得到 。
。该过程制得的
 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为
全部转化为 ,反应为:
,反应为: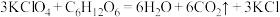 ,加入少量
,加入少量 溶液作指示剂,用
溶液作指示剂,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色 沉淀。计算
沉淀。计算 样品的纯度
样品的纯度
您最近一年使用:0次
2024-01-21更新
|
65次组卷
|
2卷引用:新疆乌鲁木齐市第九中学2023-2024学年高三上学期11月月考化学试题
名校
8 . I.能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是___________ (填字母)。
A.

B.

C.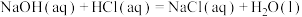

D.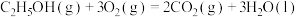

若以稀硫酸为电解质溶液,则原电池的正极反应式为___________ 。
II.如图所示的装置,X、Y都是惰性电极。将电路接通后,向乙中滴入酚酞溶液,在Fe极附近显红色。
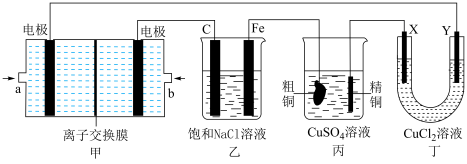
(2)甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,电极a上反应的电极反应式是___________ 。
(3)在乙装置中,总反应的离子方程式是___________ 。
(4)若乙装置中改装硝酸银溶液,接通电路一段时间后,溶液的pH___________ (填“增大”、“减小”或“不变”)
(5)工作时,丁装置Y电极上反应的电极反应式是___________ 。
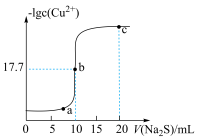
III.常温下,向10m L0.10mol/L CuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知Ksp(ZnS)>Ksp(CuS)。
(6)下列说法错误的是___________(填字母)。
(7)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36.向浓度均为0.1mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+):c(Cu2+)=___________ 。
(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.


B.


C.
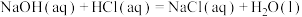

D.
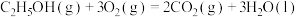

若以稀硫酸为电解质溶液,则原电池的正极反应式为
II.如图所示的装置,X、Y都是惰性电极。将电路接通后,向乙中滴入酚酞溶液,在Fe极附近显红色。

(2)甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,电极a上反应的电极反应式是
(3)在乙装置中,总反应的离子方程式是
(4)若乙装置中改装硝酸银溶液,接通电路一段时间后,溶液的pH
(5)工作时,丁装置Y电极上反应的电极反应式是
III.常温下,向10m L0.10mol/L CuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知Ksp(ZnS)>Ksp(CuS)。
(6)下列说法错误的是___________(填字母)。

| A.a、b两点CuS的溶度积Ksp相等 |
| B.常温下,CuS的溶度积Ksp的数量级为10-36 |
| C.c点溶液中:c(Cl-)>c(Na+)>c(S2-)>c(OH-)>c(H+) |
| D.闪锌矿(ZnS)遇到硫酸铜溶液可转变为铜蓝(CuS) |
(7)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36.向浓度均为0.1mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+):c(Cu2+)=
您最近一年使用:0次
名校
9 . 醋酸是一种常见的弱酸,回答下列问题:
(1)下列哪些措施能够使醋酸溶液中 增大___________(填字母)。
增大___________(填字母)。
(2)向100mL 0.1mol·L-1的醋酸中加入VmL 0.1mol·L-1的NaOH溶液完全反应后,溶液呈中性,则V___________ 100mL(填“>”“<”或“=”)。
(3)25℃时,pH=8的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=___________ ;pH=8的CH3COONa溶液中,水电离产生的OH-浓度c(OH-)水=___________ 。
(4)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大致为9,该实验选用酚酞作指示剂。
①如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为___________ mL;
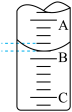
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol·L-1,三次实验结果记录如下:
从表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是___________ 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
③据②所得到的数据,写出计算该白醋中醋酸的物质的量浓度的表达式c=___________ mol·L-1(不必化简)。
(5)氨气溶于水得到氨水。在25℃下,将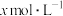 的氨水与
的氨水与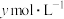 的盐酸等体积混合,反应后溶液显中性,则
的盐酸等体积混合,反应后溶液显中性,则
___________  (填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数___________ 。
(1)下列哪些措施能够使醋酸溶液中
 增大___________(填字母)。
增大___________(填字母)。| A.升温 | B.通入HCl气体 | C.加入NaOH固体 | D.加入NaHSO4固体 |
(2)向100mL 0.1mol·L-1的醋酸中加入VmL 0.1mol·L-1的NaOH溶液完全反应后,溶液呈中性,则V
(3)25℃时,pH=8的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=
(4)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大致为9,该实验选用酚酞作指示剂。
①如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为

②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol·L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
③据②所得到的数据,写出计算该白醋中醋酸的物质的量浓度的表达式c=
(5)氨气溶于水得到氨水。在25℃下,将
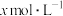 的氨水与
的氨水与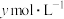 的盐酸等体积混合,反应后溶液显中性,则
的盐酸等体积混合,反应后溶液显中性,则
 (填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
您最近一年使用:0次
10 . 常温下的下列溶液,有关说法不正确的是
| A.将盐酸逐滴滴入氨水中至过量,水的电离程度:先增大后减小 |
B.pH计测得 和 和 饱和溶液的pH,前者小于后者,则有: 饱和溶液的pH,前者小于后者,则有: 酸性强于 酸性强于 |
C.向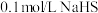 溶液中滴加酚酞,溶液变红,则有: 溶液中滴加酚酞,溶液变红,则有: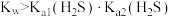 |
D.等浓度的 溶液和 溶液和 溶液的pH:前者大于后者 溶液的pH:前者大于后者 |
您最近一年使用:0次