1 . ECH(环氧氯丙烷,结构为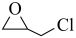 )是生产环氧树脂的中间体,工业上可由原料丙烯合成,合成路线如图所示。
)是生产环氧树脂的中间体,工业上可由原料丙烯合成,合成路线如图所示。

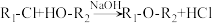
(1)ECH中含有的官能团是
(2)已知
 为加成反应,
为加成反应, 的反应类型是
的反应类型是(3)
 的反应中,B与次氯酸加成得到C,C有两种结构。
的反应中,B与次氯酸加成得到C,C有两种结构。①C结构简式是ⅰ:
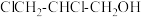 和ⅱ:
和ⅱ:②由分子中化学键的极性分析:ⅰ为
 的主要产物。该分析过程是
的主要产物。该分析过程是(4)对
 环氧氯丙烷的反应研究表明,当保持其他条件(反应温度、反应时间等)不变时,随起始反应物中
环氧氯丙烷的反应研究表明,当保持其他条件(反应温度、反应时间等)不变时,随起始反应物中 和物质C的比例增大,环氧氯丙烷的产率如图所示:
和物质C的比例增大,环氧氯丙烷的产率如图所示: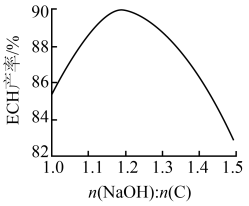
 的值增大,环氧氯丙烷产率下降的原因(用化学方程式表示):
的值增大,环氧氯丙烷产率下降的原因(用化学方程式表示):(5)原料中的丙烯可由石油裂解得到。在裂解分离得到的
 馏分中,除丙烯外,杂质气体中含有2种分子式均为
馏分中,除丙烯外,杂质气体中含有2种分子式均为 的链烃。
的链烃。①杂质的其中一种分子内含有
 杂化的碳原子,则该分子名称是
杂化的碳原子,则该分子名称是②杂质的另一种分子内,无
 杂化的碳原子,则该分子是
杂化的碳原子,则该分子是
您最近一年使用:0次
名校
2 . 铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(大球代表Fe,小球代表Mg)。则下列说法不正确的是
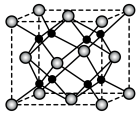
| A.铁镁合金的化学式为Mg2Fe |
| B.晶体中存在的化学键类型为金属键 |
| C.晶体中每个Fe周围紧邻的Mg有8个 |
D.该晶胞的质量是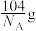 (NA表示阿伏加德罗常数的值) (NA表示阿伏加德罗常数的值) |
您最近一年使用:0次
2024-05-30更新
|
50次组卷
|
2卷引用:宁夏吴忠市吴忠中学2023-2024学年高二下学期期中考试化学试卷
名校
解题方法
3 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
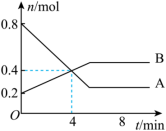
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
479次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
4 . 常温下,分别取未知浓度的 和
和 溶液,加水稀释至原体积的
溶液,加水稀释至原体积的 倍,稀释过程中,两溶液
倍,稀释过程中,两溶液 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

 和
和 溶液,加水稀释至原体积的
溶液,加水稀释至原体积的 倍,稀释过程中,两溶液
倍,稀释过程中,两溶液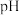 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
A. 为弱碱, 为弱碱,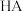 为强酸 为强酸 |
| B.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性 |
C.若升高温度,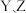 点对应溶液的 点对应溶液的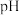 均不变 均不变 |
D.水的电离程度: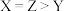 |
您最近一年使用:0次
2024-04-08更新
|
214次组卷
|
2卷引用:宁夏回族自治区石嘴山市平罗县平罗中学2023-2024学年高二下学期5月期中化学试题
名校
5 . 许多过渡金属离子能形成种类繁多的配合物。下列说法正确的是
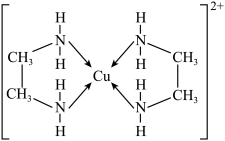
A.二乙二胺合铜配离子 的结构如图所示,可知 的结构如图所示,可知 的价电子排布式为 的价电子排布式为 ,配位数为4,配体数也为4 ,配位数为4,配体数也为4 |
B. 配合物中含有 配合物中含有 配位键 配位键 |
C.配合物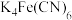 中的配位原子是C 中的配位原子是C |
D.配合物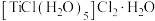 中心离子为 中心离子为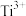 , , 该配合物与 该配合物与 溶液作用,生成 溶液作用,生成 |
您最近一年使用:0次
2024-02-19更新
|
578次组卷
|
5卷引用:宁夏回族自治区银川市永宁县上游高级中学2023-2024学年高二下学期期中考试化学试题
宁夏回族自治区银川市永宁县上游高级中学2023-2024学年高二下学期期中考试化学试题 山东省青岛市第二中学2023-2024学年高二上学期1月期末化学试题(已下线)热点09 配合物和超分子名校期末好题汇编-晶体结构与性质(选择题)(已下线)猜想03 晶体结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
6 . NaHSO4是一种酸式盐,请回答下列问题:
(1)NaHSO4在熔融状态下的电离方程式为___________ 。
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为___________ 。
(3)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出该反应的离子方程式:___________ 。
②下列三种情况下,离子方程式与上述①相同的是___________ (填字母,下同)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析不 正确的是___________。

(1)NaHSO4在熔融状态下的电离方程式为
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为
(3)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出该反应的离子方程式:
②下列三种情况下,离子方程式与上述①相同的是
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至
 恰好完全沉淀
恰好完全沉淀C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析

| A.①代表滴加H2SO4溶液的变化曲线 |
| B.b点,溶液中大量存在的离子是Na+、OH- |
| C.c点,两溶液中含有相同量的OH- |
| D.a、d两点对应的溶液均呈中性 |
您最近一年使用:0次
名校
7 . 七校某化学兴趣小组发现有一瓶无色澄清透明溶液,已知其只含下列离子中的若干种,且每种离子的数目相等: 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 ,分别取100ml溶液进行以下4组实验:
,分别取100ml溶液进行以下4组实验:
①向其中加入过量盐酸,滴加过程中均无气泡和沉淀生成。
②用pH试纸检测溶液呈碱性。
③做焰色试验,发现火焰呈黄色。
④加入足量 溶液,产生白色沉淀。
溶液,产生白色沉淀。
(1)由步骤①可以判断一定不存在的离子有___________ 。
(2)由以上实验操作能够判断的阳离子一定有___________ ,根据电中性原则能否确定含有 ,
,___________ (填“能”或“否”),请设计实验检验 :
:___________ ,书写检验 的离子方程式:
的离子方程式:___________ 。
(3)取实验①的酸性溶液加入铜片,产生气泡,经测定该气体为NO,溶液变蓝,请写出该反应的离子方程式:___________ 。
(4)电荷守恒是学习化学的重要思维方法。某 、
、 混合溶液中含有
混合溶液中含有 、
、 物质的量分别为
物质的量分别为 、
、 ,求溶液中
,求溶液中 的物质的量为
的物质的量为___________ mol。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 ,分别取100ml溶液进行以下4组实验:
,分别取100ml溶液进行以下4组实验:①向其中加入过量盐酸,滴加过程中均无气泡和沉淀生成。
②用pH试纸检测溶液呈碱性。
③做焰色试验,发现火焰呈黄色。
④加入足量
 溶液,产生白色沉淀。
溶液,产生白色沉淀。(1)由步骤①可以判断一定不存在的离子有
(2)由以上实验操作能够判断的阳离子一定有
 ,
, :
: 的离子方程式:
的离子方程式:(3)取实验①的酸性溶液加入铜片,产生气泡,经测定该气体为NO,溶液变蓝,请写出该反应的离子方程式:
(4)电荷守恒是学习化学的重要思维方法。某
 、
、 混合溶液中含有
混合溶液中含有 、
、 物质的量分别为
物质的量分别为 、
、 ,求溶液中
,求溶液中 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-08更新
|
415次组卷
|
3卷引用:宁夏银川市唐徕中学2023-2024学年高一上学期期中考试化学试题
名校
8 . 向一定浓度的 溶液中滴加
溶液中滴加 溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是
溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是

 溶液中滴加
溶液中滴加 溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是
溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是
A.ab段发生反应的离子方程式是: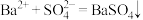 |
B.c点溶液中大量存在的离子是 、 、 |
| C.b、d两点对应溶液中的离子总数目相等 |
D.bc段发生反应的离子方程式是: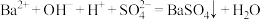 |
您最近一年使用:0次
2023-11-06更新
|
572次组卷
|
4卷引用:宁夏银川市育才中学2023-2024学年高一上学期11月期中考试化学试题
名校
9 . 二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
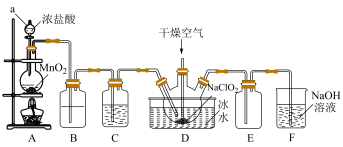
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
2023-11-06更新
|
650次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高一上学期期中考试化学试题
名校
10 . 已知反应:2NO(g)+2H2(g)  N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
下列说法中不正确的是
 N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。| 实验数据 | 初始浓度(mol·L-1) | 生成N2的初始速率(mol·L-1·s-1) | |
| c(NO) | c(H2) | ||
| 1 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
| 2 | 1.00×10-3 | 6.00×10-3 | 4.80×10-4 |
| 3 | 2.00×10-3 | 3.00×10-3 | 9.60×10-4 |
| A.关系式中x=2、y=1 |
| B.800℃时,k的值为8×104 |
| C.反应体系的二种物质中,H2(g)的浓度对反应速率影响更大 |
| D.当其他条件不变时,升高温度,速率常数将增大 |
您最近一年使用:0次



