1 . 利用氢气作为能源的前提是安全有效地解决储存氢气的问题。化学家已研究出多种储存氢气的方法。回答下列问题:
(1)某金属R的储氢材料可以通过化学反应将氢吸附和排放,已知R为短周期金属元素,其部分电离能数据如表所示:
该金属元素R是___________ (填元素符号),其位于元素周期表___________ 区。
(2)NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
氨硼烷(NH3BH3)中N、B都达到稳定结构,NH3BH3存在配位键,提供空轨道的是___________ (填元素符号),用化学键表示出(NH3BH3)分子的结构式:___________ 。
(3)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进到由Cu原子与Ag原子构成的全部四面体空隙中。该晶体储氢后的化学式为___________ 。
(4)过渡金属Q与镧(La)形成的合金是一种储氢材料,其中基态Q原子的价层电子排布式为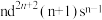 ,该合金的晶胞结构和z轴方向的投影图如图所示:
,该合金的晶胞结构和z轴方向的投影图如图所示:___________ ,该合金的密度为___________ g·cm-3(用含a,c的代数式表示,NA为阿伏加德罗常数的值)。
(1)某金属R的储氢材料可以通过化学反应将氢吸附和排放,已知R为短周期金属元素,其部分电离能数据如表所示:
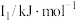 | 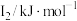 |  |  |  |
| 578 | 1817 | 2745 | 11577 | 14842 |
(2)NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
氨硼烷(NH3BH3)中N、B都达到稳定结构,NH3BH3存在配位键,提供空轨道的是
(3)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进到由Cu原子与Ag原子构成的全部四面体空隙中。该晶体储氢后的化学式为
(4)过渡金属Q与镧(La)形成的合金是一种储氢材料,其中基态Q原子的价层电子排布式为
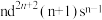 ,该合金的晶胞结构和z轴方向的投影图如图所示:
,该合金的晶胞结构和z轴方向的投影图如图所示:
您最近一年使用:0次
7日内更新
|
35次组卷
|
2卷引用:山西省部分学校2023-2024学年高二下学期5月质量检测化学试题
名校
解题方法
2 . 我国科学家屠呦呦因青蒿素研究获得诺贝尔奖,青蒿素是从青蒿中提取的能有效治疗疟疾的有机化合物。已知青蒿素为无色针状晶体,熔点为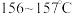 ,易溶于丙酮、乙醇和乙醚等有机溶剂,难溶于水。某校兴趣小组利用下列实验流程和实验装置提取青蒿素并确定其分子式。回答下列问题:
,易溶于丙酮、乙醇和乙醚等有机溶剂,难溶于水。某校兴趣小组利用下列实验流程和实验装置提取青蒿素并确定其分子式。回答下列问题:
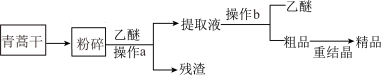
I.该兴趣小组的实验流程如图所示: 前要对青蒿干进行粉碎,其目的是
前要对青蒿干进行粉碎,其目的是_____________________ ,操作b的名称是______________ 。
(2)重结晶的操作步骤:加入 的乙醇溶液溶解
的乙醇溶液溶解
_______ 
_______  过滤、洗涤、干燥。
过滤、洗涤、干燥。
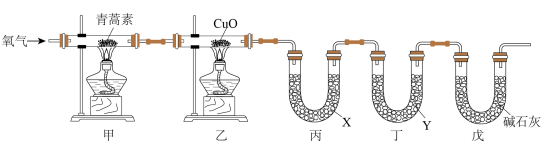
II.已知青蒿素是一种仅含有C、H、O三种元素的化合物,其相对分子质量为282。为确定其分子式,进行了如图实验:
①连接装置,检查装置气密性;
②称量装置丙、丁中仪器及药品的质量;
③取 青蒿素放入装置甲的硬质玻璃管中,点燃装置甲、乙中的酒精灯加热,充分反应;
青蒿素放入装置甲的硬质玻璃管中,点燃装置甲、乙中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后装置丙、丁中仪器及药品的质量。
(3)装置乙的作用是________________________________ ;装置丙、丁中吸收的生成物依次为________________ 、_________________ (填化学式)。
(4)实验测得有关数据如表所示:
则通过上述数据,可得出青蒿素的分子式为________________ 。
(5)装置戊的作用是________________ 。
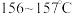 ,易溶于丙酮、乙醇和乙醚等有机溶剂,难溶于水。某校兴趣小组利用下列实验流程和实验装置提取青蒿素并确定其分子式。回答下列问题:
,易溶于丙酮、乙醇和乙醚等有机溶剂,难溶于水。某校兴趣小组利用下列实验流程和实验装置提取青蒿素并确定其分子式。回答下列问题:I.该兴趣小组的实验流程如图所示:
 前要对青蒿干进行粉碎,其目的是
前要对青蒿干进行粉碎,其目的是(2)重结晶的操作步骤:加入
 的乙醇溶液溶解
的乙醇溶液溶解

 过滤、洗涤、干燥。
过滤、洗涤、干燥。II.已知青蒿素是一种仅含有C、H、O三种元素的化合物,其相对分子质量为282。为确定其分子式,进行了如图实验:
①连接装置,检查装置气密性;
②称量装置丙、丁中仪器及药品的质量;
③取
 青蒿素放入装置甲的硬质玻璃管中,点燃装置甲、乙中的酒精灯加热,充分反应;
青蒿素放入装置甲的硬质玻璃管中,点燃装置甲、乙中的酒精灯加热,充分反应;④实验结束后冷却至室温,称量反应后装置丙、丁中仪器及药品的质量。
(3)装置乙的作用是
(4)实验测得有关数据如表所示:
装置 | 实验前(仪器+药品) | 实验后(仪器+药品) |
丙 | 54.0g | 73.8g |
丁 | 80.0g | 146.0g |
(5)装置戊的作用是
您最近一年使用:0次
3 . 已知R为短周期主族元素,一种白色钠盐M的组成用通式 表示.为了探究R元素,进行如下实验:
表示.为了探究R元素,进行如下实验:
(1)若向M溶液中滴加 溶液,产生白色沉淀,过滤,向白色沉淀中滴加过量的盐酸.产生无色无味气体,白色沉淀完全溶解.则M的阴离子符号为
溶液,产生白色沉淀,过滤,向白色沉淀中滴加过量的盐酸.产生无色无味气体,白色沉淀完全溶解.则M的阴离子符号为________ ,M的俗名是__________________ .
(2)若向M溶液中滴加 溶液,产生白色胶状物质,加热产生沉淀.写出离子方程式:
溶液,产生白色胶状物质,加热产生沉淀.写出离子方程式:__________________ .
(3)①若将M溶液滴入酸性 溶液中,溶液褪色;②若向M中滴加盐酸,将产生的气体通入品红溶液.溶液褪色.①中使溶液褪色的离子方程式为
溶液中,溶液褪色;②若向M中滴加盐酸,将产生的气体通入品红溶液.溶液褪色.①中使溶液褪色的离子方程式为___________ ,其中还原剂是______________ .加热②中褪色溶液,可能观察到的现象是________________ .
(4)若向M溶液中加入铜粉,无明显现象,再滴加稀硫酸后,溶液变蓝色,且产生的气体X和另一种单质气体Y通入足量水中恰好完全反应且属于化合反应.铜粉溶解的离子方程式为______________ .上述反应中,气体X、Y体积比为__________________ (同温同压下).
(5)若在M溶液中加入浓盐酸,产生黄绿色气体,用镊子夹取一片湿润的KI-淀粉试纸靠近该气体,试纸变蓝色.M的名称是_____________ .
 表示.为了探究R元素,进行如下实验:
表示.为了探究R元素,进行如下实验:(1)若向M溶液中滴加
 溶液,产生白色沉淀,过滤,向白色沉淀中滴加过量的盐酸.产生无色无味气体,白色沉淀完全溶解.则M的阴离子符号为
溶液,产生白色沉淀,过滤,向白色沉淀中滴加过量的盐酸.产生无色无味气体,白色沉淀完全溶解.则M的阴离子符号为(2)若向M溶液中滴加
 溶液,产生白色胶状物质,加热产生沉淀.写出离子方程式:
溶液,产生白色胶状物质,加热产生沉淀.写出离子方程式:(3)①若将M溶液滴入酸性
 溶液中,溶液褪色;②若向M中滴加盐酸,将产生的气体通入品红溶液.溶液褪色.①中使溶液褪色的离子方程式为
溶液中,溶液褪色;②若向M中滴加盐酸,将产生的气体通入品红溶液.溶液褪色.①中使溶液褪色的离子方程式为(4)若向M溶液中加入铜粉,无明显现象,再滴加稀硫酸后,溶液变蓝色,且产生的气体X和另一种单质气体Y通入足量水中恰好完全反应且属于化合反应.铜粉溶解的离子方程式为
(5)若在M溶液中加入浓盐酸,产生黄绿色气体,用镊子夹取一片湿润的KI-淀粉试纸靠近该气体,试纸变蓝色.M的名称是
您最近一年使用:0次
4 . 某温度下,在1L恒容真空密闭容器中充入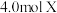 ,发生反应:
,发生反应: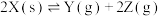 ,有关数据如下,下列说法正确的是
,有关数据如下,下列说法正确的是
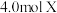 ,发生反应:
,发生反应: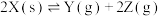 ,有关数据如下,下列说法正确的是
,有关数据如下,下列说法正确的是| 时间段/s | 产物Z的平均生成速率/( ) ) |
| 0~20 | 0.10 |
| 0~40 | 0.075 |
| 0~60 | 0.05 |
A.第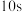 时,Y的浓度等于 时,Y的浓度等于 |
B.第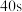 时,Y的体积分数为33.3% 时,Y的体积分数为33.3% |
| C.X的平衡转化率一定为75% |
| D.容器内气体的平均相对分子质量不再变化时,达到化学反应的限度 |
您最近一年使用:0次
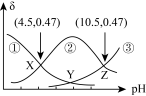
5 . 已知 是一种有机二元弱碱。常温下,某溶液中
是一种有机二元弱碱。常温下,某溶液中 、
、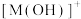 、
、 的物质的量浓度之和为0.1
的物质的量浓度之和为0.1 ,常温下测得溶液中含M微粒的分布系数(
,常温下测得溶液中含M微粒的分布系数( )随pH变化如图所示。下列说法错误的是
)随pH变化如图所示。下列说法错误的是
 是一种有机二元弱碱。常温下,某溶液中
是一种有机二元弱碱。常温下,某溶液中 、
、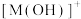 、
、 的物质的量浓度之和为0.1
的物质的量浓度之和为0.1 ,常温下测得溶液中含M微粒的分布系数(
,常温下测得溶液中含M微粒的分布系数( )随pH变化如图所示。下列说法错误的是
)随pH变化如图所示。下列说法错误的是
A.曲线②表示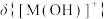 |
| B.Y点对应的溶液呈弱碱性 |
C.若pH=11时,溶液中 ,则 ,则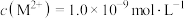 |
D.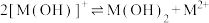 的平衡常数 的平衡常数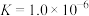 |
您最近一年使用:0次
解题方法
6 . 随着聚酯工业的快速发展, 的需求量和HCl的产出量也随之迅速增长。Deacon发明了直接氧化HCl制备
的需求量和HCl的产出量也随之迅速增长。Deacon发明了直接氧化HCl制备 的反应:
的反应: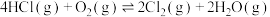 。如图为某刚性容器中,进料浓度比
。如图为某刚性容器中,进料浓度比
 分别等于1∶1、4∶1、7∶1时,HCl的平衡转化率随温度变化的关系。下列关于该反应的说法正确的是
分别等于1∶1、4∶1、7∶1时,HCl的平衡转化率随温度变化的关系。下列关于该反应的说法正确的是

 的需求量和HCl的产出量也随之迅速增长。Deacon发明了直接氧化HCl制备
的需求量和HCl的产出量也随之迅速增长。Deacon发明了直接氧化HCl制备 的反应:
的反应: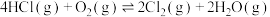 。如图为某刚性容器中,进料浓度比
。如图为某刚性容器中,进料浓度比
 分别等于1∶1、4∶1、7∶1时,HCl的平衡转化率随温度变化的关系。下列关于该反应的说法正确的是
分别等于1∶1、4∶1、7∶1时,HCl的平衡转化率随温度变化的关系。下列关于该反应的说法正确的是
A.相同条件下,升高温度可以提高 的产率 的产率 |
B.曲线Ⅰ表示进料浓度比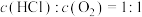 |
C.进料浓度比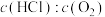 越大,平衡常数K越小 越大,平衡常数K越小 |
| D.该反应在低温条件下更易自发进行 |
您最近一年使用:0次
名校
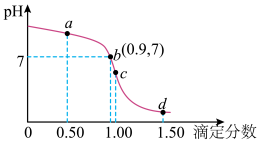
7 . 25℃时,用 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数),b点的坐标(0.9,7)。下列说法错误的是
氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数),b点的坐标(0.9,7)。下列说法错误的是
 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数),b点的坐标(0.9,7)。下列说法错误的是
氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数),b点的坐标(0.9,7)。下列说法错误的是
A.起点溶液中水电离出的 小于 小于 |
| B.温度升高,氨水的电离平衡向右移动 |
C.滴定过程,溶液中 不变 不变 |
D.25℃时,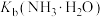 的数量级为 的数量级为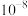 |
您最近一年使用:0次
8 . 某澄清水样中可能含有的离子如表:
为检测其成分、某化学兴趣小组用3个小试管分别取少许水样,记作水样①、水样②、水样③.做了如下实验:
ⅰ、向水样①中加入几滴KSCN溶液,无明显变化。
ⅱ.向水样②中加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色;再向反应后所得的溶液中加入 溶液,有白色沉淀生成;将上述无色气体通入足量
溶液,有白色沉淀生成;将上述无色气体通入足量 溶液中,无明显变化。
溶液中,无明显变化。
ⅲ.向水样③中加入过量NaOH溶液,仅有白色沉淀生成,静置一段时间,白色沉淀最终变为红褐色,取上层无色透明溶液,逐滴加入稀盐酸,开始无明显现象,后产生白色沉淀,继续滴加稀盐酸,白色沉淀又全部溶解。
请回答下列问题:
(1)由以上实验可判断,该水样中一定不含有的阳离子是______ (写离子符号,下同),一定不含有的阴离子是______ 。
(2)在水样②的实验过程中生成无色气体的氧化还原反应的离子方程式为____________ 。无色气体遇空气变成红棕色的原因为____________ (用化学方程式表示),该反应属于四种基本反应类型中的______ 反应。
(3)水样③的实验中,滴加稀盐酸时生成白色沉淀的离子方程式为____________ .
(4)实验室中检验 存在的方法为
存在的方法为______ 。
(5)若水样中存在的阳离子的浓度均为1 mol⋅L ,阴离子浓度相等且为整数,则溶液中
,阴离子浓度相等且为整数,则溶液中______ (填“存在”或“不存在”) ,理由是
,理由是____________ 。
阳离子 |
|
阴离子 |
|
ⅰ、向水样①中加入几滴KSCN溶液,无明显变化。
ⅱ.向水样②中加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色;再向反应后所得的溶液中加入
 溶液,有白色沉淀生成;将上述无色气体通入足量
溶液,有白色沉淀生成;将上述无色气体通入足量 溶液中,无明显变化。
溶液中,无明显变化。ⅲ.向水样③中加入过量NaOH溶液,仅有白色沉淀生成,静置一段时间,白色沉淀最终变为红褐色,取上层无色透明溶液,逐滴加入稀盐酸,开始无明显现象,后产生白色沉淀,继续滴加稀盐酸,白色沉淀又全部溶解。
请回答下列问题:
(1)由以上实验可判断,该水样中一定不含有的阳离子是
(2)在水样②的实验过程中生成无色气体的氧化还原反应的离子方程式为
(3)水样③的实验中,滴加稀盐酸时生成白色沉淀的离子方程式为
(4)实验室中检验
 存在的方法为
存在的方法为(5)若水样中存在的阳离子的浓度均为1 mol⋅L
 ,阴离子浓度相等且为整数,则溶液中
,阴离子浓度相等且为整数,则溶液中 ,理由是
,理由是
您最近一年使用:0次
2023-12-27更新
|
181次组卷
|
4卷引用:山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷
名校
解题方法
9 . 某溶液可能含有 、
、 、
、 、
、 、
、 和
和 。(已知
。(已知 )取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀2.14g;向上述滤液中加足量
)取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀2.14g;向上述滤液中加足量 溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
 、
、 、
、 、
、 、
、 和
和 。(已知
。(已知 )取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀2.14g;向上述滤液中加足量
)取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀2.14g;向上述滤液中加足量 溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中| A.至少存在5种离子 | B. 一定存在,且 一定存在,且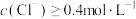 |
C. 、 、 一定存在, 一定存在, 可能不存在 可能不存在 | D. 一定不存在, 一定不存在, 可能存在 可能存在 |
您最近一年使用:0次
名校
10 . 氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:

已知:①稀土离子易与 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:
发生反应: ;
;
②硫脲: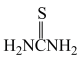 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是___________ (填写化学式)。
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式___________ 。
(3)焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是______ 。
(4)加入硫脲的目的是将CeF22+还原为Ce3+,反应的离子方程式为___________ 。
(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为___________ 。
(6)下列关于步骤④的说法正确的是___________(填字母)。
(7)取所得产品7.00gCeO2溶解后配成250mL溶液。取25.00mL该溶液用0.20mol。L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,滴定时发生反应 ,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为___________ 。(保留三位有效数字)。

已知:①稀土离子易与
 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:
发生反应: ;
;②硫脲:
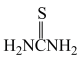 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式
(3)焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是
(4)加入硫脲的目的是将CeF22+还原为Ce3+,反应的离子方程式为
(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(6)下列关于步骤④的说法正确的是___________(填字母)。
A.该步骤发生的反应是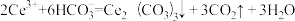 |
| B.可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度 |
| C.过滤时选择减压过滤能够大大提高过滤效率 |
| D.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率 |
(7)取所得产品7.00gCeO2溶解后配成250mL溶液。取25.00mL该溶液用0.20mol。L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,滴定时发生反应
 ,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为
您最近一年使用:0次

 、
、 、
、
 、
、


