名校
解题方法
1 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.某化学课外小组的同学通过铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下农是实验过程中的数据及相关信息:
(注:气体体积均在相同条件下测得)
(1)实验①和②探究盐酸浓度对反应速率的影响,即V1为_______ mL;实验②和③探究_______ 对反应速率的影响。
(2)实验室在制氢气时,可在锌和盐酸反应的容器中加入少量硫酸铜固体,目的是_______ (用文字表达)。
(3)分析其中一组实验,发现产生氢气的速率随时间的变化情况都是开始速率慢慢增大,后来慢慢减小。前期速率慢慢增大的主要原因是_______ ,后期速率慢慢减小的主要原因是_______ 。
Ⅱ.研究NOx、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
(4)一定温度下,在恒容的密闭容器中充入lmolCO和2molH2,发生CO(g)+ 2H2(g) CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
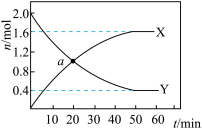
(5)利用反应2NO(g)+2CO(g) N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
①X代表的物质是_______ ;a点正反应速率_______ 逆反应速率(填“>”、“<”或“=”)。_______ 。
Ⅰ.某化学课外小组的同学通过铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下农是实验过程中的数据及相关信息:
| 序号 | 反应温度/℃ | c(HCl)/(mol/L) | V(HCl)/mL | V(H2O)/mL | 10gFe的形状 | t/min |
| ① | 20 | 2 | 5 | V1 | 块状 | 1 |
| ② | 20 | 2 | 10 | 0 | 块状 | 1 |
| ③ | 20 | 2 | 10 | 0 | 粉末 | 1 |
| ④ | 40 | 2 | 10 | 0 | 块状 | 1 |
(1)实验①和②探究盐酸浓度对反应速率的影响,即V1为
(2)实验室在制氢气时,可在锌和盐酸反应的容器中加入少量硫酸铜固体,目的是
(3)分析其中一组实验,发现产生氢气的速率随时间的变化情况都是开始速率慢慢增大,后来慢慢减小。前期速率慢慢增大的主要原因是
Ⅱ.研究NOx、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
(4)一定温度下,在恒容的密闭容器中充入lmolCO和2molH2,发生CO(g)+ 2H2(g)
 CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。| A.反应过程中n(CO)∶n(H2)不变 |
| B.(升高温度,正反应速率减小 |
| C.往容器中充入He,压强增大,反应速率加快 |
| D.容器内混合气体的平均摩尔质量保持不变时说明反应已达平衡 |
(5)利用反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。①X代表的物质是
您最近一年使用:0次
名校
解题方法
2 . 化学反应中的热量问题,对于化工生产有重要的意义
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=_______ kJ/mol。
(2)已知在微生物作用条件下, 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:_______ 。
(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为_______ (填“吸热”或“放热”)反应。 _______ kJ(用含a、b、c、d的代数式表示)。
(4)室温下,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示装置中进行中和反应。回答下列问题:_______ ,保持其他条件不变,实验中改用100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液进行反应,与上述实验相比,二者所测的中和热_______ (填“相等”或“不相等”),原因是_______ 。
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为_______ 。
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=_______ kJ/mol(已知该温度下水的比热容:c=4.18J/(g·℃),保留三位有效数字)。
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=
(2)已知在微生物作用条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。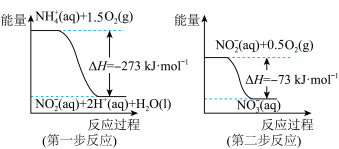
 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为
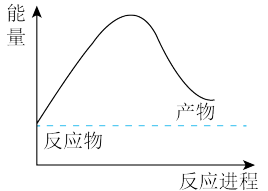
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
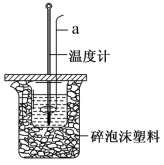
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=
您最近一年使用:0次
名校
解题方法
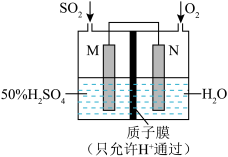
3 . 利用电化学装置原理可以设计出许多应用于环境保护、化学品提取的装置。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。_______ 极, 电极b表面发生的电极反应为_______ 。
(2)可用电化学原理处理SO2制备硫酸并提供电能,装置如图,电极为多孔材料。写出M极的电极方程式:_______ ,外电路中电流方向为:_______ (填“从M到N”或者“从N到M”)_______ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。

(2)可用电化学原理处理SO2制备硫酸并提供电能,装置如图,电极为多孔材料。写出M极的电极方程式:

您最近一年使用:0次
名校
解题方法
4 . 氮化铬(CrN)熔点高、硬度大,常用作耐磨材料。某小组在实验室用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬。已知:①CCl4的沸点是76.8℃;
②COCl2有毒,遇水生成HCl和CO2;③CrCl3易溶于水且易与水反应。
【实验一】制备无水氯化铬反应原理为: ,相关实验装置如下图(夹持装置略)。
,相关实验装置如下图(夹持装置略)。
a.水浴加热并维持A的温度在60~65℃
b.打开K,通入N2并保证锥形瓶中每分钟有250个左右的气泡逸出
c.点燃B处酒精喷灯,使瓷舟温度升至720℃左右,反应一定时间
d.一段时间后停止通入N2
e.先后停止加热A、B,冷却,并继续通入一段时间的N2
(1)上述操作步骤的先后顺序为:a→__________ 。
(2)A使用水浴加热的优点是_______ 。
(3)D中盛有过量NaOH溶液,用化学反应方程式说明D的作用:_______ 。
【实验二】制备氮化铬:其反应原理为 。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。
。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。_______ 。
(5)H中盛放碱石灰,其作用是_______ 。
(6)实验过程中需间歇性微热b处导管的目的是_______ 。(写出必要的化学方程式并解释)
②COCl2有毒,遇水生成HCl和CO2;③CrCl3易溶于水且易与水反应。
【实验一】制备无水氯化铬反应原理为:
 ,相关实验装置如下图(夹持装置略)。
,相关实验装置如下图(夹持装置略)。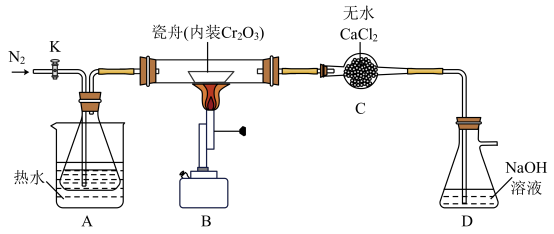
a.水浴加热并维持A的温度在60~65℃
b.打开K,通入N2并保证锥形瓶中每分钟有250个左右的气泡逸出
c.点燃B处酒精喷灯,使瓷舟温度升至720℃左右,反应一定时间
d.一段时间后停止通入N2
e.先后停止加热A、B,冷却,并继续通入一段时间的N2
(1)上述操作步骤的先后顺序为:a→
(2)A使用水浴加热的优点是
(3)D中盛有过量NaOH溶液,用化学反应方程式说明D的作用:
【实验二】制备氮化铬:其反应原理为
 。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。
。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。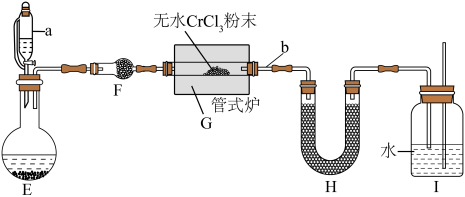
(5)H中盛放碱石灰,其作用是
(6)实验过程中需间歇性微热b处导管的目的是
您最近一年使用:0次
名校
解题方法
5 . 一定条件下,反应H2(g)+Br2(g) 2HBr(g)的速率方程为v=kca(H2)·cb(Br2) ·cz(HBr),某温度下,该反应在不同浓度下的反应速率如下:
2HBr(g)的速率方程为v=kca(H2)·cb(Br2) ·cz(HBr),某温度下,该反应在不同浓度下的反应速率如下:
根据表中的测定结果,下列结论错误的是
 2HBr(g)的速率方程为v=kca(H2)·cb(Br2) ·cz(HBr),某温度下,该反应在不同浓度下的反应速率如下:
2HBr(g)的速率方程为v=kca(H2)·cb(Br2) ·cz(HBr),某温度下,该反应在不同浓度下的反应速率如下:| c(H2)/mol·L-l | c(Br2)/ mol·L-l | c(HBr)/ mol·L-l | 反应速率 |
| 0.1 | 0.1 | 2 | v |
| 0.1 | 0.4 | 2 | 8v |
| 0.2 | 0.4 | 2 | 16v |
| 0.4 | 0.1 | 4 | 2v |
| 0.2 | 0.1 | c | 4v |
| A.a的值为1 |
| B.表中c的值为2 |
| C.反应体系的三种物质中,Br2(g)的浓度对反应速率影响最大 |
| D.在反应体系中保持其他物质浓度不变,增大HBr(g)浓度,会使反应速率增大 |
您最近一年使用:0次
名校
解题方法
6 . 某探究活动小组根据侯德榜制碱原理,按下图所示实验装置设计方案制备少量碳酸氢钠。下列说法正确的是

| A.乙装置中盛放的是NaOH溶液 |
| B.丙装置中的溶液变浑浊,因为有碳酸氢钠的晶体析出 |
| C.丁转置是为了吸收丙装置可能逸出的CO2,防止污染空气 |
| D.实验结束后,分离碳酸氢钠的操作是蒸发结晶、过滤 |
您最近一年使用:0次
名校
解题方法
7 . 可以证明可逆反
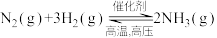 已达到平衡状态的是
已达到平衡状态的是
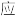
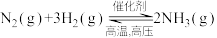 已达到平衡状态的是
已达到平衡状态的是| A.一个N≡N键断裂的同时,有3个H-H键断裂 |
| B.保持其它条件不变时,c(N2):c(H2)=1:3 |
| C.恒温恒容时,密度保持不变 |
| D.正反应速率v(H2)=0.6mol/L·min),逆反应速率v(NH3)=0.4 mol/L·min) |
您最近一年使用:0次
名校
解题方法
8 . 离子方程式是化学的专业用语,下列叙述对应的离子方程式书写正确的是
A.用强碱性溶液吸收二氧化氮;2NO2+2OH-=2 +H2O +H2O |
B.向硫化钠溶液通入足量二氧化硫:S2-+2SO2+2H2O=H2S+2 |
C.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1:2混合:Ba2++2OH-+2H++ =BaSO4↓+2H2O =BaSO4↓+2H2O |
D.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++ =3Fe3++2H2O+NO↑ =3Fe3++2H2O+NO↑ |
您最近一年使用:0次
名校
9 . 2018年第26届国际计最大会通过用阿伏加德罗常数来定义物质的量,NA为阿伏加德罗常数的值。下列说法正确的是
| A.6.4g铜与足量浓硝酸充分反应,生成的NO2在标况下体积约为4.48L |
| B.常温下,将2.7g铝片投入足量的浓硝酸中,铝失去的电子数为0.3NA |
| C.一定条件下,lmolN2与足量H2充分反应,生成的NH3分子数为2NA |
| D.常温下,将28g铁片投入足量的稀硝酸中,转移的电子数为1.5NA |
您最近一年使用:0次
名校
10 . 化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大___________ min(填“0~1”、“1~2”、“2~3”、“3~4”或“4~5”)。
②另一位同学认为在盐酸中滴入少量的CuSO4溶液可以加快反应的速率,请从原电池的角度给予分析:构成的原电池中负极反应式为___________ ,溶液中H+移向___________ (填“正”或“负”)极。
(2)某温度下在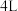 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:___________ mol/L,该反应的化学方程式是___________ 。
②5min时,Z的生成速率___________ (填“大于”、“小于”或“等于”)6min时Z的生成速率。
③若升高温度,则逆反应速率___________ (填“增大”、“减小”或“不变”)。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在
 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 109 | 220 | 332 | 412 | 480 |
②另一位同学认为在盐酸中滴入少量的CuSO4溶液可以加快反应的速率,请从原电池的角度给予分析:构成的原电池中负极反应式为
(2)某温度下在
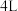 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
②5min时,Z的生成速率
③若升高温度,则逆反应速率
您最近一年使用:0次



