1 . 按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物:

| A | B |
|
|
| 步骤① | 步骤② |
| C | D |
|
|
| 步骤③ | 步骤④ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
昨日更新
|
80次组卷
|
17卷引用:重庆市松树桥中学校2023-2024学年高二下学期期中考试化学试题
重庆市松树桥中学校2023-2024学年高二下学期期中考试化学试题上海市晋元高级中学2021-2022学年高一上学期期中考试化学试题上海交通大学附属中学2021-2022学年高一上学期期中测试化学试题福建省泉州第一中学2022-2023学年高三上学期期中考试化学试题广东省珠海市斗门区第一中学2022-2023学年高二下学期期中考试化学试题安徽省蚌埠第二中学2023-2024学年高二下学期5月期中考试化学试题山东省济南市历城区第一中学2020届高三12月检测化学试题江西省南昌市进贤县第一中学2020-2021学年高二下学期第二次月考化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一上学期10月学业质量检测化学试题(已下线)专题34 基本实验仪器和基本操作(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练山东省枣庄市滕州市第一中学2022-2023学年高三上学期10月考试化学试题上海市华东师范大学附属东昌中学2022-2023学年高一上学期12月阶段考化学试题广东省深圳市盐田高级中学2022-2023学年高二下学期第一次月考化学试题 江西省宜春市宜丰中学2022-2023学年高二下学期3月月考化学试题(已下线)第02讲 研究有机化合物的一般方法-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)广东省深圳市盐田高级中学2023-2024学年高二下学期4月月考化学试题浙江省杭州市学军中学2023-2024学年高三下学期5月阶段性考试
名校
2 . 在体积固定为2 L的密闭容器中投入一定量的A和B,两种气体的物质的量浓度随时间变化的曲线如图所示,已知物质C也为气体。则:___________ (填“>”、“<”或“=”)逆反应速率;该反应达到最大限度的时间是___________ s。经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为___________ 。
(2)从反应开始到12 s内,A的转化率为___________ 。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,反应相同时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3 mol·L-1·s-1;乙:v(B)=0.12 mol·L-1·s-1;丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为___________ (用甲、乙、丙表示)。
(4)一定能够判断该反应达到平衡状态的依据是___________ (填选项)。
A.该条件下,混合气体的密度不再发生变化
B.该条件下,混合气体的压强不再发生变化
C.该条件下,单位时间内消耗3 mol A的同时生成2 mol C
D.该条件下,n(A):n(B):n(C)=2:3:4
E.该条件下,混合气体颜色不再发生变化
(5)为加快上述反应速率的,可以改变的外界条件是___________ (写出一种即可)。
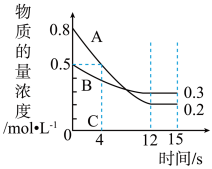
(2)从反应开始到12 s内,A的转化率为
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,反应相同时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3 mol·L-1·s-1;乙:v(B)=0.12 mol·L-1·s-1;丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(4)一定能够判断该反应达到平衡状态的依据是
A.该条件下,混合气体的密度不再发生变化
B.该条件下,混合气体的压强不再发生变化
C.该条件下,单位时间内消耗3 mol A的同时生成2 mol C
D.该条件下,n(A):n(B):n(C)=2:3:4
E.该条件下,混合气体颜色不再发生变化
(5)为加快上述反应速率的,可以改变的外界条件是
您最近一年使用:0次
名校
3 . 如图是金属和卤素单质X2反应的能量变化示意图,下列说法正确的是
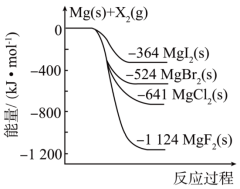
| A.稳定性:MgF2(s)>MgCl2(s)>MgBr2(s)>MgI2(s) |
| B.由MgI2(s)转化为MgCl2(s)需要吸收能量 |
| C.22.4 L F2(g)与足量Mg反应生成MgF2(s)放热1124 kJ |
| D.由图可知,MgBr2(s)分解吸收的能量比MgCl2(s)多 |
您最近一年使用:0次
7日内更新
|
113次组卷
|
2卷引用:重庆市万州二中2023-2024学年高一下学期期中考试化学试题
名校
解题方法
4 . 工业制备高纯硅的主要过程如下,其中下列说法正确的是
石英砂 粗硅
粗硅 高纯硅
高纯硅
石英砂
 粗硅
粗硅 高纯硅
高纯硅| A.单晶硅是应用广泛的半导体材料,常用来生产光导纤维 |
B.制备粗硅的反应方程式为SiO2+C Si+CO2↑ Si+CO2↑ |
| C.原料气HCl和H2应充分去除水和氧气 |
| D.原料气中仅HCl可循环利用 |
您最近一年使用:0次
7日内更新
|
82次组卷
|
2卷引用:重庆市万州二中2023-2024学年高一下学期期中考试化学试题
名校
解题方法
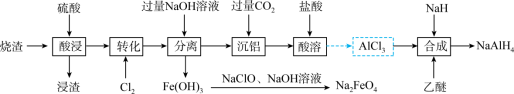
5 . NaAlH4是常用的还原剂;Na2FeO4常做净水剂和消毒剂。工业上以制备硫酸的烧渣(主要成分为Fe3O4、Fe2O3和Al2O3含少量SiO2)为原料制备NaAlH4和Na2FeO4的流程如下:
(1)NaAlH4中氢的化合价为___________ 。
(2)浸渣的主要成分是___________ (填化学式);“转化”中Cl2的作用是___________ (用离子方程式表示)。
(3)由Fe(OH)3制备Na2FeO4的离子方程式为___________ ;“分离”中铝元素转化成___________ (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是___________ 。
(5)“合成”中乙醚作溶剂,该过程发生反应的化学方程式为___________ 。
(6)“有效氢”指单位质量(1 g)含氢还原剂的还原能力相当于多少克氢气的还原能力,一般含氢还原剂的氢被氧化成H2O。则NaAlH4有效氢含量为___________ (计算结果保留三位有效数字)。
(1)NaAlH4中氢的化合价为
(2)浸渣的主要成分是
(3)由Fe(OH)3制备Na2FeO4的离子方程式为
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是
(5)“合成”中乙醚作溶剂,该过程发生反应的化学方程式为
(6)“有效氢”指单位质量(1 g)含氢还原剂的还原能力相当于多少克氢气的还原能力,一般含氢还原剂的氢被氧化成H2O。则NaAlH4有效氢含量为
您最近一年使用:0次
7日内更新
|
109次组卷
|
2卷引用:重庆市万州二中2023-2024学年高一下学期期中考试化学试题
名校
6 . Ⅰ.某同学完成了如下系列实验,探究元素周期表中元素性质的递变规律.
(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:___________ 与硫酸反应速率最慢,___________ 与硫酸反应产生的气体最多;(填元素符号)
(2)向 溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为
溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为___________ 。
Ⅱ.验证主族元素非金属性的变化规律设计了如图装置
(3)某研究小组想用该装置一次性验证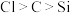 的非金属性的变化规律,则装置A、C中所装药品分别为
的非金属性的变化规律,则装置A、C中所装药品分别为___________ 、___________ .该实验采用的理论依据为___________ ;
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:___________ ;
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂 .
. 为
为___________ (填“一”、“二”或“三”)元酸.
(6)不考虑产物的损失,标准状况下若有 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成___________ 升 气体.
气体.
(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:
(2)向
 溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为
溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为Ⅱ.验证主族元素非金属性的变化规律设计了如图装置
(3)某研究小组想用该装置一次性验证
 的非金属性的变化规律,则装置A、C中所装药品分别为
的非金属性的变化规律,则装置A、C中所装药品分别为
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂
 .
.
 为
为(6)不考虑产物的损失,标准状况下若有
 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成 气体.
气体.
您最近一年使用:0次
7日内更新
|
29次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一下学期5月期中考试化学试题
名校
7 . 《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示。下列说法正确的是
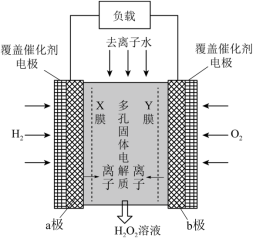
| A.该装置可实现由化学能向电能的转化 |
| B.a极为正极,发生还原反应 |
| C.X膜为阴离子交换膜(只允许阴离子通过) |
| D.当外电路通过4 mol e-时,消耗22.4 L O2(标准状况下) |
您最近一年使用:0次
7日内更新
|
94次组卷
|
2卷引用:重庆市万州二中2023-2024学年高一下学期期中考试化学试题
名校
解题方法
8 . 下列叙述不正确的是
| A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得有机物有6种 |
| B.分子式为C4H8Cl2的有机物只含一个甲基的结构有共有8种(不考虑立体异构) |
| C.含有5个碳原子的某饱和链烃,其一氯取代物可能有3种 |
D.菲的结构简式为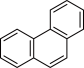 ,其一硝基取代物有5种 ,其一硝基取代物有5种 |
您最近一年使用:0次
9 . 利用CO2合成甲醇(CH3OH)是实现碳中和的措施之一,其反应方程式为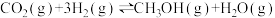 。回答下列问题:
。回答下列问题:
(1)CO2合成甲醇的能量变化如图所示。_______ 反应(填“放热”或“吸热”),反应物的化学键断裂所吸收的总能量_______ 生成物的化学键形成所释放的总能量(填“大于”或“小于”)。
(2)向2L恒容密闭容器中加入4molCO2、10molH2,恒温下发生反应,测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。_______ 逆反应速率(填“>”、“<”或“=”)。
②0~9min内,用H2表示的平均反应速率v(H2)=_______ mol·L-1·min-1。
③下列能说明反应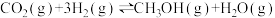 达到平衡状态的是
达到平衡状态的是_______ (填标号)。
A.混合气体的密度保持不变 B.3v正(CH3OH)=v逆(H2)
C.c(CH3OH)=c(H2O) D.2molC=O键断裂的同时生成3molH-H键
(3)以甲醇作燃料的燃料电池如图所示。_______ (填“甲醇”或“空气”);正极的电极反应式为_______ 。
②若有1molCO2生成,理论上通过质子交换膜的H+的物质的量为_______ 。
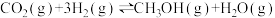 。回答下列问题:
。回答下列问题:(1)CO2合成甲醇的能量变化如图所示。

(2)向2L恒容密闭容器中加入4molCO2、10molH2,恒温下发生反应,测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。

②0~9min内,用H2表示的平均反应速率v(H2)=
③下列能说明反应
 达到平衡状态的是
达到平衡状态的是A.混合气体的密度保持不变 B.3v正(CH3OH)=v逆(H2)
C.c(CH3OH)=c(H2O) D.2molC=O键断裂的同时生成3molH-H键
(3)以甲醇作燃料的燃料电池如图所示。
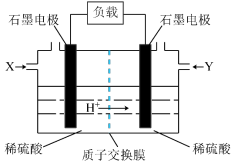
②若有1molCO2生成,理论上通过质子交换膜的H+的物质的量为
您最近一年使用:0次
名校
解题方法
10 . A~G的转化关系如图1所示(部分产物略去),其中E为红棕色气体,G为单质。常温下,将Al片浸在不同质量分数的C溶液中,经过相同时间的腐蚀后,Al片的质量损失情况如图2所示。
(1)A的化学式为_______ 。
(2)实验室中常用_______ 检验B,现象是_______ 。
(3)反应④、⑤的化学方程式依次为_______ 、_______ 。
(4)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为_______ 。
(5)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68 LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5 mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是_______ mL。
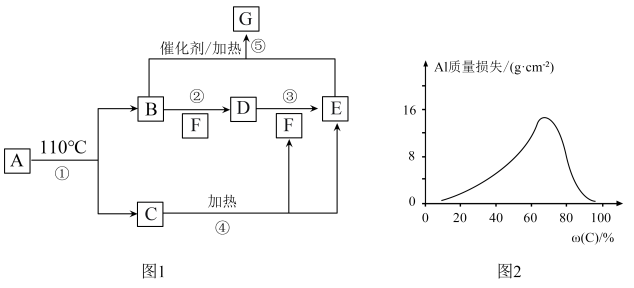
(1)A的化学式为
(2)实验室中常用
(3)反应④、⑤的化学方程式依次为
(4)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为
(5)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68 LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5 mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是
您最近一年使用:0次







